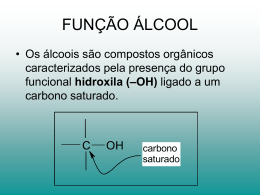
Álcoois e éteres Estrutura de álcoois Grupo funcional hidroxi (OH) Oxigénio tem hibridação sp3 Classificação Primário: carbono ligado ao grupo –OH está ligado a outro carbono. Secundário: carbono ligado ao grupo –OH está ligado a dois carbonos. Terciário: carbono ligado ao grupo –OH está ligado a três carbonos. Aromático (fenol): -OH está ligado a carbono aromático. Nomes comuns Álcool pode ser nomeado por álcool alquílico. Útil só para grupos alquilicos pequenos. Exemplos: CH3 CH3 CH CH2OH isobutil álcool OH CH3 CH CH2CH3 sec-butil álcool Alcoois - Nomenclatura Exemplos: OH OH Eth anol (Ethyl alcoh ol) OH 1-Propan ol (Propyl alcohol) 2-Prop anol (Is op ropyl alcohol) OH OH 1-Butanol (Butyl alcohol) OH 2-Bu tan ol (s ec-Bu tyl alcohol) OH 2-Methyl-1-propanol (Is ob utyl alcoh ol) OH Cyclohexanol 2-Methyl-2-prop anol (t ert-Butyl alcohol) (Cyclohexyl alcohol) Alcoois - Nomenclatura Problema: escreva o nome para cada composto (a) CH3 ( CH2 ) 6 CH2 OH OH (b) OH (c) Alcoois - Nomenclatura Alcoois insaturados A dupla ligação é demonstrada pelo infix -en-. O grupo hidroxi é demonstrada pelo sufixo -ol. Numeração da cadeia de modo a dar ao grupo OH o número mais baixo. 6 4 5 3 2 1 OH trans-3-hexen e-1-ol (E)-3-h exene-1-ol Propriedades físicas Pontes de ebulição altos devido a pontes de hidrogénio entre as moléculas. Pequenos álcoois são miscíveis com a água, mas a solubilidade diminui à medida que o tamanho dos grupos alquilo aumenta. Pontos de ebulição Alcoois têm pontos de ebulição mais altos e são mais solúveis em água que os alcanos semelhantes em peso molecular. Pontos de ebulição H + C H H O + H Solubilidade em água Solubilidade diminui à medida que o grupo alquilo aumenta Acidez dos álcoois pKa varia entre: 15.5-18.0 (água: 15.7) Acidez diminui à medida que o grupo alquilo aumenta. A presença de halogénios aumenta a acidez. Fenol é 100 milhões de vezes mais acidico que o ciclohexanol. Acidez dos álcoois Valores de pKa para alguns álcoois Basicidade dos álcoois Em presença de ácidos fortes, o átomo de oxigénio de um álcool comporta-se como uma base fraca. H2 SO4 + + + H O H CH3 CH2 -O H + O H CH3 CH2 -O-H •• H H H Ethanol Hydronium ion Ethyloxonium ion (pK a -1.7) (pK a -2.4) Portanto, álcoois podem funcionar quer como ácidos fracos quer como bases fracas. Reactividade Reacção com metais activos Alcoois reagem com Li, Na, K, e outros metais activos para libertar hidrogénio gasoso e forma alcóxidos de metal. Na é oxidado a Na+ e H+ é reduzido a H2. 2 CH3 CH2 OH + 2 Na 2 CH3 CH2 O-Na+ + H2 Sodiu m eth oxid e Alcóxidos são bases mais fortes que o OH-. Alcóxidos podem ser usados como nucleófilos na substituição nucleofilica. Podem ser usados como bases nas reacções de b-eliminação. Conversão do ROH a RX Conversão de um álcool a haleto de alquilo envolve a substituição do halogénio por -OH no carbono saturado. Os reagentes mais comuns para este proposito são ácidos de halogénio, HX, e o cloreto de tionilo, SOCl2. Conversão do ROH a RX Álcoois 3º que são solúveis em água reagem com HCl, HBr, e HI. CH3 25°C CH3 COH + HCl CH3 2-Methyl-2prop anol CH3 CH3 CCl + H2 O CH3 2-Chloro-2methylpropane Álcoois 1º e 2º de baixo peso molecular não reagem nestas condições. Conversão do ROH a RX Álcoois 3° insolúveis em água reagem borbulhando HCl gasoso através de uma solução de álcool dissolvido em éter etilico ou THF. OH CH3 1-Methylcyclohexanol + HCl 0°C eth er Cl + H2 O CH3 1-Chloro-1-methyl cyclohexan e Álcoois 1° e 2° requerem HBr e HI concentrado para formar brometos e iodetos de alquilo OH 1-Butanol + HBr Br + H2 O 1-Bromobutan e (Butyl bromide) Reacção do ROH 3° com HX Álcoois 3° reagem com HX por o mecanismo SN1 Passo 1: reacção ácido-base reversivel transfere o protão do grupo OH. CH3 ••+ CH3 -C O H + H O H •• H CH 3 2-Methyl-2-prop anol (t ert -Bu tyl alcoh ol) CH3 H + + CH3 -C O CH H 3 •• • • •• rapid an d reversib le O H H A n oxon ium ion Este protão converte o grupo OH-, um grupo abandonante fraco, a H2O, um melhor grupo abandonante. Reacção do ROH 3° com HX Passo 2: Perda de H2O do ião oxonium para dar um carbocatião 3° como intermediário. CH3 H + CH3 -C O CH H slow , rate determining SN 1 3 A n oxon ium ion CH3 + CH3 -C + CH3 A 3° carbocation in termediate O H H Passo 3: Reacção com o ião haleto completa a reacção. CH3 + CH3 -C CH3 + Cl fast CH3 CH3 -C Cl CH3 2-Chloro-2-methylprop ane (t ert -Bu tyl ch loride) Reacção do ROH 1° com HX Álcoois 1° reagem por mecanismo SN2. Passo 1: Transferência de protão para o OH converte o grupo abandonante OH- (um mau grupo abandonante) a H2O, um melhor grupo abandonante. + + OH H O H rapid and reversible H + O H H An oxonium ion H O H Passo 2: Deslocamento nucleofilico do H2O pelo Br-. Br - + O H slow , rate H determinin g SN2 Br + O H H Reacção do ROH com HX Reacções são governadas por uma combinação de efeitos electrónicos e estericos. governed by steric factors n ever react by SN 2 Increas ing rate of dis placement of H2 O 3° alcoh ol SN 1 2° alcohol Increas ing rate of carbocati on formation governed by electronic factors SN 2 1° alcoh ol n ever react by SN 1 Reacção com SOCl2 Cloreto de tionilo, SOCl2, é o reagente mais usado para a conversão de álcoois a cloretos de alquilo. pyridine OH + SOCl 2 1-Hep tanol Thionyl ch loride Cl + SO2 + HCl 1-Chlorohep tane Reacção com cloreto de tionilo Produz cloreto de alquilo, SO2, HCl S liga-se a -OH, Cl- sai Cl- tira o H+ do grupo OH C-O quebra, enquanto o Cl- se transfere para C Deshidratação de álcoois O álcool pode ser convertido em alceno por eliminação do H + OH de átomos de carbono adjacentes (b-eliminação). Álcoois 1° podem ser aquecidos a temperatura elevada na presença de um catalisador ácido como o H2SO4 ou H3PO4. Álcoois 2° sofrem deshidratação a baixas temperaturas. Álcoois 3° normalmente requerem temperaturas um pouco acima da temperatura ambiente. Deshidratação de álcoois = eliminação O primeiro passo é a protonação do grupo hidroxilo. H H3C OH H2SO4 CH3 H3C O H CH3 A perda de água conduz à formação do carbocatião. H H3C O H - H2O CH3 H3C CH3 Deshidratação de álcoois = eliminação Segundo, a base remove o protão b centro de carbocatião. H3C b H H H3CHC CHCH3 CH3 + H2SO4 OSO3H Esta reacção é uma E1. O passo determinante da reacção é a formação do carbocatião. Deshidratação de álcoois = eliminação No caso de ter como escolha diferentes hidrogénios b, forma-se preferencialmente o alceno mais estável. CH3 H3PO4 H3C CH3CHCH2CH3 OH CH3 H2C CH + H3C H3C 84 % CH2 CH3 16 % Deshidratação de álcoois = eliminação Como resultado do mecanismo E1, a desidratação segue a seguinte ordem: R H R R OH > H OH > R H R R OH O reflecte a estabilidade do carbocatião intermediário. R R R H R > H R > R H Deshidratação de álcoois = eliminação Álcoois primários sofrem deshidratação via E2. Primeiro, contudo, gera-se um bom grupo abandonante. H + H OH O H Os passos seguintes, remoção da água e desprotonação tem lugar simultaneamente. OSO3H H H3C CH H O H H3C CH2 Reacções de deshidratação Em H2SO4 conc. produz alceno Forma-se carbocatião intermediário Produto formado segue a regra de Zaitsev Deshidratação bimolecular produz éter Baixa temp, 140°C ou inferior, favorece éter Alta temp, 180°C e acima, favorece alceno Mecanismo de deshidratação H OH CH3CHCH3 H2SO4 OH CH3CHCH3 CH3CHCH3 alcohol H2O CH2 CHCH3 + CH3OH H3O CH3 OH2 CH3 O CH3 H CH3OH H2O CH3OCH3 Diagrama de Energia, E1 Oxidação de álcoois Existem 3 tipos de álcoois: R R CH R CH2 OH OH R R' 10 C OH R 20 30 Deshidratação (oxidação) é possivel para 10 e 20 formando-se aldeídos e cetonas, respectivamente. O R O R H aldeído R' cetona Oxidação de álcoois Aldeídos podem ser oxidados a ácidos. O O R R H OH aldeido ácido Agentes de oxidação tipicos são o ácido crómico (H2CrO4) ou clorocromato piridinium (PCC). O - O H O Cr Cl HO Cr OH N O O chromic acid PCC Exemplos H2CrO4 OH ciclopentanol OH O ciclopentanone H2CrO4 O H butanol butanal OH O Ácido butanoico H2CrO4 Carbonos 1º, 2º, 3º Exemplos OH PCC O CH2Cl2 butanol H butanal PCC é o agente de oxidação mais selectivo. Oxidação pode ser parada a nível do aldeído. Éteres Éters - Estrutura O grupo funcional de um éter é o átomo de oxigénio ligado a dois átomos de carbono. Oxigénio tem uma hibridação sp3 com ângulos de ligação aproximadamente 109.5°. No éter dimetilico a ângulo da ligação é 110.3°. H H •• H C H O •• C H H Éteres - Nomenclatura IUPAC A cadeia hidrocarbonada mais longa do alcano parente O grupo -OR tem um substituinte alcoxi. Nomes comuns: Nome do grupo ligado ao oxigénio seguido da palavra éter. O Et 2 O Eth oxyethane (D i ethyl eth er) CH3 CH3 OCCH3 CH3 2-Metho xy-2-methy lpropane (methy l t ert -buty l ether, MTBE) OH OEt t rans-2-Etho xy cycl ohexanol Éteres - Nomenclatura Embora os éteres ciclicos tenham nome IUPAC, o seu nome comum é mais frequentemente usado. O O O O O Eth ylen e oxide Tetrahydrofu ran , THF Tetrahydropyran 1,4-D ioxane Éteres – Propriedades físicas Éteres são moléculas polares. Cada ligação C-O é covalente polar. Contudo, sómente forças atractivas fracas existem entre moléculas no estado líquido puro. Éteres – Propriedades físicas Pontos de ebulição de éteres são mais baixos que os dos álcoois. Éteres – Propriedades físicas Éteres são aceitadores de pontes de hidrogénio. Eles não são dadores de pontes de hidrogénio. Éteres - Propriedades físicas O efeito da ligação de hidrogénio é ilustrada comparando o ponto de ebulição do etanol e do éter dimetilico. CH3 CH2 OH Ethanol bp 78°C CH3 OCH3 Dimethyl ether bp -24°C Reacções dos éteres Éteres relembram os alcanos na sua resistência à reacção química. Não reagem com agentes oxidantes fortes como o ácido crómico, H2CrO4. Não são afectados pela maioria dos ácidos e bases a temperaturas moderadas. Porque são bons solventes e geralmente inertes à reacção química são usados como solventes nas reacções químicas. Epóxidos Epóxidos: é um éter ciclico no qual o oxigénio é um dos átomos do anel do anel de 3 membros. C C O Function al group of an epoxide H2 C CH2 O Ethylene oxide CH3 CH CH2 O Prop ylen e oxide Óxido de etileno é sintetizado apartir do etileno com O2. CH2 =CH2 Ethylen e + O2 Ag heat CH2 CH2 O Ethylen e oxid e Epóxidos Outros epóxidos podem ser sintetizados apartir do alceno por oxidação com ácido peroxicarboxilico, RCO3H. + Cyclohexene O RCOOH H CH2 Cl2 A peroxycarb oxylic acid O + O RCOH H 1,2-Epoxycyclohexane A carboxylic (Cyclohexen e oxid e) acid Reacções de epóxidos Éteres são geralmente não reactivos em solução aquosa. Epóxidos, contudo, reagem prontamente dado à tensão angular do anel de 3 membros. Da reacção de um epóxido com ácido forma-se um glicol. H + O + H2 O H 1,2-Epoxycyclopentane (Cyclopen tene oxid e) H OH OH trans-1,2-Cyclopentaned iol Outras aberturas do anel de epóxido O valor do epóxido deve-se ao número de nucleófilos que provoca a abertura do anel, e da combinação de grupos funcionais que podem ser sintetizados apartir dele. CH3 H2 C CH O Methyloxirane (Prop ylen e oxid e) NH3 H2 N b CH3 A b-aminoalcohol OH CH3 H2 O/ H3 O HO OH b CH3 + Na SH / H2 O HS OH b + A glycol A b-mercaptoalcohol Epóxidos como “bloco de construção” Formulas estruturais para duas drogas comuns, sendo cada uma sintetizada em parte apartir do óxido de etileno. CH3 O O N CH3 O CH3 N CH3 H2 N Procaine (Novocain e) D iph enhydramine (Benad ryl) FIM
Download