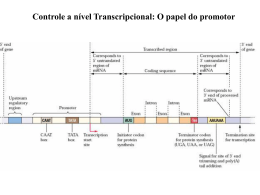
Caso Clinico 1: Maria, de 28 anos de idade, é filha do Sr. José (60 anos), que é afetado por ataxia espinocerebelar tipo 3 (SCA3), uma doença de herança autossômica dominante causada por expansões de trinucleotideos na região codificadora . Um tio paterno e duas tias paternas, já falecidos, tiveram SCA3. A penetrância da SCA3 varia com a idade, sendo de 20% em indivíduos com menos de 30 anos de idade e de 80% em indivíduos entre 50-60 anos de idade. Apesar de existir teste genético para SCA3, Maria não quer realizar o teste. Contudo, ela quer vir a ter filhos e não quer correr risco que eles venham a ser portadores da mutação responsável pela SCA3 em seus familiares. Ataxia espinocerebelar tipo 3 (SCA3) Doença de Machado-Joseph • Doença neurodegenerativa – AD – a mais frequente • Em geral de início tardio, com grande variabilidade clínica, caracterizadas pela perda progressiva de coordenação da marcha, dos movimentos das mãos dos olhos e da fala. • Estudos moleculares: – aumento de repetições CAG no gene ATXN3 – Indivíduos normais: 12 a 40 cópias – Afetados: > 61 ou mais cópias da repetição. Caso Clinico 1: a) A preocupação de Maria em vir a ter filhos com SCA3 se justifica? Porque? SCA3 José I 1 II 2 3 4 60a 6 Maria 1 28a 2 III ? SCA3 I 1 2 3 4 60a 6 II 1 28a III portadora nao portadora : A PRIORI 1/2 1/2 Nao manifestar 0,8 1 0,4 A posteriori 0,4 0,9 2 0,5 4 9 = 44,4% ~ I 1 II 2 3 4 60a 4 9 6 1 28a 2 1/2 III 2/9 ~ ~22% Caso Clinico 1: b) O que você ofereceria como opções quanto a medidas preventivas em relação a SCA3 para os futuros descendentes de Maria. - Realizar um teste genético (analise da região de trinucleotídeo no gene SCA3) no pai de Mariana, para confirmar o diagnóstico clinico. - Se a mutação patogênica é identificada: é possível fazer diagnóstico pré-implantação. - A confidencialidade pode ser mantida Caso Clinico 2: Mariana, 24 anos de idade, tem um irmão (Ricardo) com Distrofia muscular tipo Duchenne (DMD). O laudo do teste molecular e da bióspia muscular encontram-se em anexo. Não há nenhum outro caso de DMD na família. Mariana agendou uma consulta com você, pois quer decidir quanto a sua futura prole. Data de Nascimento: Material: Exame Solicitado: Encaminhamento: 24/05/2006 amostra de sangue periférico coletada pelo CEGH Pesquisa de mutação no gene da Distrofina Dra. Adriana Sexo: ( ) F ( X )M Coleta: 29/11/2012 Relatório: 28/01/2013 Teste Genético realizado em amostra de DNA de Ricardo Indicação: Metodologia: Teste molecular solicitado para pesquisa de deleção ou duplicação no gene da Distrofina. O paciente apresenta quadro clínico compatível com o diagnóstico de Distrofia Muscular do tipo Duchenne. 1. Dosagem da Enzima Creatinofosfoquinase (CK) realizada pelo Laboratório de Análises Clínicas da Faculdade de Ciências Farmacêuticas – USP (Valores de referência para mulheres: 26-155 U/L e para homens: 26-189 U/L) 2. Análise de deleção e duplicação nos 79 exons e da região promotora do gene da Distrofina pela técnica de MLPA (Multiplex Ligation-dependent Probe Amplification - MRC Holland SALSA kit P034/P035). Este método não detecta mutações de ponto. Resultados: 1- CK : 22275 U/L (laudo de resultados nº 8854F). 2- Não foi detectada deleção ou duplicação no gene da Distrofina. Interpretação: O resultado acima não exclui o diagnóstico de Distrofia Muscular do tipo Duchenne (DMD). Comentários: 1- A DMD é uma doença genética ligada ao cromossomo X que afeta indivíduos do sexo masculino. 2- Cerca de 60-70% dos pacientes afetados pela DMD apresenta uma deleção molecular no gene da Distrofina; 7-10% dos pacientes apresentam uma duplicação neste gene e os casos restantes aparentemente resultam de mutações de ponto. Dadas as potenciais implicações para outros membros da família, todos os testes genéticos devem ser acompanhados de aconselhamento genético. Referências Gatta V, Scarciolla O, et. al. Identification of deletions and duplications of the DMD gene in affected males and carrier females by multiple ligation probe amplification (MLPA). Hum Genet. 2005 Jun;117(1):92-8. Epub 2005 Apr 20. Zatz, M., Genômica das doenças neuromusculares e neurodegenerativas. In: Genômica São Paulo: Ed. Atheneu. p. 347-360, 2004. Gene Reviews: http://www.ncbi.nlm.nih.gov/books/NBK1119/ OMIM: http://omim.org/entry/300377 MRC-Holland (SALSA MLPA KIT P034/P035) - http://www.mrc-holland.com Avaliação da distrofina em amostra de biopsia muscular de Ricardo Caso Clinico 2: a) Como você orientaria Mariana em relação a riscos genéticos para seus futuros filhos H = 2m + H 2 H -H 2 ? 2H –H =2m 2 = 2m H =2m 2 H = 4m HETEROZIGOTA A PRIORI CONDICIONAL NÃO HETEROZIGOTA 1- 4 m = ~1 4m m 1/2 4 m = 2m 2 A posteriori 2m 2m+m m = 2m = 2 3m 3 2/3 1/2 1/3 1/4 1/12 Caso Clinico 2: b) que testes genéticos você recomendaria Atualmente: Sequenciamento de nova geração: identifica deleções, duplicações e mutações de ponto. Sempre que possível, testar o proposito afetado Caso clinico 3 O Casal Priscila (26 anos) e Mario (27 anos), clinicamente normais e primos de 1o. grau ( seus pais são irmãos), desejam saber se tem risco de virem a ter crianças afetadas por fenilcetonuria, uma vez que o irmão de Priscila é afetado por esta doença. Fenilcetonuria (PKU) é uma doença com padrão de herança autossômico recessivo, e a incidência da doença é de 1/50.000. Caso clinico 3 a) Como você faria o aconselhamento genético para esta família, quanto aO risco de recorrência da PKU b) Há indicação de realizar algum teste genético.? C) Se Priscila e Mario não fossem primos, sua conduta mudaria? Aa 1/2 Aa Aa 1/2 Aa 1/4 Aa 2/3 aa 1/4 x 2/3 x 1/4 1/24 Caso clinico 3 b) Há indicação de realizar algum teste genético. Sim TESTAR MARIO PARA MUTAÇAO Quando a frequencia é > 1 É recomendável c) Se Priscila e Mario não fossem primos, sua conduta mudaria? Aa Aa PKU p2+2pq+q2 aa = q2 = 1/50.000 q = 1/220 p = 1-1/220 ~1 Aa 1/110 Aa 2/3 aa 1/110 x 2/3 x 1/4 2pq= 1/110 1/660 Doenças de Herança Autossômica Recessiva Frequência mais alta em certas populações Doença de Tay Sachs Doença de armazenamento lisossômico Deficiência de hexosaminidase A Morte neuronal começando aos 3-6 meses de vida Regressão motora, perda visual e dos movimentos voluntários Estado vegetativo após ~1 ano Incidência 1/3600 em população de Judeus Ashkenazi 1/400.000 População mundial Em qual das duas populações há chance maior de ter afetados que são heterozigotos compostos para mutações no gene HEXA? Se justifica triagem de heterozigotos nestas populações? Doenças de Herança Autossômica Recessiva Frequência mais alta em certas populações Doença de Tay Sachs Doença de armazenamento lisossômico Deficiência de hexosaminidase A Morte neuronal começando aos 3-6 meses de vida Regressão motora, perda visual e dos movimentos voluntários Estado vegetativo após ~1 ano Incidência 1/3600 em população de Judeus Ashkenazi 1/40.000 População mundial Frequencia de heterozigoto= 1/30 1/100 Em qual das duas populações há chance maior de ter afetados que são heterozigotos compostos para mutações no gene HEXA? Na população geral Se justifica triagem de heterozigotos nestas populações? Efeito fundador – um tipo de deriva genética
Download