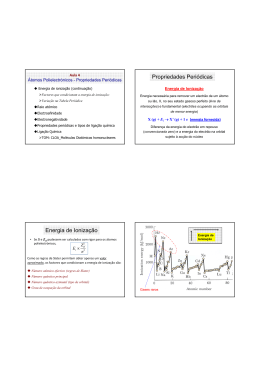
Aula 3 Átomos Polielectrónicos Átomos polielectrónicos Orbitais monoelectrónicas Energia das orbitais Regras de preenchimento das orbitais Princípio da Energia Mínima Princípio de Exclusão de Pauli Regra de Hund Regra de Wiswesser Configuração Electrónica e Tabela Periódica Número atómico efectivo Modelo Quântico do Átomo Modelo Quântico do Átomo 4º Número Quântico – Nº Quântico Magnético de SPIN, ms (Momento Angular Intrínseco) Orbital: Os espectros mostram duas riscas muito próximas Resultado da introdução da quarta variável – TEMPO (efeito relativista) caracterizada por n, l, ml Estado de um electrão: caracterizado por quatro números quânticos n, l, ml, ms O Nº Quântico de Spin apenas pode tomar dois valores ms = ± 1/2 Modelo Quântico: Átomos Polielectrónicos Modelo Quântico: Átomos Polielectrónicos Equação de Schrödinger independente do tempo − h2 8π 2me ∂ 2Ψ ∂ 2Ψ ∂ 2Ψ 2 + 2 + 2 + VΨ = EΨ ∂y ∂z ∂x Resolução deve fornecer orbitais e energias dos electrões ⇒ Consideram-se os electrões independentes a moveremse num potencial de simetria esférica, determinado não só pela carga nuclear (Z+) mas também a “blindagem” dos outros electrões. Mas a presença de repulsões interelectrónicas inviabiliza a obtenção de uma solução analítica ⇒ A função de onda para o átomo é o produto das funções Aproximações: para os diversos electrões. ⇒ Orbitais são as monoelectrónicas (átomos hidrogenóides) ⇒ Mas ... CADA ÁTOMO É UM CASO! Energias dependem de n e de l ⇒ NÃO HÁ EXPRESSÃO ANALÍTICA! Modelo Quântico: Átomos Polielectrónicos Modelo Quântico: Átomos Polielectrónicos Números Quânticos n (= 1, 2, 3,…..) - número quântico principal - designa o nível ou camada Orbital: caracterizada por n, l, ml l (0 ≤ l ≤ n-1) - número quântico secundário Estado de um electrão: caracterizado por n, l, ml, ms - designa o sub-nível (s, p, d, f, g, ….) Orbitais: ml (-l ≤ ml ≤ + +ll ) - número quântico magnético - designa a simetria da orbital Camada Sub-nível Orbital n=1 1s n=2 2s 2px2py2pz n=3 3s ……… 3px3py3pz 3dx2-y23dz23dxz3dxy3dyz Átomos Polielectrónicos Energia das Orbitais Distribuição dos electrões: Princípios e regras 1. Princípio da Energia Mínima - mas a sequência de energias das orbitais não é comum a todos os átomos ……. Regras 2. Princípio de Exclusão de Pauli - Num átomo não podem existir dois electrões com os 4 números quânticos iguais 3. Regra de Wiswesser - As orbitais de mais baixa energia são : ⇒ as de menor valor da soma de (n+l) ⇒ Para o mesmo valor de (n+l), a de menor n tem menor energia 4. 1ª Regra de Hund - Em orbitais com o mesmo l começa-se por colocar um elctrão em cada orbital e só depois é que se emparelham Átomos Polielectrónicos Regra da Diagonal (Regra de Wiswesser) Dá ordem de preenchimento mas…. HÁ EXCEPÇÕES!! ⇒ TABELA PERIÓDICA Átomos Hidrogenóides Átomos Polielectrónicos Tabela Periódica Efeitos relativistas Energia das orbitais em função do número atómico Exercício: Determine o Grupo e o Período do elemento com nº atómico Z = 42 (Z = 42) ⇒ Regra da Diagonal: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 ⇒ Elemento de transição por ter o sub-nível 4d parcialmente preenchido ⇒ Não obedece à regra de Wiswesser (deveria ser 5s2 4d4) ⇒ Ver TABELA PERIÓDICA E(4s) < E(3d) ⇒ O nº de electrões nas orbitais (n-1)d, ns e np é: (n-1)d = 5; ns = 1 e np = 0 ⇒ Total = 6 electrões ⇒ GRUPO 6 e PERíODO 5 Átomos Polielectrónicos Forma simplificada de tratar os átomos polielectrónicos Tratá-los como hidrogenóides, mas em que a carga nuclear que actua sobre um electrão é blindada pelos restantes electrões do átomo Nº Atómico Efectivo = nº Atómico – Coeficiente de Blindagem Número Atómico Efectivo (Zef) O Coeficiente e Blindagem (S) é calculável a partir das Regras Empíricas de Slater 1) As orbitais atómicas são organizadas em Grupos de Slater (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) ... 2) O coeficiente de blindagem, S, é a soma das seguintes contribuições: i) Zero por cada electrão em grupo de Slater exterior ao electrão em causa Zef = Z - S ii) 0,35 por cada electrão no mesmo grupo de Slater (excepto em 1s que é de 0,30) iii) Se o electrão a que se refere o cálculo for um electrão s ou p: 0,85 por cada electrão cujo nº quântico principal seja uma unidade inferior à do electrão a que se refere o cálculo En = − Z2 2π 2 µe 4 Z 2 ∝− 2 4πε h2 n2 n Hidrogenóide 1 2 0 ⇒ En ∝ − Z ef2 n2 Exemplo: Calcular o Zef para um electrão 4s no átomo de cobalto (Z= 27) 1,0 por cada um dos restantes electrões interiores iv) Se o electrão a que se refere o cálculo for um electrão d ou f: 1,0 por cada electrão em grupos de Slater interiores Exemplo: Calcular o Zef para os electrões do ferro (Z = 27) ⇒ 1s2 2s2 2p6 3s2 3p6 3d7 4s2 Zef = 27 – (1x 0,35 + 15 x 0,85 + 10 x 1) = 3,9 Fe (Z = 26) Configuração electrónica: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Exemplo: Calcular o Zef para um electrão 3d no átomo de cobalto (Z= 27) (Z = 27) ⇒ 1s2 2s2 2p6 3s2 3p6 3d7 4s2 Zef = 27 – (6x 0,35 + 18 x 1) = 6,9 As orbitais s e p são mais “penetrantes” que as d ou f por isso os electrões em orbitais s ou p sofrem uma blindagem menor por parte dos electrões imediatamente interiores Números atómicos efectivos dos electrões ns ou np Modelo Quântico: Probabilidade radial Raio mais provável para a orbital ⇒ Ao longo de um Periodo Zef aumenta da esquerda para a direita As orbitais s são mais penetrantes que as p e estas mais penetrantes que as d ⇒ Ao longo de um Grupo Zef aumenta de cima para baixo Propriedades Periódicas Propriedades Periódicas A energia do electrão no nível n de um átomo hidrogenóide é: E =− Energia de Ionização 2π 2 µe 4 Z 2 Z 2 ∝ 2 4πε h2 n2 n 1 2 0 e2 Z 2 4 πε 2a0 n 2 1 2 0 a0 = 52,9 pm (raio de Bohr) Energia necessária para remover um electrão de um átomo ou ião, X, no seu estado gasoso perfeito (livre de En = − ou Para o átomo de Hidrogénio: E1= - 13,59 eV interacções) e fundamental (electrões ocupando as orbitais Ei(H)= 0 - E1= -E1=13,59 eV de menor energia) X (g) + Ei → X+ (g) + 1 e (energia fornecida) Diferença da energia do electrão em repouso (convencionada zero) e a energia do electrão na orbital sujeito à acção do núcleo Energia de Ionização Para os átomos polielectrónicos não conseguimos calcular as energias dos electrões e, por isso, não podemos calcular as energias de ionização Comparações Energia de Ionização X (g) + Ei → X+ (g) + 1 e (energia fornecida) • Se S e Zef pudessem ser calculados com rigor para os átomos polielectrónicos, Z2 Ei ∝ ef n2 Como as regras de Slater permitem obter apenas um valor aproximado, os factores que condicionam a energia de ionização são: Energia de Ionização do Hidrogénio Número atómico efectivo (regras de Slater) (valor simétrico) Número quântico azimutal (tipo de orbital) Número quântico principal Grau de ocupação da orbital Número Atómico Efectivo (Zef) Outros factores que condicionam a Energia de Ionização O Coeficiente e Blindagem (S) é calculável a partir das Regras Empíricas de Slater 1) As orbitais atómicas são organizadas em Grupos de Slater (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) ... Tipo de orbital – As regras de Slater não reflectem o grau de penetrabilidade das orbitais (por exemplo s e p) O efeito de penetração pode-se sobrepor a pequenas variações de Zef e de n ⇒ (Berílio – Boro) 2) O coeficiente de blindagem, S, é a soma das seguintes contribuições: i) Zero por cada electrão em grupo de Slater exterior ao electrão em causa ii) 0,35 por cada electrão no mesmo grupo de Slater (excepto em 1s que é de 0,30) iii) Se o electrão a que se refere o cálculo for um electrão s ou p: 0,85 por cada electrão cujo nº quântico principal seja uma unidade inferior à do electrão a que se refere o cálculo Primeiras Energias de Ionização (kJ/mol) 1,0 por cada um dos restantes electrões interiores iv) Se o electrão a que se refere o cálculo for um electrão d ou f: 1,0 por cada electrão em grupos de Slater interiores Outros factores que condicionam a Energia de Ionização Outros factores que condicionam a Energia de Ionização Grau de ocupação da orbital – Electrões partilhando a Be Z=4 ⇒ 1s2 2s2 (orbital s totalmente preenchida) ⇒ Mais Estável mesma orbital repelem-se mutuamente ⇒ a energia de ionização é menor do que no caso de electrões isolados. Ex. ⇒ (Azoto - Oxigénio) e (Fósforo - Enxofre) ⇒ 1s2 2s1 (orbital s percialmente preenchida) B Z= 5 ⇒ 1s2 2s2 2p1 (orbital p com apenas 1 electrão) ⇒ 1s2 2s2 2p0 (orbital s totalmente preenchida) ⇒ Mais Estável 1ª Ei (Be) = 900 kJ/mol > 1ª Ei (B) = 801 kJ/mol Ei (Azoto) = 1402 kJ/mol > Ei (Oxigénio) = 1314 kJ/mol Energia de Ionização de Ordem Superior Energia de Ionização X (g) + Ei1 → X+ (g) + 1 e (1ª EI) X+ (g) + Ei2 → X2+ (g) + 1 e (2ª EI) X2+ (g) + Ei3 → X3+ (g) + 1 e (3ª EI) As energias de ionização de ordem superior são sempre maiores que as de menor ordem, dado que existindo menos electrões há menor repulsão interelectrónica, pelo que os electrões ficam mais ligados aos núcleos. Ca (g) → Ca+ (g) + e ⇒ Ei1 = 590 kJ/mol Ca+ (g) → Ca2+ (g) + e ⇒ Ei2 = 1144 kJ/mol Gases raros Ca2+ (g) → Ca3+ (g) + e ⇒ Ei3 = 4905 kJ/mol
Download