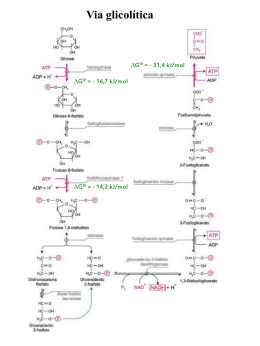
Glicólise Metabolismo da glicose C6H12O6 + 6 O2 6 CO2 + 6 H2O ΔG’o = -2.870 kJ/mol Glicólise • primeira via do catabolismo da glicose; • via central que ocorre em todo as as células; • ocorre no citoplasma das células; Glicose + NAD+ + 2 ADP + 2 Pi 2 Piruvato + NADH + H+ + 2 ATP + 2 H2O glicólise Glicólise pode ocorrer em duas vias: • Anaerobiose – O produto final é Piruvato que posteriormente é fermentado em Acido Láctico ou Etanol. • Aerobiose – O produto final é o piruvato que depois, por processos posteriores à glicólise, é oxidado em CO2 e H2O. Fase Preparatória • utilização de 2 moléculas de ATP. • formação de gliceeraldeído-3-fosfato e diidroxiacetona fosfato. Fase de Pagamento • oxidação do gliceraldeído-3-fosfato. • formação de 4 moléculas de ATP. • formação de 2 moléculas de NADH. • formação de piruvato. Glicose Glicose -6-Fosfato ADP ATP Mg2+ hexoquinase ΔGo = -16,7 kJ/mol • A glicose é uma molécula quimicamente inerte, assim para se iniciar a sua degradação é necessário que seja ativada; • Depois de entrar na célula a glicose é fosforilada pela hexocinase produzindo glicose-6-fosfato pela transferência do fosfato do ATP; • A glicose-6-fosfato não é transportado através da membrana Plasmática; • Reação irreversível; Glicose -6- Fosfato Frutose -6- Fosfato Mg2+ fosfoexone isomerase ΔGo = -1,7 kJ/mol Frutose -6-fosfafto Frutose-1,6-Bifosfato ADP ATP Mg2+ fosfofrutoquinase 1 • A frutose-6-fosfato é fosforilada a frutose-1,6-bifosfato pela fosfofrutoquinase; •Enzima reguladora da glicólise; ΔGo = -14,2 kJ/mol Frutose-1,6-bifosfato Gliceraldeído-3-fosfato Diidroxiacetona fosfato + aldolase ΔGo = 23,8 kJ/mol • A frutose-1,6-bifosfato é dividida pela aldolase em duas trioses fosfatadas ficando cada uma com um fosfato. • Apenas o gliceraldeído-3-fosfato subsequentes. Diidroxiacetona fosfato pode ser degradado pelos passos Gliceraldeído-3-fosfato Triose fosfato isomerase ΔGo = 7,5 kJ/mol • Diidroxiacetona fosfato é rapidamente convertido em gliceraldeído-3-fosfato. Gliceraldeído-3-fosfato + Pi 1,3-Bifosfoglicerato NAD+ NADH + H+ gliceraldeído-3-fosfoato desidrogenase ΔGo = 6,3 kJ/mol • O Gliceraldeído-3-fosfato é convertido num composto intermédio. • Grupo Aldeído (-CHO) é oxidado em Grupo Carboxílico (-COOH). • O grupo fosfato deriva de um fosfato inorgânico. 1,3-Bifosfoglicerato ADP 3-Fosfoglicerato ATP Mg2+ + fosfoglicerato quinase + ΔGo = -18,5 kJ/mol 3-Fosfoglicerato 2-Fosfoglicerato Mg2+ fosfoglicerato mutase ΔGo = 4,4 kJ/mol 2-Fosfoglicerato Fosfoenolpiruvato H2O enolase ΔGo = 7,5 kJ/mol Fosfoenolpiruvato Piruvato ADP ATP Mg2+, K+ piruvato quinase ΔGo = -31,4 kJ/mol • Reação exergônica irreversível; • Transferência do grupo fosfato do fosfoenolpiruvato para o ADP; Como os açúcares que ingerimos na alimentação entram na via glicolítica? Destinos do piruvato Fermentação alcoólica Fermentação láctica Louis Pasteur 1861: crescimento de leveduras, por grama de glicose, maior na presença do que na ausência de ar. Glicose consumida mais lentamente na presença de ar do que na ausência. • Teoria vitalista (“força vital”) Eduard Buchner 1907 – Prêmio Nobel Derruba a Teoria vitalista – a fermentação ocorre sem vida organizada – Zimases. Harden e Young 1909: isolamento do primeiro intermediário da via glicolítica. 1929: Arthur Harden - Prêmio Nobel Descoberta de um procedimento para acelerar a fermentação: adição de Pi ao meio. Otto Meyerhoff (1922): Prêmio Nobel – Descoberta da correlação entre o consumo de oxigênio e o metabolismo do ácido lático nos músculos de coelho. Ativador: obtido por autólise de levedura. O ativador perde a atividade se aquecido por 1 minuto a 50 ºC e conserva-se bem em gelo. Células tumorais: Otto Warburg – 1920 Células tumorais malignas convertem glicose equivalente a 30% do peso seco em lactato/h. (Músculo esquelético humano = 6% do peso seco em lactato/h) 22 Metabolismo do Etanol no fígado Álcool desidrogenase (ADH) Acetaldeído desidrogenase (ALDH) Hipoglicemia gliconeogênese Sensibilidade diferencial ao álcool Consumo de álcool segundo diferentes padrões levou a uma evolução divergente. Existem várias enzimas ADH no homem: dímeros (5 genes). ADH são essenciais pois quebram e metabolizam as moléculas de álcool (tóxico) que é absorvida para o sangue. População do Sudeste Asiático: maior intolerância ao álcool – acúmulo de acetaldeído – rubor alcoólico (“Asian flush”) Alcoolismo (tolerância ao álcool) -Populações européias:alelos ADH2 e ADH3 menos ativas metabolizam lentamente o etanol Intolerância ao álcool: - Sudeste asiático: ~ 50 % pop. possui o alelo mutante ALDH2*2 (8% da atividade do gene wt) Hexoquinase Glicose + ATP HK Glicose 6-fosfato + ADP + H+ inibidor Isoformas I, II e III: cinética michaeliana com Km < 0,1 mM, ou seja, funcionam sempre em Vmáx. [glicose] plasm = 5 a 8 mM • Hexoquinase (músculo): I, II, e III • Glicoquinase ou Hexoquinase IV – presente no fígado: menor afinidade pela glicose. • Ligada a uma proteína reguladora forma um complexo inativo. Hexoquinase IV é regulada pelo nível de glicose no sangue: regulação por seqüestro no núcleo celular hepatócito Após refeição Durante jejum Vindo da gliconeogênese Fígado não compete com demais órgãos pela glicose escassa. HEXOQUINASE IV • Glicoquinase (Hexoquinase IV) não é inibida por glicose 6-fosfato e tem maior Km pela glicose. • É importante no fígado para garantir que glicose não seja desperdiçada quando estiver abundante, sendo encaminhada para síntese de glicogênio e ácidos graxos. • Além disso, quando a glicose está escassa, garante que tecidos como cérebro e músculo tenham prioridade no uso Fosfofrutoquinase-1 • Frutose-1,6-bifosfato a partir desse ponto, o açúcar está comprometido com a via glicolítica; • Reação altamente exergônica e irreversível, ΔG0’ = - 14,2 kJ/mol; • Além do sítio catalítico, esta enzima possui diversos sítios onde inibidores e ativadores alostéricos se ligam; Frutose-2,6-bifosfato • Em 1980, foi observado que frutose-2,6-bisfosfato ativava a fosfofrutoquinase aumentando sua afinidade pelo substrato frutose-6-fosfato. • Frutose 2,6-bisfosfato é um ativador alostérico que desloca o equilíbrio conformocional da enzima para sua forma ativa. • É produzido pela FOSFOFRUTOQUINASE 2 (PFK 2). Regulação alostérica: enzima bifuncional 6-fosfofruto-2-quinase/frutose 2,6-bifosfatase PFK2 Ativa PFK1 + glicólise • Regulação por controle covalente: substrato para proteína quinase A (PKA) Piruvato quinase ADP + ATP • Regulação por controle covalente • • • • • Último passo da via glicolítica. Fluxo de saída. Produz ATP e Piruvato. Também é um tetrâmero apresentando diferentes isoformas em diferentes tecidos. Isoforma L (fígado) e isoforma M (músculo). Muitas propriedades em comum: - Frutose 1,6-bisfosfato: ativa - ATP: inibe alostericamente - Alanina: produzida a partir de piruvato, inibe a PIK. • • No entanto, as isoformas L (fígado) e M (músculo) diferem na regulação por modificação covalente: fosforilação. A isoforma L é inativada ao ser fosforilada quando o nível de glicose no sangue cai (estímulo disparado pelo glucagon) Exercícios • A transformação da glicose em lactato nos músculos libera apenas 7% da energia livre obtida quando a glicose é completamente oxidada em CO2 e H2O. Isso significa que a glicólise anaeróbica no músculo é um desperdício de glicose? Explique. • A concentração de glicose no sangue é mantida ao redor de 5 mM. O que acontece com a glicose assim que penetra nas células? Em certas situações médicas a glicose é administrada intravenosamente para nutrir pacientes. Como a transformação da glicose em glicose-6-fosfato consome ATP, por que não administrar diretamente a glicose-6-fosfato na veia dessas pessoas? • O efeito do ATP na enzima alostérica PFK-1 é mostrada a seguir. Para uma dada concentração de frutose-6-fosfato, a atividade de PFK-1 cresce com concentrações aumentadas de ATP, mas é atingido um ponto acima do qual aumentos na concentração de ATP provocam a inibição da enzima. a) Explique por que o ATP pode ser tanto um substrato quanto um inibidor da PFK-1. Como esta enzima é regulada pelo ATP? b) Como a concentração de ATP regula a glicólise? c) A diminuição da PFK-1 por ATP é diminuída quando a concentração de ADP é alta. Explique por que. • Um paciente apresenta vômitos e diarréia pouco depois de ingerir leite. Um teste de tolerância à lactose é efetuado da seguinte forma: o paciente ingere uma certa quantidade de lactose e, a seguir, tem suas concentrações sanguíneas de glicose e galactose medidas em intervalos de tempo. Nos indivíduos normais, sem intolerância à lactose, esses níveis aumentam até um máximo em, mais ou menos, uma hora e depois declinam. Explique as causas desse fato. Os níveis de glicose e galactose do paciente não aumentam durante o teste. Explique a causa disso. Regulação da via glicolítica Gliconeogênese: via antagônica à glicólise Síntese de glicose a partir de compostos que não são carboidratos: aminoácidos, lactato e glicerol. Alguns tecidos dependem quase completamente de glicose para energia metabólica depleção de glicose gliconeogênese Conversão de piruvato a fosfoenolpiruvato Alanina e Glutamina Conversão de frutose-1,6-fosfato a frutose-6-fosfato Conversão de glicose-6-fosfato a glicose Vesículas com glicose do retículo unem-se com a membrana plasmática ocorrendo, assim a liberação da glicose para a corrente sanguínea. O músculo e o cérebro não contêm as enzimas (1) glicose-6-fosfatase e o músculo liso e cardíaco não contêm (2) frutose-1,6-bifosfatase. Por isso estes órgãos têm prioridade na captação de glicose. (1) Glicose-6-fosfato + H2O glicose + Pi (2) Frutose-1,6-bisfosfato + H2O frutose 6-fosfato + Pi Regulação recíproca da gliconeogênese e da glicose Frutose-2,6- bifosfato Necessidade de glicose Tecidos dependentes de glicose • cérebro • hemácias Requerimento de glicose diário no adulto 160 gramas (glicemia normal 75 a 99 mg/dl) • 120 gramas – cérebro • 40 gramas – outros tecidos Controle da Glicemia por Regulação Endócrina • Necessidade de uma reserva energética de fácil mobilização Insulina X Glucagon Estoca glicose na forma de glicogênio e secreta quando necessário. Homeostase da glicose Insulina • Hormônio polipeptídico (cadeia A; cadeia B) • União por duas pontes dissulfeto Controle da liberação de insulina • Queda de glicose plasmática • Alimentação rica em proteína T ip o de r eser va receptor de insulina Glicogênio Glicogênio Glicose ( m M) Lipídeos Pr ot eín a Hor m ôn io ou su bst r at o ( U) I nsulina (mU/ m l) Glu cagon ( pg/ m l) r azão in su lin a:glucagon Glicose ( m M) Ácidos gr axos ( m M) Acet oacet at o ( m M) bHidr oxibut ir at o ( m M) Lact at o ( m M) Pir uvat o ( m M) Alan ina ( m M) AT P ( m M) T ecido Qu an t idade ( g) f ígado m úsculo f lu idos cor por ais t ecido adip oso m úsculo 70 1 20 20 1 50 00 60 00 Muit o bem alim en t ado Pósabsor ção ( 1 2h ) Jeju m 3 dias Jeju m 5 sem an as 40 80 0.50 6 .4 0.14 0.04 0.03 2 .5 0.25 0 .8 3 43 15 1 00 0.15 4 .8 0 .6 0.05 0.10 0.70 0.06 0.03 2 90 8 1 50 0.05 3 .8 1 .2 0 .4 1 .4 0.70 0.04 0 .3 3 80 6 1 20 0.05 3 .6 1 .4 1 .3 6 .0 0 .6 0.03 0 .1 5 37 Fo nt e: Ru der m an et al ., 1 9 7 6 . Os dad os fo r am o bt id os d e i n divídu os no r m ais, ex cet o par a dados d e 5 sem an as em j eju m qu e f or am ob t i dos de pacien t es o besos su bm et i dos a jej u m t er ap êut i co. O cálcu l o de equ ivalen t es d e AT P f o i calcu l ado p ar a oxid ação co m pl et a de subst r at o s a CO 2 e H2 O. Efeito metabólico da insulina • Armazena glicose em glicogênio • Inibe a gliconeogênese e a glicogenólise • Aumenta a expressão de transportadores GLUT-4 TRANSPORTADOR Km par a glicose ( mM ) Dist r ibuição Car act er íst icas GLUT 1 1 -2 am pla, com alt a con cent r ação no cér ebr o, er it r óci t os e en dot élio t r an sp or t ador con st it u t ivo de glicose GLUT 2 15 - 20 r in s, int est in o delgado, f ígado e pân cr eas e cél ulas b t r an sp or t ador de baixa af inidade, f u ncion a com o sensor de glicose GLUT 3 10 n eu r ônios, placen t a t r an spor t ador de alt a afin idade GLUT 4 5 m úsculos esquelét ico e car díaco, t ecido adip oso t r an sp or t ador dep en dent e de in su lin a GLUT 5 6 - 11 in t est in o delgado, esper m a, r im , cér ebr o, adipóci t os e m úsculo t r an spor t ador de f r u t ose, af in idade m u it o baixa p ar a glicose Regulação da transportadores internalização da glicose por sequestro de GLUT-4 permanece sequestrado em vesículas no citoplasma até que a Insulina sinalize para sua exposição. Diabetes Mellitus: comum no Brasil (prevalência 7,6 % da população brasileira entre 30 e 69 anos) Apresentam hiperglicemia Tipo I: insulino-dependente ou juvenil. É uma doença auto-imune que provoca a destruição de células b das ilhotas do pâncreas. Tipo II: não insulino-dependente (resistente a insulina, e por secreção deficiente de insulina). 80% estão acima do peso adequado Síndrome Metabólica No diabetes o organismo comporta-se como no jejum prolongado. Um dos métodos de monitoramento da hiperglicemia é o exame que mede a Hemoglobina glicosilada (HbA1c): em diabetes essa taxa pode ser até 3 X maior. Regulação da síntese do glicogênio A glicogênio sintase mantém-se inativa por meio de fosforilação de serinas: Glicogênio sintase quinase 3 (GSK3) glicose 6-P liga-se a um sítio alostérico na glicogênio sintase aumentando o acesso da fosfoproteína fosfatase A regulação da insulina a nível transcricional Efeitos metabólicos do glucagon Metabolismo do carboidrato Aumento imediato da glicemia • degradação do glicogênio hepático • estímulo para gliconeogênese Epinefrina Secretado em momentos de stress, prepara o organismo para grandes esforços físicos, estimula o coração e eleva a tensão arterial. Aumenta a glicemia muscular. Ciclo de Cori Cooperação metabólica entre o fígado e o músculo durante um exercício vigoroso (escassez de oxigênio – condição anaeróbica). 1) Isquemia (Infarto do miocárdio): Isquemia: falta de suprimento sangüíneo para um tecido orgânico necrose do tecido por isquemia
Download