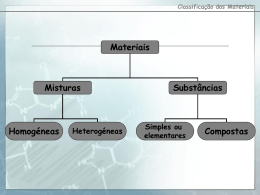
ESCOLA EB 2,3 DE GUEIFÃES Ciências Físico-Químicas Ficha de Exercícios de revisão 9º Ano Maio/08 TEMA- VIVER MELHOR NA TERRA: 3. CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS A constituição dos átomos, distribuição electrónica, estabilidade química, iões. Tabela Periódica. Metais e não-metais. Propriedades físicas e reactividade química. Nome___________________________________________________________________________Nº___________Turma_ _____ Objectivos para o 5º teste: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 1. Identificar as partículas constituintes dos átomos. Relacionar a massa do átomo com a massa do núcleo. Definir número atómico. Caracterizar um elemento químico pelo número atómico. Identificar o átomo de hidrogénio como o mais simples e o mais leve. Definir número de massa. Identificar isótopos. Caracterizar isótopos de um elemento pelo número de massa. Compreender a organização da Tabela Periódica. Descrever a distribuição electrónica em termos de níveis energéticos para átomos simples. Associar estabilidade química à configuração electrónica dos gases nobres. Relacionar a distribuição electrónica com grupo e período da tabela periódica, para os átomos dos elementos representativos. Interpretar a formação de iões. Relacionar a carga de um ião com o número de electrões em excesso ou em falta. Distinguir um ião do átomo correspondente. Interpretar simbologia química. Distinguir substâncias elementares de substâncias compostas. Distinguir metais de não metais, através das suas propriedades. Classificar substâncias com base no seu comportamento químico. Interpretar a reactividade dos metais. Qual dos valores seguintes pode ser o de um raio atómico? 0,01 mm 2. 0,000 000 1 m -12 100 pm Nota: 1 pm =10 m Completa as frases: O núcleo de um átomo tem carga eléctrica de sinal ________________ e os electrões que se movem em volta do núcleo têm carga de sinal _________________. O átomo, no seu conjunto, é electricamente ___________________ porque ____________________________________________________________ . 3. Um átomo possui 3 protões, 4 neutrões e 3 electrões. Indica: 3.1. Quantas partículas existem no núcleo desse átomo. 3.2. Qual é a carga nuclear. 3.3. Qual é o número atómico do elemento a que o átomo pertence. 3.4. Qual é o número de massa. 4. O elemento azoto tem dois isótopos naturais, representados simbolicamente no quadro seguinte. 4.1. Completa o quadro. Nome do elemento 14 7 15 7 Z Número de protões A Número de electrões Número de neutrões N N 4.2. Em que diferem os átomos destes dois isótopos? 5. Considera as duas representações seguintes: 59 28 Ni 59 27 Co 5.1. Indica a constituição dos núcleos de cada um dos átomos. 5.2. São isótopos? Justifica. 1/2 6. Dois isótopos do elemento oxigénio encontram-se representados simbolicamente no quadro seguinte. 6.1. Completa o quadro. 16 15 8O 8O Número atómico Número de massa Número de protões Número de electrões Número de neutrões 6.2. Em que diferem os átomos destes dois isótopos? 7. Completa: 7.1. Br + 1e → _________ 7.2. Ca - 2e → _________ 7.3. Al - 3e → _________ + 7.4. K → K + _________ 7.5. _____ + 1e → I 27.6. O +______ → O 8. 8.1. 8.2. 8.3. 8.4. 8.5. Cada átomo de fósforo (P) possui 15 electrões. Faz a distribuição desses electrões pelos níveis de energia. Quantos electrões estão colocados no nível de maior energia? Indica, justificando, em que grupo e em que período da tabela periódica se encontra este elemento. Que tipo de ião terá tendência a formar um átomo deste elemento? Representa-o. Completa a frase seguinte: O número de protões destes átomos é _____________ e a sua carga nuclear é ______________ . + 9. A distribuição electrónica do ião potássio (K ) é: 2,8,8. 9.1. Escreve a distribuição electrónica do átomo que lhe deu origem. 9.2. Indica a carga nuclear deste ião. 10. Completa o quadro: Átomo Lítio Sódio Flúor Cloro Azoto Representação simbólica nº de protões nº de neutrões distribuição electrónica Grupo da T.P. Período da T.P. Ião que tende a originar 7 3 Li 23 11 Na 19 9F 35 17 Cl 15 7N 11. Completa o quadro: Átomo ou ião Número de electrões Cu 2+ Cu S 2S Carga nuclear + 29 +16 12. Indica três propriedades físicas características dos metais. 13. O lítio, o sódio e o potássio fazem parte de um grupo de elementos representativos da tabela periódica. 13.1. Como se chama esse grupo? 13.2. Como varia a reactividade ao longo desse grupo? Explica essa variação. 13.3. Escreve e acerta a equação química que traduz a reacção do lítio com a água. 13.4. Qual é o carácter químico da solução resultante? 2/2
Download