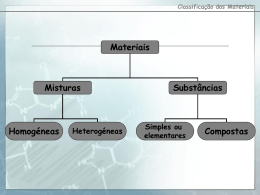
Ciências Físico-Químicas Correcção da Ficha de Exercícios de revisão ESCOLA EB 2,3 DE GUEIFÃES 9º Ano Maio/08 TEMA- VIVER MELHOR NA TERRA: 3. CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS A constituição dos átomos, distribuição electrónica, estabilidade química, iões. Tabela Periódica. Metais e não-metais. Propriedades físicas e reactividade química. 1. 2. 3. 3.1. 3.2. 3.3. 3.4. 100 pm O núcleo de um átomo tem carga eléctrica de sinal positivo e os electrões que se movem em volta do núcleo têm carga de sinal negativo O átomo, no seu conjunto, é electricamente neutro porque o número de protões (cada protão tem carga +1) é igual ao número de electrões (cada electrão tem carga -1). Um átomo possui 3 protões, 4 neutrões e 3 electrões. 7 partículas ( 3 protões+ 4 neutrões). +3 3. 7. 4. O elemento azoto tem dois isótopos naturais, representados simbolicamente no quadro seguinte. 4.1. . 14 7 N 15 7 N Nome do elemento Z A Número de protões Número de electrões Número de neutrões azoto 7 14 7 7 7 (14-7) azoto 7 15 7 7 8 (15-7) 4.2. No número de neutrões (consequentemente o número de massa é diferente). 5. 59 28 59 27 Ni Co 5.1. Ni - 28 protões 31 neutrões; Co – 27 protões e 32 neutrões. 5.2. Não são isótopos porque não têm o mesmo número atómico, são átomos de elementos químicos diferentes. 6. Dois isótopos do elemento oxigénio encontram-se representados simbolicamente no quadro seguinte. 6.1. 16 Número atómico Número de massa Número de protões Número de electrões Número de neutrões 8O 8 16 8 8 8 15 8O 8 15 8 8 7 6.2. No número de neutrões (consequentemente o número de massa é diferente). 7. Completa: 7.1. Br + 1e- → Br - → Ca - → Al 7.2. Ca - 2e 7.3. Al - 7.4. K → K+ + 1e- 7.5. I + 1e- → I- 7.6. O + 2e- → O2- 3e 2+ 3+ 1/2 8. 8.1. 8.2. 8.3. 8.4. 8.5. Cada átomo de fósforo (P) possui 15 electrões. 2,8,5. 5 grupo 15, porque tem 5 electrões de valência, e 3º período, porque tem 3 níveis de energia. ião trinegativo P 3O número de protões destes átomos é 15 e a sua carga nuclear é +15 . 9. 9.1. 9.2. A distribuição electrónica do ião potássio (K+) é: 2,8,8. 2,8,8,1 +19. 10. Completa o quadro: Átomo Lítio Sódio Flúor Cloro Azoto Representação simbólica nº de protões nº de neutrões distribuição electrónica Grupo da T.P. Período da T.P. Ião que tende a originar 7 3 Li 23 11 Na 19 9F 35 17 Cl 15 7N 3 4 2,1 1 2 Li 11 12 2,8,1 1 3 Na+ 9 10 2,7 17 2 F 17 18 2,8,7 17 3 Cl 7 8 2,5 15 2 N 3- + - 11. Completa o quadro: Átomo ou ião Número de electrões Carga nuclear Cu Cu2+ S S2- 29 27 16 18 + 29 +29 +16 +16 12. Têm brilho metálico, são bons condutores do calor, são bons condutores da corrente eléctrica (pontos de fusão e de ebulição elevados, dúcteis e maleáveis). 13. O lítio, o sódio e o potássio fazem parte de um grupo de elementos representativos da tabela periódica. 13.1. Grupo dos metais alcalinos. 13.2. A reactividade aumenta ao longo do grupo porque à medida que aumenta o número de níveis de energia, é cada vez mais “fácil” o átomo ceder o seu último electrão de valência, que se encontra sucessivamente menos atraído pelo respectivo núcleo. 13.3. 2 Li (s) + 2 H2O (l) 13.4. A solução tem carácter alcalino. → 2LiHO (aq) + H2 (g) 2/2
Download