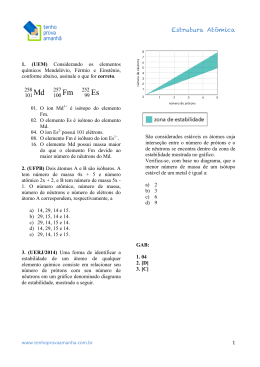
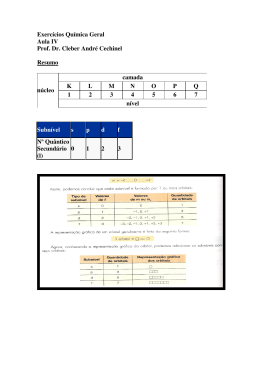
NOTA QUÍMICA SECÃO - JORGE TADEU ALUNO(A):_____________________________________________________________________________ 14 04 2011 MARQUE COM LETRA DE FORMA A SUA TURMA 1º ANO INSTRUÇÕES: • Usar somente caneta esferográfica (azul ou preta) • Não usar calculadora • Não fazer perguntas • Não usar corretivo nem rasurar • A interpretação das questões faz parte da prova 01. Considere as espécies químicas monoatômicas apresentadas na tabela a seguir: Espécie química monoatômica 1 2 3 4 5 Número de prótons 38 38 56 56 35 Número de nêutrons 38 39 56 57 36 Número de elétrons 38 36 56 56 36 03. Escreva a distribuição eletrônica em camadas e calcule o número de massa de certo átomo neutro que possui como subnível mais energético 3p5 e 18 nêutrons em seu núcleo. Com relação às espécies químicas monoatômicas apresentadas acima, determine: a) O número de massa das espécies 1, 2, 3, 4 e 5. b) A carga total das espécies 2 e 5, e também suas classificações em cátions, ânions ou átomos neutros. 04. Certo elemento químico A possui número de massa 15x + 4 e número atômico 8x, sabendo que ele é isóbaro do elemento B que possui número de massa 13x + 10 e número atômico 9x, determine: a) Os números atômicos e os números de massa desses dois elementos. 02. “Um cientista da Faculdade de Engenharia de Alimentos da Universidade Estadual de Campinas declarou que quando há consumo excessivo de produtos a base de grãos integrais, os fibratos presentes nas fibras destes grãos podem reduzir a absorção de minerais como zinco, ferro e cálcio.” b) Os quatro números quânticos do elétron mais energético do elemento A, sabendo que o primeiro elétron do orbital possui número quântico spin –1/2. (O Estado de São Paulo, p. A28, 12/09/2010.) P2-1ºB/Kelly Os elementos zinco, ferro e cálcio podem ser absorvidos no organismo na forma de seus cátions bivalentes. Sabendo que o número atômico do ferro é 26, escreva a sua distribuição eletrônica em camadas e também a distribuição em ordem energética do ferro na forma em que é absorvido pelo organismo. QUESTÕES RESPONDIDAS A LÁPIS SERÃO ANULADAS 05. Os números quânticos são grandezas utilizadas para calcular o conteúdo energético de um elétron e também para identificar a possível localização de um elétron na eletrosfera, sendo assim, determine o número atômico e escreva a distibuição em camadas de um átomo neutro que possui para o seu elétron mais energético o seguinte conjunto de números quânticos: n = 4, l = 1 , m = 0, Sp = +1/2 DADO ; adote para o primeiro elétron do orbital Sp = –1/2. 08. Considere as representações genéricas das espécies X, Y, R2– e Z2+. 16 X 8 17 Y 8 17 2– R 7 16 2+ Z 7 Calcule o número de nêutrons dessas espécies e determine aquelas que são isótonas. P2-1ºB/Kelly 06. O envenenamento por chumbo (Pb) é um problema relatado desde a Antiguidade, pois os romanos utilizavam este metal em dutos de água e recipientes para cozinhar. No corpo humano, com o passar do tempo, o chumbo deposita-se nos ossos, substituindo o cálcio. Isto ocorre, porque os íons Pb+2 e Ca+2 são similares em tamanho, fazendo com que a absorção de chumbo pelo organismo aumente em pessoas que têm deficiência de cálcio. Sabendo que o número de massa do chumbo é 207 e que seu número de nêutrons é 43 unidades maior do que o número de prótons. Determine o valor do número atômico, do número de nêutrons e também do número de elétrons do Pb+2. 07. A observação da coloração da chama em um bico de Bunsen é uma técnica analítica na qual amostras que contêm cátions metálicos, como potássio, bário, sódio e estrôncio, são inseridas na chama. Os elementos, ao receberem energia da chama, geram espécies excitadas que, ao retornarem para o estado fundamental, liberam parte da energia recebida na forma de radiação e a chama adquire uma cor que caracteriza o cátion metálico. Descreva um modelo atômico que pode ser utilizado para explicar esse fenômeno e o esquematize. Ensino Médio e Pré-vestibular
Download