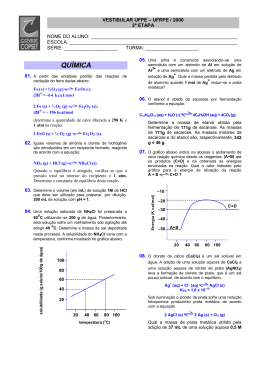
COVEST/UFPE – 2000 – 2ª ETAPA . A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação: . Iguais volumes de amônia e cloreto de hidrogênio são introduzidos em um recipiente fechado, reagindo de acordo com a equação: Quando o equilíbrio é atingido, verifica-se que a pressão total no interior do recipiente é Determine a constante de equilíbrio desta reação. 1 atm. . Determine o volume (em mL) de solução 1M de HCl que deve ser utilizado para preparar, por diluição, 200 mL de solução com pH = 1. . Uma solução saturada de NH4Cl foi preparada a 80ºC utilizando-se 200g de água. Posteriormente, esta solução sofre um resfriamento sob agitação até atingir 40ºC. Determine a massa de sal depositada neste processo. A solubilidade do NH4Cl varia com a temperatura, conforme mostrado no gráfico abaixo. . Uma pilha é construída associando-se uma semicélula com um eletrodo de Al em solução de Al3+ e uma semicélula com um eletrodo de Ag em solução de Ag+. Qual a massa perdida pelo eletrodo de alumínio quando 1 mol de Ag+ reduz-se prata metálica? . O etanol é obtido da sacarose por fermentação conforme a equação: Determine a massa de etanol obtida pela fermentação de 171g de sacarose. As massas molares da sacarose e do etanol são, respectivamente, 342g e 46g. 154. O gráfico abaixo indica na abscissa o andamento de uma reação química desde os reagentes (A + B) até os produtos (C + D) e na ordenada as energias envolvidas na reação. Qual o valor ← indicado pelo gráfico para a energia de ativação da reação A + B → C + D ? . O cloreto de cálcio (CaCl2) é um sal solúvel em água. A adição de uma solução aquosa de CaCl2 a uma solução aquosa de nitrato de prata (AgNO3) leva a formação de cloreto de prata, que é um sal pouco solúvel, de acordo com o equilíbrio: Sob iluminação o cloreto de prata sofre uma redução fotoquímica produzindo prata metálica de acordo com a equação Qual a massa de prata metálica obtida pela adição de 37 mL de uma solução aquosa 0,5M de cloreto de cálcio a 100 mL de uma solução aquosa 1M de nitrato de prata? . O pH do sangue humano é mantido entre 7,35 e 7,45 por diversos sistemas tampão associados, − sendo o principal deles o sistema ácido carbônico (H2CO3)− hidrogeno carbonato (HCO3 ) : − Sabendo-se que exalamos CO2 através da respiração e que HCO3 é excretado na urina, de que maneira os equilíbrios acima se deslocariam para prevenir que o uso intenso de diurético e a condição conhecida por hiperventilação (respiração anormalmente rápida e profunda) afetam o pH do sangue? 0 0Se deslocariam para a esquerda em ambos os casos. 1 1 Se deslocariam para a direita em ambos os casos. 2 2 Não se deslocariam porque se trata de um sistema tampão, capaz de manter o pH constante. 3 3 Se deslocariam para a esquerda no caso de hiperventilação. 4 4 Se deslocariam para a direita no caso do uso intenso de diuréticos. . A lei de velocidade para a reação, Se triplicarmos as concentrações de NO e O2 ao mesmo tempo, quantas vezes mais rápida será a reação? . Existem três diferentes diclorobenzenos, C6H4Cl2 , dependendo da localização dos átomos de cloro: Sobre estes compostos pode-se dizer: 0 0Todos têm o mesmo momento de dipolo, pois sua composição química é a mesma. 1 1 O mais polar é o composto (2). 2 2 O composto (1) é mais solúvel em solventes apolares. 3 3 Os compostos (2) e (3) são polares. 4 4 Nenhum deles é polar porque o anel benzênico é perfeitamente simétrico nos três casos. . Os detergentes comerciais são misturas de diversos ingredientes. O componente mais importante é o chamado tensoativo ou surfactante que consiste de longas moléculas orgânicas com um grupo polar em uma das pontas. Um exemplo de um tensoativo seria: Sobre estes compostos podemos dizer que: 0 0 São moléculas polares. 1 1 São bases de Lewis bastante fortes, que reagem com gorduras formando sabões solúveis em água. 2 2 São capazes de solubilizar gorduras em água, porque a longa cadeia carbônica interage com as moléculas de gordura, enquanto a ponta polar interage com as moléculas de água. 3 3 São bases de Brönsted fortes, que desprotonam as moléculas de gordura, tornando-as carregadas e solúveis em água. 4 4 Ao se misturarem com a água, as longas cadeias carbônicas do tensoativo formam uma mistura menos polar e, portanto, mais capaz de dissolver substâncias apolares. . Ácido acético e ácido trifluoroacético apresentam as seguintes fórmulas estruturais Ambos os ácidos carboxílicos são solúveis em água. Sobre estes compostos podemos afirmar: 00 11 22 33 44 . Os dois ácidos liberam íons em solução aquosa. O grau de dissociação iônica do ácido acético é 100%. O ácido acético é mais forte que o ácido trifluoroacético. O grupo CF3 influencia na acidez do grupo carboxílico. O ácido trifluoroacético tem massa molar superior ao ácido acético. A reação de um ácido carboxílico com um álcool pode ser descrita pela equação química abaixo: Podemos afirmar em relação a esta reação: 0 0Esta reação é catalisada pelo íon H+. 1 1A reação de esterificação envolve um ácido de Brönsted-Lowry e uma base de Arrhenius. 2 2A retirada da água do meio reacional favorece a formação do produto. 3 3O benzoato de metila é o produto formado. 4 4O mecanismo proposto para esta reação envolve a formação de radicais livres. . A reação de 1 mol de 3-etil-3-pentanol com ácido sulfúrico sob aquecimento leva á formação de um único produto com 50% de rendimento. Podemos afirmar com relação a esta reação: 00 11 22 33 44 . Ocorre formação de água. O produto gerado não apresenta isomeria cis/trans. O produto formado é o 3-etil-2-penteno. O produto formado nestas condições será uma cetona. 49g de produto é formado. Dois fracos, A e B, contendo diferentes reagentes, estão hermeticamente fechados e são colocados nos pratos de uma balança, que fica equilibrada como mostra o diagrama abaixo. Os frascos são agitados para que os reagentes entrem em contato. As seguintes reações ocorrem: Frasco A: Na2SO4 + Ba(NO3)2 → 2 NaNO3 + BaSO4 (precipitado branco) Frasco B: Zn(s) + H2SO4 → ZnSO4 + H2(g) Podemos afirmar que: 00 11 22 33 44 Com o andamento das reações o braço da balança pende para o lado do frasco A. Com o andamento das reações o braço da balança pende para o lado do frasco B. Com o andamento das reações os braços da balança permanecem na mesma posição. Este experimento envolve uma reação ácido-base. Este experimento envolve uma reação de oxidação-redução.
Download