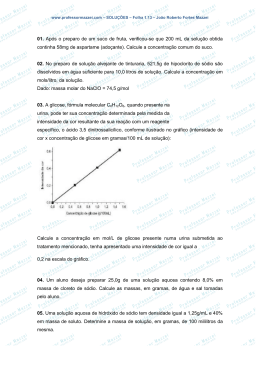
QUÍMICA PRISE II SOLUÇÕES 1. INTRODUÇÃO 4.1 FENÔMENO DE SATURAÇÃO DE UMA SOLUÇÃO Quando a mistura apresenta as mesmas características em toda a extensão do recipiente temos uma mistura homogênea e, se tiver mais de um aspecto a mistura será heterogênea. Deste modo: I.P.C.: SOLUÇÕES são misturas homogêneas de duas ou mais substâncias. Nas soluções o componente que está presente em menor quantidade recebe o nome de soluto (é o disperso), enquanto o componente que se apresenta em maior quantidade é o solvente (dispersante). Imaginamos um copo de água e que pouco a pouco serão adicionadas colheres de cloreto de sódio (sal de cozinha). Logo nas primeiras colheres o sal será solubilizado, porém chega certo ponto que a quantidade de água contida no copo não consegui solubilizar o sal adicionado que acaba sobrando no fundo do copo, daí dizemos então que essa solução se tornou uma solução saturada ou que atingiu o ponto de saturação. O ponto de saturação depende do soluto, do solvente e das condições físicas (a temperatura sempre influi, e a pressão é especialmente importante em soluções que contêm gases). O ponto de saturação é definido pelo coeficiente (ou grau) de solubilidade. Sal (soluto) I.P.C.: Coeficiente de solubilidade (ou grau de solubilidade) é a Água (solvente) quantidade necessária de uma substância (em geral em gramas) para saturar uma quantidade padrão (em geral 100g, 1000g ou 1L) de solvente, em determinadas condições de temperatura e pressão. 2. UNIDADES DE CONCENTRAÇÃO No estudo das soluções trabalhamos com diferentes grandezas, sendo assim adotaremos para o soluto e solvente os número 1 e 2 respectivamente, observe: SOLUTO m1 (massa do soluto) n1 (número de mols do soluto) V1 (volume do soluto) SOLVENTE m2 (massa do solvente) SOLUÇÃO m (massa da solução) n2 (número de mols do solvente) V2 (volume do solvente) n (número de mols da solução) V (volume da solução) 3. CLASSIFICAÇÃO DAS SOLUÇÕES Classificação das Soluções Classificação De acordo com o estado físico do soluto e do estado físico do solvente Ligas metálicas Líquidas Açúcar em águas Gasosas Ar atmosférico Sólido-sólido Ligas metálicas Sólido-líquido Cloreto água Líquido-líquido Álcool em água Gás-líquido Gás-gás De acordo com a natureza do soluto Exemplos Sólidas Gás-sólido Moleculares (possuem solutos moleculares) Iônicas (possuem solutos iônicos) Quando o coeficiente de solubilidade de uma substância é um valor muito pequeno (próximo de zero), dizemos que a substância é insolúvel naquele solvente, é o caso do cloreto de prata (AgCl), cujo seu coeficiente de solubilidade em água é 0,014g/L. Em se tratando de dois líquidos, dizemos que são imiscíveis; é o caso de água e óleo. Quando dois líquidos se dissolvem em qualquer proporção (coeficiente de solubilidade infinito) dizemos que são totalmente miscíveis; é o caso da mistura de água e óleo. 4.2 TIPOS DE SOLUÇÕES A tabela a seguir apresenta a classificação das soluções de acordo com o estado de agregação da solução, os estados físicos do soluto e do solvente e a natureza do soluto. De acordo com o estado de agregação da solução Por exemplo, os coeficientes de solubilidade em água, a 0°C: Para o NaCl é igual a 357g/L; Para o AgNO3, vale 1220g/L; Para o CaSO4 é igual a 2g/L. de sódio em Hidrogênio na platina em pó Gás carbônico nas bebidas Todas as misturas gasosas Açúcar em água Cloreto água de sódio em 4. REGRA DE SOLUBILIDADE De acordo com estudos anteriores para uma substância ser solúvel em outra dependerá da polaridade de suas ligações, pois generalizando: uma substância polar tende a se dissolver num solvente polar. Uma substância apolar tende a se dissolver num solvente apolar. Em função do ponto de saturação, classificamos as soluções em: INSATURADA (ou não saturada): quando dissolvemos uma quantidade inferior ao coeficiente de solubilidade; SATURADA: quando o coeficiente de solubilidade é atingido, neste caso pode ou não haver sobra de soluto, este que se for sólido irá se depositar no fundo do recipiente, chamado de corpo de fundo ou precipitado. SUPERSATURADA: quando é dissolvida uma quantidade de soluto maior que o coeficiente de solubilidade. Ex1: Tomamos como exemplo a solubilização de Cloreto de sódio em água e adotaremos um coeficiente de solubilidade de 360g/L a uma temperatura fixa de 25°C. No caso de soluções supersaturadas adotaremos o mesmo exemplo anterior. Soluções supersaturadas são aquelas que o solvente consegui solubilizar uma quantidade de soluto maior que o estipulado pelo coeficiente de solubilidade, para isso terá que ser alterado as condições físicas do sistema como temperatura e pressão. Analise a solução saturada com corpo de fundo representada abaixo. Para solubilizar a quantidade excedente de soluto aumentaremos a temperatura do sistema deste modo temos: Resfriamento Lento e sem agitação 4.3 CURVAS DE SOLUBILIDADE Curvas de solubilidade são os gráficos que apresentam a variação dos coeficientes de solubilidade das substâncias em função da temperatura. Analisando um gráfico de solubilidade podemos destacar três regiões. A temperatura e a pressão têm influência na solubilidade de um sólido e de um gás em um líquido. Quando a solubilidade aumenta com o aumento da temperatura, teremos uma solubilidade endotérmica. Supomos que a temperatura aumentou de 25°C para 40°C, deste modo aumentando a temperatura à solubilidade de cloreto de sódio também aumenta solubilizando todo o excedente (corpo de fundo) por isso é classificada como supersaturada. Porém, a solução supersaturada é muito instável e resfriando por muito tempo ou oferecendo qualquer perturbação ou adicionando uma quantidade mínima de soluto (cloreto de sódio) o excedente que foi solubilizado pelo aquecimento da solução volta ao fundo do recipiente (corpo de fundo). Quando a solubilidade diminui com o aumento da temperatura, teremos uma solubilidade exotérmica. Algumas solubilidades têm irregularidades, apresentando pontos de inflexão. Ex2: (PUC-RJ) A tabela ao lado mostra a solubilidade de vários sais, à temperatura ambiente, em g/100mL. Se 25mL de uma solução saturada de um desses sais foram completamente evaporados, e o resíduo sólido pesou 13g, identifique o sal. a) AgNO3 b) Al2(SO4)3 c) NaCl d) KNO3 e) KBr Ex3: (PUC-RJ) Observe o gráfico ao lado, que representa a solubilidade em grama por 100g de H2O, de 3 sais inorgânicos em determinada faixa de temperatura. Identifique a afirmativa correta: Solubilidade g/100g de H2O KI a) A solubilidade dos 3 sais aumenta com a temperatura. b) O aumento de temperatura favorece a solubilização do Li2SO4. NaCl c) A solubilidade do KI é maior que as solubilidades dos demais sais, na faixa de temperatura dada. Li2SO4 d) A solubilidade do NaCl varia Temperatura (°C) com a temperatura. e) A solubilidade de 2 sais diminui com a temperatura. Ex8: (UFU-MG) Em condições ambientes, a densidade do mercúrio é de aproximadamente 13g/mL. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de: a) 2600g d) 6500g b) 3200g e) 7400g c) 4800g 5.3 TÍTULO (T) É a relação entre as quantidades de massa ou volume do soluto e da solução, pode ser de 2 maneiras Título em massa ou em volume. Título ou fração em massa (m/m): é o quociente entre a massa do soluto e a massa total da solução (soluto+solvente). Tm = m1 m ou Tm = Em que: Tm = título em massa. m1 = massa do soluto. m2 = massa do solvente. m = massa da solução. m1 m1 + m 2 5. CONCENTRAÇÃO DE SOLUÇÕES São expressões matemáticas que indicam a quantidade de soluto dissolvida numa determinada quantidade de solução. Nessas expressões, o soluto terá o índice 1 e o solvente o índice 2, a solução não possui índice, como demonstrado no ponto 2 deste caderno. Título ou fração em volume (V/V): é o quociente entre o volume do soluto e o volume total da solução (soluto+solvente). 5.1 CONCENTRAÇÃO EM MASSA (C) TV = Concentração em massa é a quantidade em gramas, de soluto existente em 1 litro de solução. Pode ser chamada também de concentração comum ou concentração em grama por litro ou simplesmente concentração. C= Massa do soluto (gramas) Volume da solução (litros) C= m1 V Ex4: A concentração em g/L, da solução obtida ao se dissolverem 4g de cloreto de sódio em 50cm3 de água é: a) 200 g/L d) 12,5 g/L b) 20 g/L e) 80 g/L c) 0,08 g/L Ex5: (U.S.Judas Tadeu-SP) Para transformar a água doce (menor teor de NaCℓ, Cloreto de Sódio) em água salgada (maior teor de NaCℓ, Cloreto de Sódio), foram colocados 2,0 kg de sal de cozinha nesta solução. Sabendose que a concentração comum da água salgada é 40 g/L, qual é o volume final da solução? a) 0,05 L d) 5.000 mL b) 0,80m3 e) 0,45dm3 c) 50,0L Ex6: O leite contém matéria protéica, sais minerais, sais orgânicos e pequenas quantidades de vários produtos, tais como: lecitina, uréia, ácido láctico, vitaminas, enzimas, etc. O leite bovino possui, em média, 33 g de proteína por litro. Qual a massa de proteínas contida em 50 mL desse leite? a) 0,65 g d) 2,65 g b) 1,75 g e) 1,65 g c) 0,75 g 5.2 DENSIDADE (d) Densidade de uma solução é a relação entre a massa da solução e seu volume. Massa da solução Volume da solução V ou C= m V Unidade: (g/mL ou Kg/L) Ex7: 5,0 litros de uma solução tem massa de 20g. A densidade dessa solução é: a) 25 g/L d) 5 g/L b) 20 g/L e) 4 g/L c) 15 g/L Em que: TV = título em volume. V1 = volume do soluto. V2 = volume do solvente. V = volume da solução. V1 TV = V1 + V2 O título não tem unidade (é um número puro) e independe da unidade usada em seu cálculo, note também que o título sempre vai variar entre zero e um (0 < T < 1). Pode também ser expresso em porcentagem (percentual em massa ou volume). T% = 100 x T Unidade: (g/L) C= V1 (0 < T < 100%) Percentual em massa por volume (% m/V): É a massa do soluto, em gramas, presente em 100 mL de solução, ou seja, o percentual é igual ao valor da massa do soluto, em gramas, para cada 100 mL da solução. Deste modo temos: Ex9: %m/V = 10% em massa por volume de H2SO4 indica: 10 g de H2SO4 dissolvido em cada 100 mL de solução. Ex10: %m/V = 0,5% em massa por volume de KI indica: 0,5 g de KI dissolvido em cada 100 mL de solução. Ex11: (F.F.O. Diamantina-MG) Qual o volume de H2O são necessários, a fim de se preparar uma solução, a 20%, em volume, usando 80 mL de soluto? a) 400 d) 500 b) 320 e) 560 c) 480 Ex12: Uma massa de 40g de NaOH são dissolvidas em 160g de água. A porcentagem, em massa, de NaOH presente nesta solução é de: a) 20% d) 80% b) 40% e) 100% c) 10% Ex13: Uma solução aquosa de NaCl apresenta porcentagem em massa de 12,5%. Isso significa que, para cada 100g de solução, teremos ______g de soluto e ______g de solvente. Completa-se corretamente a afirmação acima, respectivamente, com: a) 12,5g e 100 g d) 100g e 12,5g b) 12,5g e 87,5g e) 58,5g e 41,5g c) 87,5g e 12,5g # I.P.C: Relação entre Concentração comum e Título: C = 1000 x d x T Ex14: Uma solução encerra 15g de carbonato de sódio em 135g de água e tem densidade igual a 1,1g/mL. A concentração em massa é a) 160g/L d) 100g/L b) 180g/L e) 110g/L c) 150g/L 5.4 CONCENTRAÇÃO EM MOL POR LITRO OU MOLARIDADE (M) 5.5 FRAÇÃO MOLAR OU FRAÇÃO EM MOLS (x) Até aqui vimos a concentração comum e o título. Nelas aparecem unidade de massa (em mg, g, kg, etc.) e volume (mL, L, m3, etc.), essas concentrações são muito utilizadas no cotidiano como em alimentos, medicamentos, no comércio entre outros. Vamos agora estudar outras formas de concentração, nas quais as quantidades de soluto são expressas em mols. Esses tipos de concentrações são específicas do ramo da química, pois trabalha com quantidade de matéria. Portanto, concentração em mol por litro (concentração molar ou molaridade) é a quantidade de soluto em mols existente em 1 litro de solução. Fração molar, em uma solução, é o quociente entre a quantidade de mols do soluto e a quantidade total de mols da solução (soluto + solvente). M= nº de mols do soluto (mols) Volume da solução (litros) M= n1 # I.P.C: Lembrando que... Em que: m1 = massa do soluto. MM = massa molar do soluto. m1 MM Unidade: g/mol Portanto podemos utilizar também a expressão: M= x1 = m1 MM.V Ex15: Qual a molaridade de uma solução de iodeto de sódio que encerra 45g do sal em 400mL de solução? (Massas atômicas: Na=23; I=127) a) 0,25 mol/L d) 1,05 mol/L b) 0,45 mol/L e) 1,35 mol/L c) 0,75 mol/L Ex16: (UCS-RS) Uma pessoa usou 34,2g de sacarose (C12H22O11) para adoçar um cafezinho. O volume de cafezinho adoçado na xícara foi de 50mL. Qual foi a concentração da sacarose nesse cafezinho? a) 0,5mol/L d) 2,0mol/L b) 1,0mol/L e) 2,5mol/L c) 1,5mol/L Ex17: (UFU-MG) O soro caseiro, recomendado para evitar a desidratação infantil, consiste em uma solução aquosa de cloreto de sódio (NaCl) 0,06mol.L-1 e sacarose (C12H22O11) 0,032mol.L-1. As quantidades (em gramas) de cloreto de sódio e sacarose necessárias para preparar um copo de 200mL de soro caseiro são respectivamente: a) 0,012g e 0,0064g d) 0,024g e 0,128g b) 0,7g e 2,19g e) 0,045g e 3,76g c) 3,51g e 10,94g # I.P.C: Relação entre a Concentração comum e molaridade. C = M . MM1 Ex18: (Cesgranrio-RJ) Num exame laboratorial, foi recolhida uma amostra de sangue, sendo o plasma separado dos eritrócitos, ou seja, deles isolados antes que qualquer modificação fosse feita na concentração de gás carbônico. Sabendo-se que a concentração de CO2, neste plasma, foi de 0,025mol/L, essa mesma concentração, em g/L, é de: a) 1.760 d) 1,1 b) 6x10-4 e) 0,70 c) 2,2 Ex19: (PUC-PR) A solução aquosa de NaOH (soda cáustica) é um produto químico muito utilizado. Uma determinada indústria necessitou uszar uma solução com 20% em massa de hidróxido de sódio, que apresenta uma densidade de 1,2kg/L (Massas atômicas: Na=23; O=16; H=1) Qual a molaridades da solução? a) 12M d) 2M b) 6M e) 1M c) 3M Em que: x1 = fração em mols do soluto. n1 = nº de mols do soluto. n2 = nº de mols do solvente. n1 n1 + n2 Analogamente para o solvente temos por definição: x2 = V Unidade: mol/L n= Matematicamente temos: n2 n1 + n2 A fração molar, assim como o Título, não tem unidade (é um número puro) e independe da unidade usada em seu cálculo, note também que o título sempre vai variar entre zero e um (0 < x < 1). Pode também ser expresso em porcentagem (percentual em massa ou volume). x% = 100 . x (0 < x < 100%) Ex20: Uma solução contém 230g de álcool comum (C2H5OH) e 360g de água. Calcule as frações molares do álcool e da água na solução (massas atômicas: H=1; O=16; C=12). - Cálculo das quantidades de mols: - do álcool: n1 = - da água: n2 = - Total: n1 + m1 MM m2 MM = = 230 46 360 18 n1 = 5 mols n2 = 20 mols n2 = 25 mols - Cálculo das frações molares: - do álcool: x1 = - da água: x2 = n1 n1 + n2 n2 n1 + n2 = = 5 25 20 25 x1 = 0,2 x2 = 0,8 - observe que x1 + x2 = 1 Ex21: (FUERN) Uma solução preparada tomando-se 1 mol de glicose (C6H12O6) e 99 mol de água (H2O) apresenta frações molares de soluto e solvente, respectivamente, iguais a: a) 0,18 e 0,82 d) 0,10 e 0,90 b) 0,82 e 0,18 e) 0,01 e 0,99 c) 0,90 e 0,10 Ex22: Uma solução de ácido nítrico tem concentração igual a 126 g/L de densidade igual a 1,008 g/mL. As frações molares do soluto e do solvente são respectivamente: a) 0,1260 e 0,8820 d) 0,0360 e 0,9640 b) 0,1119 e 0,8881 e) 0,0345 e 0,9655 c) 0,0392 e 0,9607 Ex23: (UFF-RJ) Uma solução contém 18g de glicose (C6H12O6), 24g de ácido acético (C2H4O) e 81g de água (H2O). Qual a fração molar de ácido acético na solução? a) 0,04 d) 0,80 b) 0,08 e) 1,00 c) 0,40 Ex24: Uma solução possui 5 mols de álcool comum e 20 mols de água. Podemos afirmar que as frações molares do soluto e do solvente são, respectivamente, iguais a: a) 5 e 20. b) 20 e 5. c) 20 e 80. d) 0,2 e 0,8. e) 0,8 e 0,2. 5.6 PARTES POR MILHÃO (PPT) É aplicada para soluções extremamente diluídas, onde a massa do solvente é praticamente igual à massa da solução sendo a quantidade de soluto dissolvido muito pequena. 6. DILUIÇÃO DAS SOLUÇÕES É o processo que consiste em adicionar solvente puro a uma solução, com o objetivo de diminuir sua concentração. Como a massa do soluto não se altera, teremos que: i. Parte por milhão em massa: É a massa do soluto, em mg, dissolvida em cada 1 kg de solução ou de solvente. Também pode ser a massa do soluto, em g, dissolvida em cada 1 tonelada de solução ou de solvente. ppm = m1 mg m kg ii. Parte por milhão em volume: É o volume do soluto, em mL, dissolvido em cada 1m3 de solução ou de solvente. ppm = V1 mL V m3 iii. Parte por milhão em massa por volume: É a massa do soluto, em mg, dissolvida em cada 1 litro de solução ou de solvente. ppm = m1 mg V L # I.P.C: Relação entre título e ppm: ppm = 104 x T% Ex25: A química bioinorgânica pode ser tentativamente definida como a parte da química que estuda os elementos químicos dentro do contexto especial dos organismos vivos, sejam eles essenciais à vida, ou necessários em pequeniníssima escala. Os elementos são ditos essenciais quando a sua falta no organismo vai causar algum tipo de disfunção, ou vai debilitar seriamente alguma função orgânica, e a adição desse elemento vai restaurar a saúde daquele organismo. Diversos íons metálicos, como o sódio, potássio, magnésio e cálcio, são necessários para o bom funcionamento de nosso organismo. Precisamos ingerir diariamente uma série desses íons metálicos. Considerando que um adulto de 80 kg ingeriu alimentos com 6 g de uma mistura desses íons, podemos afirmar que a concentração, em ppm, será: a) 75 ppm. d) 60 ppm. b) 70 ppm. e) 50 ppm. c) 65 ppm. Ex26: (UFPE) Em uma estação para tratamento de água, muitas vezes realiza-se a remoção de íons Ca+2 dissolvidos, que são responsáveis pela dureza da água. Essa remoção pode ser conseguida pela adição de carbonato de sódio que irá provocar a precipitação do carbonato de cálcio. Se 100.000 litros de água contendo 98,1 ppm (partes por milhão) de íons Ca+2 precisam ser tratados de acordo com o procedimento acima, quantos quilogramas de carbonato de sódio serão necessários? Ca+2 + Na2CO3 → CaCO3 + 2Na+ a) Aproximadamente 36 kg. b) Aproximadamente 26 kg. c) Aproximadamente 20 kg. d) Aproximadamente 15 kg. e) Aproximadamente 10 kg. Ex27: O monóxido de carbono, um gás poluente e tóxico, é liberado na queima incompleta de diferentes combustíveis. A Organização Mundial de Saúde (OMS), estabeleceu que o ar de boa qualidade pode conter até 4,5 ppm em volume de monóxido de carbono (CO). A porcentagem em volume de CO no ar vale: a) 4,5 x 10-3%. d) 5,4 x 10-3%. -4 b) 4,5 x 10 %. e) 5,4 x 10-4%. c) 4,5 x 10-5%. Ex28: O benzoato de sódio é um sal orgânico aromático mononuclear, de fórmula estrutural indicada ao lado, bastante utilizado na conservação de sucos de frutas, como o de acerola, e refrigerantes, como a coca-cola, sendo adicionado em uma concentração máxima de 0,1%. Qual o valor dessa concentração em partes por milhão? a) 1000 ppm. d) 2500 ppm. b) 1500 ppm. e) 3000 ppm. c) 2000 ppm. C1 x V1 = C2 x V2 Como a massa do soluto não se altera, teremos que: M1 x V1 = M2 x V2 e T1 x m1 = T2 x m2 Ex29: Se adicionarmos 80 mL de água a 20 mL de uma solução 0,20 mol/L de hidróxido de potássio, iremos obter uma solução de concentração molar igual a: a) 0,010 mol/L. d) 0,040 mol/L. b) 0,020 mol/L. e) 0,050 mol/L. c) 0,025 mol/L. Ex30: O volume de água, em mL, que deve ser adicionado a 80 mL de solução aquosa 0,1 M de uréia, para que a solução resultante seja 0,08 M, deve ser igual a: a) 0,8 mL. d) 80 mL. b) 1 mL. e) 100 mL. c) 20 mL. Ex31: Uma solução 0,05 mol/L de glicose, contida em um béquer, perde água por evaporação até restar um volume de 100 mL, passando a concentração para 0,5 mol/L. O volume de água evaporada é, em torno de: a) 50 mL. d) 1000 mL. b) 100 mL. e) 900 mL. c) 500 mL. 7. MISTURA DE SOLUÇÕES DE MESMO SOLUTO Podemos demonstrar que a concentração final está relacionada com as concentrações das soluções misturadas pelas expressões: CF = MF = TF = C1 x V1 + C2 x V2 V1 + V2 M1 x V1 + M2 x V2 V1 + V2 T1 x V1 + T2 x V2 V1 + V2 Ex32: Qual a molaridade de uma solução de NaOH formada pela mistura de 60 mL de solução 5M com 300 mL de solução 2M, da mesma base ? a) 1,5 molar. d) 3,5 molar. b) 2,0 molar. e) 5,0 molar. c) 2,5 molar. Ex33: O volume de uma solução de hidróxido de sódio 1,5 mol/L que deve ser misturado a 300 mL de uma solução 2 mol/L da mesma base, a fim torná-la solução 1,8 mol/L, é: a) 200 mL. d) 400 mL. b) 20 mL. e) 350 mL. c) 2000 mL. Ex34: 200 mL de uma solução aquosa de glicose de concentração 60g/L foram misturados a 300 mL de uma solução de glicose de concentração 120g/L. A concentração da solução final, em g/L, será: a) 96 g/L. d) 180 g/L. b) 9,6 g/L. e) 60 g/L. c) 90 g/L. Ex35: 500 mL de uma solução 1 M de H2SO4 e 1500 mL de uma outra solução 2 M de H2SO4 foram misturados e volume completado para 2500 mL pela adição de água. Identifique a alternativa que apresenta corretamente a molaridade da solução resultante: a) 1,5 M. d) 1,6 M. b) 1,4 M. e) 1,8 M. c) 1,2 M. 8. ANÁLISE VOLUMÉTRICA OU VOLUMETRIA É o processo pelo qual determinamos a concentração de uma solução (ou quantidade de soluto nela existente) pela medição de volume de uma segunda solução, de concentração já conhecida (solução titulante) que reage com a primeira. Esquema da Volumetria - Passo3: Cálculo da quantidade de mols do volume total da solução. I. Pesagem da amostra (0,5g). - Passo4: Cálculo da massa de NaOH na solução. II. Solubilização da amostra. Alíquota: 50mL --------------- 0,002 mols de NaOH Solução: 250mL -------------- Y mols Y = 0,010 mols de NaOH 1 mol de NaOH --------------- 40g de NaOH 0,01 mols ---------------------- Z g Z = 0,4 g de NaOH III. Elevação a volume conhecido (com o balão volumétrico 250mL). - Passo5: Cálculo da pureza da amostra. 0,5 g -------------------------- 100% 0,4 g -------------------------- P P = 80% de pureza. OBS: Podemos calcular também a concentração da solução de NaOH. - Partindo do Passo3 temos: IV. Retirada de uma alíquota (com pipeta 50mL). Alícota: 50mL --------------- 0,002 mols de NaOH Molaridade: 1000mL ------------ M M = 0,4 mol/L E também Concentração Comum: C = M x MM1 C = 0,4 x 40 C = 16 g/L Ex36: Em uma aula de titulometria, um aluno utilizou uma solução de 20 mL de hidróxido de potássio 0,5 mol/L para neutralizar completamente uma solução 1,0 mol/L de ácido sulfúrico. Determine o volume da solução de ácido sulfúrico utilizado pelo aluno: a) 10 mL d) 15 mL b) 5 mL e) 20 mL c) 1 mL V. Titulação. Ex37: Em uma titulação, foram gastos 7,0 mL de uma solução de HNO3 0,70 mol/L como solução reagente para análise de 25,0 mL de uma solução de hidróxido de bário. A concentração, em mol/L, da solução de hidróxido de bário analisada foi: a) 0,098. d) 0,196. b) 0,049. e) 0,070. c) 0,030. A volumetria é muito empregada nos laboratórios e indústrias químicas. Nas indústrias é utilizado no controle de pureza das matérias primas e dos produtos fabricados. Tomando como exemplo o nosso exemplo de titulação, podemos calcular a pureza da amostra de hidróxido de sódio. - Passo1: adotando uma concentração de solução de HCl a 0,2 molar e o volume usado na titulação de 10mL, temos: M = n1 V n1 0,2 = 0,2 n1 = 0,002 mols de HCl x 0,01 0,01 = n1 - Passo2: Relação estequiométrica. HCl + NaOH NaCl + H2O 1 mol ---- 1 mol 0,002 mols ---- X X = 0,002 mols de NaOH Ex38: Quantos gramas de hidróxido de potássio são neutralizados por 250 mL de solução de ácido nítrico de concentração 0,20 mol/L ? Dado: Massa molar do KOH = 56,0 g/mol a) 1,0 g. d) 2,8 g. b) 1,2 g. e) 5,6 g. c) 1,4 g. Ex39: 20 mL de uma solução aquosa de NaOH de molaridade desconhecida foram titulados com uma solução aquosa 0,2 mol/L de H2SO4. O volume de ácido gasto na titulação foi de 50 mL. Qual a molaridade da base? a) 1,0 mol/L. d) 0,5 mol/L. b) 2,0 mol/L. e) 4,0 mol/L. c) 3,5 mol/L. Ex40: Na titulação de 10 mL de ácido clorídrico existente numa amostra de suco gástrico, foram gastos 9,0mL de uma solução 0,20 mol/L de hidróxido de sódio. Qual a molaridade do ácido na amostra? a) 1,80 mol/L. d) 0,20 mol/L. b) 0,90 mol/L. e) 0,18 mol/L. c) 0,45 mol/L. Quer uma ajuda em Química, acesse... www.profkemil.ning.com
Download