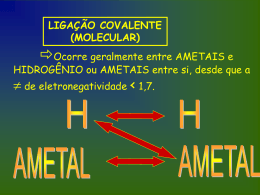
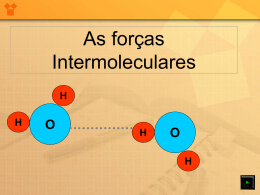
LIGAÇÃO COVALENTE (MOLECULAR) Ocorre geralmente entre AMETAIS e HIDROGÊNIO ou AMETAIS entre si, desde que a de eletronegatividade < 1,7. Ligações covalentes normais Fórmula de Lewis H 1 sigma O H O 1 sigma + 1 pi N N 1 sigma + 2 pi Fórmula estrutural Fórmula molecular HH H2 OO O2 NN N2 Lig. Covalente Simples Lig. Covalente Dupla Lig. Covalente Tripla Orbitais moleculares e Um mesmo átomo pode fazer até 4 ligações covalentes comuns mas, entre dois átomos, o número máximo de ligas covalentes comuns é 3. Dependendo da quantidade de ligações e dos orbitais em que estas se formam, podemos representá-las por ou . A B AB A B GEOMETRIA MOLECULAR “Braços” são ligações simples, duplas, triplas ou dativas que estão em volta do elemento central. xx C N C 2 “Braços” 3 “Braços” 4 “Braços” Moléculas Diatômicas - Linear Moléculas Poliatômicas: 2 “Braços” H2O CO2 3 “Braços” NH3 SO3 4 “Braços” CH4 Sobra e-: ANGULAR Ñ sobra e-: LINEAR Sobra e-: PIRAMIDAL Ñ sobra e-: TRIGONAL TETRAÉDRICA X2 Ex.: H2, N2, O2 Moléculas Diatômicas Geometria: Linear Ângulo: 180° H H XY Ex.: HBr, HCl, HF Moléculas Diatômicas Geometria: Linear Ângulo: 180° H Cl XY2 Ex.: CO2, CS2 2 “Braços” Geometria: Linear Moléculas Poliatômicas Ângulo: 180° O C O XY2 e 2 “Braços” Ex.: SO2 Moléculas Poliatômicas Geometria: Angular Ângulo: 112° S O O XY22e Ex.: H2O, H2S 2 “Braços” Geometria: Angular Moléculas Poliatômicas Ângulo: 105° O H H XY3 Ex.: BF3, BH3 Geometria: Trigonal Plana Ângulo: 120° H 3 “Braços” Moléculas Poliatômicas B H H XY3 e Ex.: NH3, PH3 3 “Braços” Geometria: Piramidal Moléculas Poliatômicas Ângulo: 107° N H H H XY4 Ex.: CH4,CCl4 H Geometria: Tetraédrica 4 “Braços” Moléculas Poliatômicas Ângulo: 109°28’ C H H H Polaridade das ligações químicas Elas podem ser : POLARES E APOLARES Ligação Covalente Polar: Ocorre entre átomos diferentes. Dessa forma, o átomo que possui maior eletronegatividade atrai o par eletrônico compartilhado com maior intensidade. Ex.: HCl. O par eletrônico fica mais próximo do cloro pois este átomo atrai mais fortemente os elétrons da ligação covalente (porque é mais eletronegativo). Pólo: é a região com acúmulo de carga elétrica. + H (Pólo) - Cl Eletronegatividade É uma propriedade periódica importante. É a tendência que um átomo possui em atrair elétrons. A eletronegatividade pode também ser chamada de caráter não-metálico. Sua variação: - Grupo: aumenta de baixo para cima. - Período: aumenta da esquerda para a direita. Ligação Covalente Apolar: Ocorre entre átomos iguais. Dessa forma, os átomos possuem mesma eletronegatividade e atraem, conseqüentemente, o par eletrônico compartilhado com a mesma intensidade. Ex.: H2, O2, N2 H H O par eletrônico é eqüidistante aos dois núcleos Polaridade da Ligação Iônica Escala de eletronegatividade de Linus Pauling em ordem crescente: METAIS, H, P,C, S, I, Br, Cl, N, O, F A ligação Iônica é sempre polar, pois a diferença de eletronegatividade é muito grande (metal e não-metal) Polaridade de moléculas Nº de nuvens eletrônicas ao redor do átomo central Nº de átomos iguais = ligados ao átomo central Molécula apolar Polaridade de moléculas Nº de nuvens eletrônicas ao redor do átomo central Nº de átomos iguais ≠ ligados ao átomo central Molécula polar Polaridade de moléculas • Moléculas diatômicas formadas por átomos iguais são sempre apolares. Ex. O2 • Moléculas diatômicas formadas por átomos diferentes são sempre polares. Ex. HF H H O APOLAR H H Cl POLAR H POLAR H N H C H H POLAR H H H SIMÉTRICA = APOLAR Ligações ou Forças Intermoleculares Essas ligações mantém as moléculas unidas nos estados sólido (muito juntas e quase sem liberdade) e líquido (mais ou menos próximas e com movimento médio) e quando são rompidas, as moléculas passam para o estado gasoso (muito separadas, com muita liberdade). Ligações ou Forças Intermoleculares • Quanto maior a intensidade dessas forças ou ligações, menos volátil é a substância. • Estas ligações dependem, preponderantemente, da polaridade que a substância possui. • Ex: As colas interagem por meio de ligações intermoleculares com os objetos a serem colados. Ligações ou Forças Intermoleculares • Se a substância for polar a ligação será chamada de dipolo-dipolo ou dipolo permanente- dipolo permanente, onde a principal ligação é a ponte de hidrogênio; O pólo negativo de uma molécula atrai o pólo positivo da molécula vizinha e o positivo atrai o negativo. Ex: HCl. A Força Dipolo- Dipolo: • É independente de um meio externo à molécula para sua existência. Suas principais características são: • Ocorre em compostos polares; • Os compostos possuem em sua estrutura pólos bem definidos. Estes pólos são chamados de dipolos permanentes; Forças por Dipolo-dipolo • Em compostos polares, como o HBr, temos a constituição de dipolo permanente entre os elementos que constituem a molécula: +H Br - +H +H • Br - Br - A diferença de eletronegatividade e a geometria molecular determinam a formação do dipolo permanente. Ocorre uma atração eletrostática entre os pólos positivo e negativo do composto. Note que esta atração independe de meio externo à molécula: +H Br - +H Br - +H Forças de dipolo permanente Br - Ligações ou Forças Intermoleculares • Se a substância for apolar a ligação será chamada de dipolo instantâneo- dipolo induzido; Força de London (ou Força de Van der Walls para alguns autores). São forças muito fracas. Ex: H2 A força de Van der Walls ocorre em todas as substâncias, polares ou apolares, mas é a única das apolares. Dipolo instantâneo- dipolo induzido • Dependem de um fator externo à molécula para que possam existir. O fator pode ser a pressão, carga elétrica,etc. • Este fator externo provoca uma ligeira polarização (dipolo induzido ) no composto apolar; Dipolo instantâneo- dipolo induzido • São consideradas forças fracas pois facilmente podem ser extintas, basta para tanto que o fator externo seja impedido de ter sua atuação; • Os principais exemplos de compostos que possuem este tipo de força intermolecular são os hidrocarbonetos. Van der Walls Johannes Diderik Van der Walls, Leiden 1837 - Amsterdan 1923físico holandês que estabeleceu uma equação do estado dos fluídos com maior exatidão do que a dos gases perfeitos. Descobre a lei dos estados correspondentes, porém, seu estudo de maior importância relacionou as forças de atração entre as moléculas, que lhe conferiu o Prêmio Nobel de Física em 1910. Forças de Van der Walls ou de London Os compostos apolares, em geral, estão na fase gasosa, possuindo suas moléculas bem separadas: Moléculas apolares Quando um fator externo ( no caso a pressão ) atua ocorre o desenvolvimento de um dipolo induzido: Dipolo aproximação induzido surgindo, assim, - - + - Pressão causa uma + - + + entre as moléculas o dipolo induzido. - + - + + - + Pontes de Hidrogênio São ligações entre moléculas polares, que se estabelecem quando o hidrogênio, muito polarizado, de uma molécula, une-se com o F, O, N de outra molécula, em conseqüência da atração eletrostática provocada pela grande polaridade dos elementos (são muito fortes). Pontes de Hidrogênio Principais características: • Ocorrem em compostos muito polarizados; • O hidrogênio deve estar ligado a F, O, N • O ( HF ) é o único caso de pontes de hidrogênio na fase gasosa. • H2O e NH3 também são casos de pontes de hidrogênio. FORÇAS INTERMOLECULARES Pontes de H Forças de Van Der Waals Moléc. Polares Muito Fortes Com H ligado a Altos PF e PE FON Dipolo- Moléc. Médias Dipolo Polares (Permanente) Dipolo Instantâneo - Dipolo Induzido Moléc. Muito Fracas Apolares Baixos PF e PE Propriedades Físicas dos Compostos Ponto de Fusão e Ponto de Ebulição Em geral, os pontos de fusão e ebulição das substâncias podem ser previstos através de: • Quanto maior o mol d uma substância maiores serão suas propriedades físicas, • Quando mais intensa a força da atração molecular maiores serão as propriedades físicas. Assim, em resumo, temos: Ligações iônicas Sólido Pontes de hidrogênio Dipólo permanente Líquido Van der Walls Gasoso Propriedades Físicas dos Compostos Ponto de Fusão e Ponto de Ebulição: Em geral, os pontos de fusão e ebulição das substâncias podem ser previstos através de: • Quanto maior o mol de uma substância maiores serão suas propriedades físicas, • Quando mais intensa a força da atração molecular maiores serão as propriedades físicas. Propriedades Físicas dos Compostos Solubilidade É a propriedade que um composto apresenta de ser disseminado em outro através de pequenas partículas. Um exemplo deste fenômeno é a dissolução de uma pequena quantidade de sal de cozinha em água. Propriedades Físicas dos Compostos Regra de Prática Solubilidade: Semelhante tende a dissolver Semelhante Observações: • Os solventes polares mais comuns são H2O, NH3 e álcool, • Os solventes apolares mais comuns são o CCl4, CS2, C6H6 e os hidrocarbonetos. • Os solutos são substâncias dissolvidas em outras chamadas de solventes. Alotropia • É a propriedade pela qual um mesmo elemento químico pode formar duas ou mais substâncias simples diferentes (alótropos ou variedades alotrópicas). Exemplos de alótropos: 1.Oxigênio: O2 (gás oxigênio) e O3 (ozônio) Diferem na atomicidade (número de átomos). O gás oxigênio corresponde a 21% do volume do ar seco e sem poluentes. É importante para a sobrevivência da maioria dos seres vivos e para a combustão (queima). O Ozônio (molécula triatômica, O3) é um gás que está em maior quantidade numa altitude de 20 a 40 km e constitui a camada de ozônio, impedindo a passagem dos raios nocivos do sol. É um gás azul-claro e tem odor intenso, que pode ser sentido após tempestades com descargas elétricas e próximo a equipamentos de alta voltagem. 2. Carbono: Diamante e grafite Diferem no arranjo cristalino dos átomos. O Diamante é um sólido transparente e muito duro (resiste a ser riscado por outras substâncias). É a substância natural mais dura, sendo usado para cortar vidro e fazer brocas, mas não é resistente a impactos (ex. marteladas). A grafite é um sólido escuro e pouco duro. Em 1985 foi descoberta uma nova forma alotrópica: A molécula de fulereno (buckyball) tem 60 átomos de carbono e se parece com uma bola de futebol microscópica. Hoje, já existem outros fulerenos e os pesquisadores acreditam que eles poderão ser usados em baterias combustíveis, lubrificantes, na terapia do câncer, foguetes, etc. 3. Enxofre (S): Rômbico e Monoclínico. O elemento químico enxofre forma moléculas S8 que no estado sólido (amarelo), se agrupam e constituem o retículo cristalino molecular. 4. Fósforo (P): Branco (P4), usado em bombas incendiárias e Vermelho (Pn),macromoléculas, usado nas caixas de fósforo de segurança. Livro didático: Química na abordagem do cotidiano, vol 1, Peruzzo/Canto • • • • • • Polaridade e solubilidade – pg. 145 a 146 Ligações intermoleculares – pg. 146 a 150 Alotropia – pg. 150 a 153. Geometria molecular – pg. 138 a 140 Polaridade das ligações – pg. 141 a 143 Exercícios – Todos, da página 141 à 155.
Download