1 Hidrocarbonetos aromáticos Uma classe especial de hidrocarbonetos cíclicos que contém ligações simples e duplas alternadas no mesmo anel de seis membros. Eles são conhecidos como “Hidrocarbonetos aromáticos” ou “arenos” Exemplo mais simples: Benzeno HC HC H C C H CH HC CH HC Benzeno (I) H C C H ∗ CH CH Benzeno (II) 3 ligações duplas e 3 simples localizadas em posições alternadas num anel plano. - Cada um dos átomos de carbono está também covalentemente ligado a 1 átomo de hidrogênio. As fórmulas (I) e (II) representam o benzeno, mas as ligações duplas e simples foram deslocadas. Os elétrons das 3 ligações duplas podem ser imaginados como se estivessem espalhados (deslocados) sobre os seis átomos de carbono. Assim, cada ligação é agora mais do que uma ligação simples, mas menos do que uma dupla. Diz-se que ela tem caráter parcial de ligação dupla. Esta situação, que é característica de todos os compostos aromáticos, pode ser representada pelas fórmulas (III) e (IV). HC HC H C C H (III) CH CH ou (IV) 2 Os HC aromáticos apresentam propriedades bem incomuns e não reagem da mesma maneira como nos alquenos. Por ex: o benzeno não sofre as reações usuais de adição nas ligações duplas. O benzeno é uma molécula não-polar, insolúvel em água. Como outros HC, ele é extremamente inflamável, mas queima com a chama fuliginosa característica de moléculas aromáticas. Os vapores do benzeno são tóxicos; inalação pode causar parada respiratória e morte. ou Os HC aromáticos podem consistir de anéis “fundidos” entre si, isto é, tendo dois ou mais átomos de carbono em comum. Ex: Naftaleno (C10H8) HC HC H C C H C C H C C H CH CH ⇒ ou Chamado hidrocarboneto aromático ou polinuclear. Substâncias com a qual as "bolinhas" de naftalina são feitas. - Outros compostos policíclicos são feitos por fusão de 3 ou mais anéis benzênicos. Antraceno Fenantreno ∗ Nesta moléculas, os elétrons das ligações duplas estão espalhados sobre todo o sistema anelar aromático. _ Muitos destes tipos de moléculas têm-se revelado como cancerígenos. Ex: Benzopireno Potente agente cancerígeno. Formado pela combustão incompleta do tabaco, hulha e óleo. Encontrado no “alcatrão” da fumaça do cigarro. O benzopireno e outros HC polinucleares estão também presentes em carnes fortemente grelhadas sobre carvão e em peixe defumado, assim como na atmosfera sobre grandes cidades →Poluente do ar. 3 Reações de Hidrocarbonetos aromáticos - Os HC aromáticos ao contrário dos alifáticos, normalmente não sofrem reações de adição, se caracterizam por uma tendência a sofrer substituição heterolítica (por causa da estabilidade do sistema anelar). Exceto hidrogenação (altas energias). Benzeno → Ciclohexano Após a reação de substituição, o benzeno por exemplo, retém a aromaticidade do anel, estabilizado por ressonância, o que confere a alta estabilidade a este produto. Substituintes comuns em compostos orgânicos Substituintes Nome do átomo ou radical -F Flúor -Cl Cloro -Br Bromo -I Iodo -OH Hidroxila -SH Sulfidrila -NH2 Amino -NO2 Nitro -SO3H Ácido sulfônico - Os compostos aromáticos sofrem reações de substituição com halogênios. A halogenação pelo próprio halogênio só ocorre na presença de um catalisador como ZnCl2, FeBr3, AlBr3, etc. O catalisador tem natureza de ácido de Lewis e age induzindo um grau de polarização na molécula de halogênio, aumentando com isso seu caráter eletrofílico ( a extremidade mais positiva passa a atacar os elétrons π do núcleo). 4 Ex: Cloração do benzeno δ+ Cl H δCl . FeCl3 δ+ Cl δCl . FeCl3 Cl + + - Cl . FeCl3 Cl + HCl + FeCl3 Outros exemplos de substituição eletrofílica: Nitração Fonte para o agente eletrófilo nitrante: ácido misto H2SO4/HNO3 +2 1) HONO2 + H3O H2SO4 + 2 HSO4- + NO2 + íon nitrônio 2) + 3) NO2 H + NO2 H + NO2 (Lenta) + NO2 + HSO4 + H2SO4 (Rápida) Sulfonação + SO3 SO3H H2SO4 Ácido benzenossulfônico Alquilação + CH3Cl CH3 AlCl 3 + Tolueno HCl 5 Nomenclatura dos derivados do benzeno Dois sistemas são usados na nomenclatura dos benzenos monossubstituídos. 1) Benzeno é o nome-base e o substituinte é simplesmente indicado por um prefixo. Ex: F Br NO2 Bromobenzeno Nitrobenzeno Cl Fluorbenzeno Clorobenzeno 2) O substituinte e o anel benzênico são considerados em conjunto formando novo nome-base. Ex: CH3 OH Tolueno (metilbenzeno) NH2 Fenol (Hidroxibenzeno) Anilina (Aminobenzeno) O SO3H COOH Ácido benzenossulfônico - C Ácido benzóico O CH3 Acetofenona CH3 Anisol Quando dois substituintes estão presentes, suas posições relativas são indicadas pelo uso de orto (o), meta (m) e para (p). - Para o dibromobenzeno Br Br Br Br o - dibromobenzeno orto Br m - dibromobenzeno meta - Para os clorotoluenos CH3 Br p - dibromobenzeno para CH3 CH3 Cl Cl o - Clorotolueno m - Clorotolueno Cl p - Clorotolueno 6 Os dimetilbenzenos são chamados de xilenos. CH3 CH3 CH3 CH3 CH3 CH3 o - xileno p - xileno m - xileno - Se mais de 2 grupos estiverem presentes no anel benzênico, suas posições devem ser indicadas pelo emprego de números. 1 1 1 Cl 2 6 OH NO2 Cl Cl 2 6 6 2 3 5 3 3 5 Cl 4 4 1,2,3-triclorobenzeno Br Cl Cl 2,4-dicloro-1nitrobenzeno NH2 Cl 4 5 3,4-diclorofenol COOH Br NO2 O2N Br 2,4,6-tribromoanilina Ácido 3,5-dinitrobenzóico ∗Quando o próprio anel benzênico é um substituinte ele é chamado grupo fenila. A remoção de um hidrogênio do benzeno produz o radical fenila. Ex: 1 2 3 4 CH3CHCH2CH3 Fragmento de um areno (radical arila) Fenila 2-fenilbutano (Não 2-benzilbutano) - A remoção de um 1 hidrogênio do grupo metila do tolueno → Benzila CH2Cl CH2 Benzila Cloreto de benzila (ou α-clorotolueno) 7 Existem outros compostos aromáticos, altamente reativos (mais do que o benzeno) Possuem elétrons π mais disponíveis e que reagem com halogênios sem a necessidade de ácidos de Lewis. Os derivados halogenados de compostos aromáticos têm aplicação nas mais diversas indústrias. (Problemas ambientais → Alta persistência) - Um exemplo de composto aromático mais complicado é o DDT (dicloro-difenil-tricloroetano) Inseticida que mata efetivamente o mosquito transmissor da malária e febre amarela. CCl3 Cl CH Cl (DDT) Seu uso foi proibido em muitas partes do mundo porque ele pode interromper o equilíbrio natural do meio ambiente, envenenando peixes e enfraquecendo as cascas de ovos das aves. Bioacumulação, Bioconcentração, Metabolização Em muitas aves, os metabólitos interferem na enzima que regula a distribuição de cálcio →ovos com casca fina - Problema semelhante tem sido criado pelas PCBs (bifenilas policloradas) Cl Cl Cl Cl Consistem de 2 anéis aromáticos unidos por uma ligação C-C. Uma PCB ∗ Antes de serem proibidas nos USA, as PCBs eram usadas como líquidos refrigerantes e como fluidos isolantes em equipamentos elétricos e outras aplicações. A estabilidade desses HC aromáticos halogenados é que levaram ao seu grande emprego industrial. Contribuem para os danos ambientais porque se decompões muito lentamente. 8 ESTEREOQUÍMICA A estereoquímica trata da estrutura das moléculas em 3 dimensões Arranjo dos átomos no espaço Isomerismo: – Isômeros estruturais e estereoisômeros Isomeria ⇒ Fenômeno pelo qual dois ou mais compostos apresentam a mesma fórmula molecular, mas fórmulas estruturais diferentes. ∗ Os compostos químicos denominados isômeros. que apresentam isomeria são Isomeria estrutural = Isomeria constitucional Os isômeros estruturais são às vezes classificados em subcategorias: Isômeros de cadeia, isômeros de posição, isômeros de grupo funcional. Fórmula molecular Isômeros constitucionais CH3 (de cadeia) C4H10 CH3CH2CH2CH3 CH3-CH-CH3 Butano Isobutano Cl (de posição) C3H7Cl CH3CH2CH2Cl CH3-CH-CH3 1-cloro-propano 2-cloro-propano (de função) C2H6O CH3CH2OH CH3OCH3 Etanol Éter dimetílico (Álcool etílico) 9 Estereoisômeros Os estereoisômeros não são isômeros estruturais. Os estereoisômeros diferem somente no arranjo dos seus átomos no espaço, pois eles têm os seus átomos constituintes ligados na mesma ordem. Ex: H3C H3C H H H3C C C C C H H Cis-2-buteno CH3 - Isômeros (ambos têm a fórmula molecular C4H8) - Não são isômeros estruturais (a ordem de ligação dos átomos é a mesma) Trans-2-buteno Isômeros que diferem somente no arranjo dos seus átomos no espaço. (“Configurações” diferentes) ∗O termo “configuração” é usado para descrever um arranjo de átomos que não podem ser alterados por simples rotação de grupos ou átomos ao redor de ligações (rotações livres impedidas por substituintes, ligações duplas ou triplas). A configuração não pode ser alterada exceto pela quebra de ligações e a conseqüente formação de outras. ∗ O termo “conformação” é qualquer um dos possíveis arranjos de átomos ou grupos de átomos que são produzidos pela rotação ao redor de enlaces simples. ______________________________________________________ Os estereoisômeros podem ser divididos em duas categorias gerais Enantiômeros e Diastereoisômeros Enantiômeros ⇒ Estereoisômeros que são imagens especulares um do outro (não superponíveis) Diastereoisômeros ⇒ Estereoisômeros que não são imagens especulares um do outro. Ex: Cis e Trans-2-buteno (Não são reflexos especulares) 10 Enantiômeros e moléculas quirais O enantiomerismo ocorre somente com os compostos cujas moléculas são quirais. - Uma molécula quiral pode ser definida como aquela que não é superponível à sua imagem especular. - As moléculas que são superponíveis às suas imagens especulares são aquirais. Quirais → Mãos, luvas Aquirais → Meias Exemplo de objetos: Exemplo de quiralidade: 2-Butanol ⇒ * CH3-CH-CH 2-CH3 OH Imagens especulares - Não superponíveis ∗ Para todas as moléculas que contêm um único átomo quiral haverá a possibilidade da existência de 1 par de enantiômeros. Um carbono quiral é um átomo de carbono que possui 4 grupos diferentes ligados a ele. Carbono 2 H Ex: 2-Butanol 1 3 2 4 CH3-C-CH2-CH3 * OH Carbono quiral ou centro quiral 11 Se dois ou mais grupos que estão unidos a um átomo tetraédrico são iguais, a molécula é superponível à sua imagem especular e é aquiral. Ex: 2-propanol: CH3-CH-CH3 OH CH3 CH3 OH H H HO CH3 CH3 Quando um deles é girado, as duas estruturas são superponíveis (Não são enantiômeros) Representam 2 moléculas de um mesmo composto Elementos de simetria : Planos de simetria Uma outra maneira de reconhecer uma molécula quiral é pela utilização de planos de simetria na molécula. Plano de simetria: Plano imaginário que divide a molécula ao meio, de tal forma que as duas metades são reflexos especulares uma da outra. Ex: 2-cloro-propano 2-cloro-butano ; H Cl CH3 C CH3 H Têm plano de simetria (Aquiral) CH3 C CH2CH3 Cl Não possui simetria (Quiral) 12 Nomenclatura dos enantiômeros: O sistema R e S Os dois enantiômeros do butanol são: Se dermos nome a estes 2 enantiômeros pela IUPAC: Ambos receberão o mesmo nome 2-Butanol Cahn; Ingold; Prelog → Imaginaram um sistema de nomenclatura R ⇒ Direito S ⇒ Esquerdo De acordo com o sistema Cahn-Ingold-Prelog, existem dois enantiômeros do 2-butanol R-2-butanol S-2-butanol - As designações R ou S são feitas com base no que se segue 1) Ordenar os substituintes do carbono quiral por número atômico (seqüência de prioridade). Ao grupo com o menor grupo atômico se atribui o número de mais baixa prioridade, 1; ao grupo com o número atômico imediatamente mais alto se dá o número seguinte, 2, e assim por diante. Ex: 2 CH3 4 H 1 HO CH2CH3 3 Enantiômero (I) do 2-butanol 13 2) Colocar o átomo de mais baixa prioridade o mais afastado do observador (1o Giro) (1a Troca) CH3 CH2CH3 HO H (1a troca) 3) Fazer troca de posições para retornar ao enantiômero de partida (um número par de trocas não altera a configuração do enantiômero) 4 HO 2 3 CH3 CH2CH3 H 1 R (Horário) 4) Traçar um círculo seguindo a seqüência de prioridade (do maior para o menor) Se a direção for horária, o enantiômero é designado R Se for anti-horária, o enantiômero é designado S ∗ A seqüência de prioridade ou regra de precedência para compostos que contêm ligações duplas ou triplas, considera que ambos os átomos são duplicados ou triplicados C A como se fosse C A A C e C A como se fosse A C C A A C 14 Propriedades físico-químicas de enantiômeros ∗ Os enantiômeros têm propriedades físicas idênticas (PF, PE, densidades, índices de refração, solubilidades, espectros de infravermelho, etc), exceto o sentido da rotação do plano de polarização da luz. - Um deles gira o plano da luz para a direita e o outro para a esquerda (de um mesmo ângulo). A luz planopolarizada A luz é um fenômeno eletromagnético. Um feixe de luz consiste de dois campos oscilantes mutuamente perpendiculares: um campo elétrico oscilante e um campo magnético oscilante. Os campos oscilantes elétrico e magnético de um raio de luz ordinária. ⇓ Transformação de luz não-polarizada em luz polarizada Lâmpada origem (luz monocromática) Luz não polarizada Prisma de nicol Luz polarizada Único plano de vibração 15 O dispositivo que é utilizado para medir-se o efeito da luz planopolarizada sobre os compostos opticamente ativos é o polarímetro. O analisador de um polarímetro não é nada mais do que um outro polarizador. - Se o tubo do polarímetro está vazio, ou se uma substância opticamente inativa está presente, os eixos da luz planopolarizada e do analisador estarão exatamente paralelos quando o instrumento indica 0°, e o observador perceberá a quantidade máxima de luz que o atravessa. Quando um feixe de luz planopolarizada passa através de um enantiômero, o plano de polarização gira. Os enantiômeros separados giram o plano de luz planopolarizada de valores iguais, mas em direções opostas. Por causa dos seus efeitos sobre a luz planopolarizada, diz-se que os enantiômeros são compostos opticamente ativos. 16 O número de graus que o plano de polarização é girado, depende do número de moléculas quirais que ele encontra Depende: Comprimento do tubo Concentração do enantiômero Temperatura (T) Comprimento de onda (λ λ) da luz utilizada Base padronizada → Rotação óptica específica [α] Rotação observada [α ] = α C⋅l Comprimento do tubo (dm) Ex: [α ]25 D = +3,1° concentração g/cm 3 ! Não existe correlação óbvia entre a configuração dos enantiômeros (R,S) e a direção na qual eles giram o plano da luz planopolarizada (+, -) Assim, pode existir R(+); R(-); S(+) e S(-) Atividade óptica Quase todas as moléculas individuais (quirais ou aquirais) são teoricamente capazes de produzir uma ligeira rotação do plano de luz planopolarizada. Numa solução: Existem bilhões de moléculas no caminho do feixe luminoso (presentes em todas as orientações possíveis) O efeito do encontro de duas moléculas aquirais pode produzir uma rotação muito pequena para a direita. Antes que o feixe saia da solução pode encontrar uma molécula que tenha uma orientação e que seja a exata imagem especular da primeira. O efeito deste 2o encontro gira o plano de rotação de um mesmo valor, mas em sentido oposto, que cancela exatamente a primeira rotação. O feixe emerge sem rotação resultante (opticamente inativo). Quando um feixe de luz planopolarizada atravessa uma solução “quiral pura” (ex: R-butanol), não há molécula presente cuja orientação sirva exatamente de reflexo especular (ex: S-butanol). O cancelamento exato de todas as rotações produzidas não ocorre. Portanto, uma rotação resultante do plano de polarização é observada (opticamente ativo). 17 Modificação racêmica Uma mistura de partes iguais (equimoleculares) de ambos os enantiômeros, chama-se modificação racêmica. Uma modificação racêmica é opticamente inativa. Misturando-se os dois enantiômeros um com o outro, a rotação causada pelas moléculas de um dos isômeros é anulada por uma rotação exatamente igual e de sinal contrário por um número igual de moléculas do outro. Composto aquiral Modificação racêmica Opticamente inativos ±) Modificações racêmicas ⇒ Geralmente designadas como sendo (± ∗ Uma substância opticamente ativa que consista de um único enantiômero se diz ser “opticamente pura” ______________________________________________________ Diastereoisômeros Estereoisômeros que não são imagens especulares um do outro. Compostos com mais de um centro quiral CH3 CH2 *H C *H C Cl Cl CH3 (Dois centros quirais) 2 ,3-diclorope ntan o Regra para saber quantos estereoisômeros são possíveis 2n, onde n = n° de centros quirais ∗ No 2,3-dicloropentano, não se deve esperar mais do que quatro estereoisômeros. 18 Usando as projeções de Fischer CH2 CH3 *H C *H C Cl Cl CH3 2,3-dicloropentano CH3 CH3 Cl H Cl H CH3 Cl H H Cl Cl H H Cl H Cl Cl H CH2CH3 CH2CH3 I II e III IV CH2CH3 CH2CH3 (II) (I) Pares CH3 (IV) (III) Pares Enantiômeros I III ; II III ; I II e IV IV Diastereoisômeros (Imagens especulares) ∗ Os diastereoisômeros têm propriedades químicas semelhantes, mas não idênticas. (Energias de ativação, estados de transição e velocidades de reação diferentes) ! Os diastereoisômeros têm propriedades físicas diferentes (PE, PF, solubilidades em dado solvente, densidades, índices de refração, etc. diferentes) A rotação específica é diferente ⇒ Podem ter o mesmo ou diferente sinal de rotação e alguns podem ser inativos. ∗ Devido às diferenças nas propriedades físicas, podem ser separados por cristalização fracionada, destilação, cromatografia (diferenças na polaridade). No entanto, somente serão obtidas 2 frações Modificação racêmica de I e II Modificação racêmica de III e IV Para separar os enantiômeros é necessário recorrer à “Resolução das modificações racêmicas”, por meio de reagentes opticamente ativos. 19 Compostos meso (Estruturas mesógiras) Considerando outro exemplo com moléculas C H 3 que contêm dois carbonos quirais: O 2,3-diclorobutano. CH3 CH3 Cl H Cl H *H C Cl Cl CH3 CH3 CH3 Cl H H Cl Cl H H Cl H Cl Cl H CH3 CH3 (II) (I) Pares *H C I II CH3 CH3 (III) (IV) Pares III IV Sobreponíveis (Mesógiros) Enantiômeros (Imagens especulares) 2n → Espera-se 4 estereoisômeros. No entanto só apresenta 3 (I, II e III) ∗ As moléculas (III) e (IV) são aquirais (apesar de conter carbonos quirais) Moléculas aquirais que contêm centros quirais são chamados compostos meso (opticamente inativos). ! Metade da molécula é a imagem da outra metade num espelho (em uma de suas conformações). Plano de simetria. Nomenclatura de compostos com mais de um centro quiral. Utilizam-se as regras de nomenclatura R, S, analisando cada centro separadamente e atribuem-se números a cada um dos carbonos. CH3 Ex: 2,3-dicloropentano 5 CH2 4 *H C 3 Cl *H C 2 Cl CH3 1 20 CH3 2S H 2 Cl H 3 Cl CH2CH3 Estabele-se a sequência de prioridade pelo número atômico. Cl 3R CH3 H Gira-se no sentido dos números atômicos. (2S,3R)-2,3-dicloropentano Horário - R Anti-horário - S Se for mesógiro é desnecessário usar números Por ex: (S,S) (R,R) (S,R) (R,S) 2,3-diclorobutano Reações em que participam estereoisômeros a) Geração de um centro quiral Às vezes uma reação realizada com reagentes cujas moléculas são aquirais fornecem produtos cujas moléculas são quirais. O resultado desta reação é a formação de uma modificação racêmica opticamente inativa. Ex: Cloração de n-butano para dar cloreto de s-butila CH3 CH2 CH2 CH3 C l2 ∆ ou Luz CH3 CH2 CH CH3 Cl (Q u ira l) (A q u ira l) (M o d ifica çã o ra cê m ic a ) 50 R / 50 S ∗ Síntese de compostos quirais a partir de reagentes aquirais Modificações racêmicas. 21 b) Geração de segundo centro quiral Ex: Cloreto de s-butila → Cloração → 2,3-diclorobutano CH3 CH2 *H C Cl CH3 C l2 ∆ ou Luz CH3 *H C *H C Cl Cl CH3 o u tro s + p ro d u to s Formam-se 3 estereoisômeros: (1 par de enantiômeros e 1 mesógiro) Nesta reação são observados 3 aspectos importantes: 1) Como o centro quiral não é destruído, a configuração é mantida. 2) São formadas 2 configurações em torno do centro quiral (resultam do ataque do cloro em lados opostos da porção planar do radical). Formam-se os diastereoisômeros. 3) Os produtos (diastereoisômeros) se formam em quantidades diferentes, porque os ataques (pelo cloro) não são igualmente prováveis. Formação do 1o centro quiral Quantidades enantiômeros racêmica) iguais de (modificação 2o centro quiral Produto com quantidades diferentes de diastereoisômeros. Quando o radical quiral é formado, falta simetria para as faces que serão atacadas terem exatamente a mesma probabilidade. 22 Separação de enantiômeros: Resolução - Uma modificação racêmica é uma mistura equimolecular de enantiômeros. - As propriedades físicas (exceto o desvio da luz planopolarizada) e as propriedades químicas são idênticas. Os métodos convencionais de separação dos compostos orgânicos (cristalização e destilação) falham quando aplicados a modificações racêmicas. ∗ O processo mais útil para a separação de enantiômeros baseia-se em permitir que uma modificação racêmica reaja com um só enantiômero de um outro composto (opticamente ativo). Portanto, uma modificação racêmica é convertida em uma mistura de diastereoisômeros que apresentam pontos de ebulição e fusão diferentes, e podem ser separados por métodos convencionais. ∗ O processo de separação dos enantiômeros de uma modificação racêmica é chamada de resolução. Alguns compostos opticamente ativos obtêm-se de fontes naturais, pois os organismos vivos usualmente produzem apenas um dos enantiômeros do par (estereoespecificidade). Em sistemas biológicos, a estereoespecificidade desempenha um papel preponderante. As enzimas (catalisadores biológicos) atuam sobre compostos em sua maioria opticamente ativos. Ex: Glicose (+) → Importante no metabolismo animal (também na fermentação alcoólica) Glicose (-) → Não participa do metabolismo animal, nem é fermentada por leveduras. Adrenalina (-) → A sua atividade hormonal é muitas vezes superior ao seu respectivo enantiômero. Efedrina (+) → Possui atividade terapêutica e impede a ação do enantiômero (-). Aspargina, Leucina → Somente um dos enantiômeros do par é doce. Ácido lático (+) → Contração dos músculos. Ácido málico(-) → Sumos de frutos. 23 Como a maioria das moléculas orgânicas que ocorrem nos organismos vivos é sintetizada por reações catalisadas enzimaticamente, a maioria ocorre como um só enantiômero. As proteínas, que constituem os músculos e outros tecidos, o glicogênio no fígado ou no sangue, as enzimas e hormonas que regulam o crescimento e os processos fisiológicos, são todos opticamente ativos. ∗ A partir destes compostos naturais, outros compostos opticamente ativos podem ser preparados. As modificações racêmicas podem ser separadas por compostos opticamente ativos. A maioria das resoluções até agora realizadas depende da reação de bases orgânicas com os ácidos orgânicos com formação de sais. Aminas naturais opticamente ativas (-) Quinina (-) Estricnina (-) Brucina ∗ Separação de ácidos racêmicos Ácidos (+) ou (-) tartárico ⇒ Resolução de bases racêmicas Ex: Modificação racêmica de um ácido resolvida usando amina.
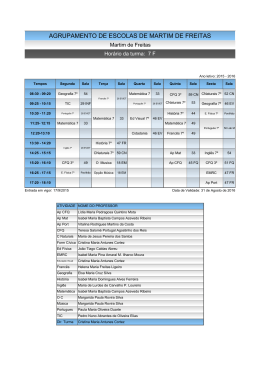
Download