Temperatura e sua medição
Alcinda Maria da Costa Anacleto
Departamento de Física
Faculdade de Ciências da Universidade do Porto
2007
Temperatura e sua medição
Alcinda Maria da Costa Anacleto
Dissertação apresentada na Faculdade de Ciências da Universidade do Porto para
obtenção do grau de Mestre em Física para o Ensino
Departamento de Física
Faculdade de Ciências da Universidade do Porto
2007
I often say that when you can measure what you are speaking about, and
express it in numbers, you know something about it; but when you cannot
measure it, when you cannot express it in numbers, your knowledge is of a
meagre and unsatisfactory kind.
Lord Kelvin
Uma teoria tem tanto mais impacte quanto maior for a simplicidade das suas
premissas, quanto mais diversas forem as coisas relacionadas e quanto maior for
a sua área de aplicabilidade. Daí a impressão profunda que a Termodinâmica
clássica me causou. É a única teoria física de conteúdo universal a respeito da
qual estou convencido que, no quadro da aplicabilidade dos seus conceitos
básicos, nunca será ultrapassada. Somente por estas razões é uma parte muito
importante da formação de um físico.
Albert Einstein
Deve-se dar mais crédito à observação do que às teorias, e a estas só até
ao ponto em que são confirmadas pelos factos observados.
Aristóteles
A natureza não esconde os seus segredos por malícia, mas devido à sua
própria imensidão.
Albert Einstein
Ao meu marido, Joaquim, e aos meus filhos, Joaquim e Inês.
i
Agradecimentos
Ao meu orientador, Professor Doutor Manuel Joaquim Bastos Marques, é devido
um agradecimento especial, pela disponibilidade que sempre manifestou, pelo seu
inestimável apoio e incentivo, e pelas suas valiosas sugestões científicas de cariz teórico
e prático.
Agradeço ao Eng. Paulo Cabral, responsável pelo laboratório de Metrologia da
Temperatura do Instituto Electrotécnico Português, pela simpatia demonstrada e pela
calibração do termómetro que foi usado como referência no trabalho experimental. É
também devida uma palavra de agradecimento ao técnico do laboratório, Sr. Inácio
Gonçalves, que realizou a calibração e que esclareceu amavelmente algumas questões
com ela relacionadas.
Ao Departamento de Física da Faculdade de Ciências da Universidade do Porto,
agradeço a disponibilidade dos seus Laboratórios e, em particular, da oficina para a
construção de algum equipamento.
Ao INESC-Porto, um agradecimento por disponibilizar o laboratório e o
equipamento necessários à realização da experiência do termómetro de Brillouin.
Ao IFIMUP, agradeço a construção do termopar Cobre-Constantan.
Um obrigado à minha colega e amiga Silvina por me ouvir durante as caminhadas e
pela revisão do resumo em Francês. E à minha colega e amiga Anabela Coelho agradeço
os comentários sobre a Tese.
Finalmente, uma palavra de agradecimento a todos os que, de alguma forma,
contribuíram para a realização deste trabalho.
iii
Sumário
A temperatura é, provavelmente, uma das grandezas físicas mais medidas e
controladas. A temperatura está de algum modo presente nas mais variadas situações,
desde o nosso dia-a-dia até à investigação científica. As grandezas e os fenómenos físicos
dependem quase sempre da temperatura, o que a torna um parâmetro da maior relevância.
Além disso é uma variável importante na Termodinâmica, a qual é parte importante dos
currículos do ensino básico e secundário.
O trabalho apresentado centra-se no estudo teórico e experimental da temperatura e
da sua medição.
Numa primeira parte são abordados os conceitos fundamentais da Termodinâmica
necessários para uma melhor compreensão dos tópicos seguintes, introduzindo-se de
seguida os fundamentos de metrologia de temperatura. Estuda-se a problemática da
medição de temperatura na exploração dos diversos tipos de termómetros e dos
princípios físicos que lhes são subjacentes.
Apresentam-se de seguida o resultado de uma calibração de um termómetro de
resistência de platina e uma intercomparação e calibração de vários termómetros, alguns
dos quais baseados em tecnologias de fibra óptica. Outras actividades experimentais,
directamente relacionadas com alguns dos conceitos termodinâmicos abordados, são
também apresentadas.
Finalmente, o trabalho é concluído apresentando-se uma discussão centrada na
definição teórica de temperatura absoluta, com base nos conceitos de Termodinâmica, e
na possibilidade de definir temperatura com base em leis fundamentais da Física e da
constante de Boltzmann.
v
Abstract
Nowadays, temperature is probably the most controlled and measured physical
entity. Temperature is present in a lot of situations from scientific research to day-life.
The physical phenomena and values are temperature dependent, making it an important
parameter. Moreover it is a fundamental parameter in Thermodynamics; which is an
important topic in Basic and Secondary School curricula.
This work is built around the theoretical and experimental study of temperature and
it measurement.
In a first part fundamental concepts from Thermodynamics are touched. These
concepts are needed to a better understanding of the next topics followed by the
fundamentals of temperature metrology. The problems linked to the measurement of
temperature in the context of the different thermometers, together with the physical
phenomena relevant to their work are discussed.
In a second part we present the calibration of a platinum thermometer in a reference
laboratory and a comparison and calibration of several thermometers, some of them
based on optical fibre technology. Some other experimental activities, related to some of
the thermodynamic concepts discussed, are also presented.
The work is concluded with a discussion focused in the theoretical definition of
absolute temperature based on the Thermodynamic concepts and in the possibility of a
new definition of temperature based on the fundamental laws of Physics and on the
Boltzmann constant.
vii
Résumé
Aujourd’hui, la température est probablement l'entité physique la plus contrôlée et
la plus mesurée. La température est présente dans beaucoup de situations soit dans la
recherche scientifique soit dans notre quotidien. Les phénomènes et les valeurs physiques
dépendent de la température, ce qui la rend un paramètre important. En plus c'est un
paramètre fondamental en Thermodynamique qui est une matière importante dans des
programmes d'études d'école secondaire et de base.
Ce travail est établi autour de l'étude théorique et expérimentale de la température
et de sa mesure.
Dans une première partie, sont touchés des concepts fondamentaux de la
Thermodynamique. Ces concepts sont nécessaires pour une meilleure compréhension des
prochaines matières suivies des principes fondamentaux de la métrologie de la
température. On étudie les problèmes liés à la mesure de la température dans le contexte
des différents thermomètres, ainsi que les phénomènes physiques qui les concernent.
Ensuite, on présente le calibrage d'un thermomètre de platine dans un laboratoire de
référence et une comparaison et un calibrage de plusieurs thermomètres, certains d'entre
eux basés sur la technologie de fibre optique. Quelques autres activités expérimentales,
directement rapportées à certains des concepts thermodynamiques discutés, sont aussi
présentées.
On conclut le travail avec une discussion focalisée dans la définition théorique de
la température absolue basée sur les concepts thermodynamiques et dans la possibilité
d'une nouvelle définition de la température basée sur les lois fondamentales de la
physique et sur la constante de Boltzmann.
ix
Índice
1
Introdução ...................................................................................................................... 1
1.1
Objectivos ............................................................................................................. 1
1.2
A relevância do estudo.......................................................................................... 1
1.3
Enquadramento curricular..................................................................................... 2
1.4
Estrutura da Tese................................................................................................... 6
2
Conceitos básicos de Termodinâmica............................................................................ 9
2.1
Domínio da Termodinâmica ................................................................................. 9
2.2
Definições fundamentais..................................................................................... 12
2.2.1
Sistema, vizinhança e fronteira .................................................................. 12
2.2.2
Propriedades de um sistema ....................................................................... 13
2.2.3
Variáveis intensivas, extensivas e conjugadas ........................................... 14
2.2.4
Equilíbrio termodinâmico........................................................................... 14
2.2.5
Trabalho e calor.......................................................................................... 15
2.2.6
Ligações ..................................................................................................... 16
2.2.7
Processos termodinâmicos ......................................................................... 17
2.2.8
Fonte de calor e fonte de trabalho .............................................................. 18
2.3
Primeira Lei da Termodinâmica e Calor............................................................. 19
2.3.1
Trabalho adiabático e energia interna......................................................... 19
2.3.2
Formulação matemática da Primeira Lei.................................................... 20
2.4
A Segunda Lei da Termodinâmica...................................................................... 21
2.4.1
Enunciados de Kelvin-Planck e de Clausius da 2ª Lei ............................... 22
2.4.2
Processos reversíveis e irreversíveis .......................................................... 24
2.4.3
O ciclo e o teorema de Carnot .................................................................... 25
3
Lei zero da Termodinâmica e Temperatura ................................................................. 27
3.1
Noção intuitiva de temperatura ........................................................................... 27
3.1.1
Temperatura como sensação ...................................................................... 27
3.1.2
Capacidade térmica .................................................................................... 28
3.1.3
Capacidade térmica mássica da água; a caloria.......................................... 32
3.1.4
Condutividade térmica ............................................................................... 33
3.2
Conceito de temperatura ..................................................................................... 39
3.2.1
Equilíbrio térmico ...................................................................................... 39
3.2.2
Lei zero da Termodinâmica........................................................................ 40
3.2.3
Definição de temperatura ........................................................................... 41
3.2.4
O ponto de vista microscópio..................................................................... 46
3.3
Radiação térmica................................................................................................. 49
3.3.1
A teoria clássica da radiação do corpo negro ............................................. 55
3.3.2
A distribuição de Boltzmann...................................................................... 62
3.3.3
A teoria de Planck da radiação do corpo negro.......................................... 66
4
Metrologia da temperatura........................................................................................... 71
4.1
Introdução ........................................................................................................... 71
4.2
Breve história da medição de temperatura .......................................................... 72
4.3
Termometria e escalas termométricas................................................................. 79
4.3.1
Escalas de temperaturas e princípios gerais ............................................... 79
4.3.2
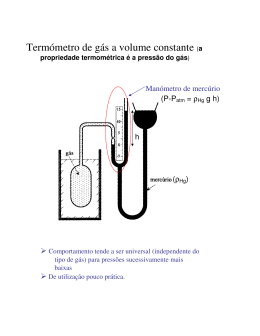
Termómetro de gás a volume constante ..................................................... 83
4.3.3
Calibração e padrões de medida ................................................................. 86
4.3.4
Padrão de temperatura termodinâmica ....................................................... 89
4.4
A Escala Internacional de Temperatura (ITS-90) ............................................... 89
xi
Temperatura e sua medição
5
Tipos mais usuais de termómetros e sua aplicação...................................................... 93
5.1
Termómetros de dilatação ................................................................................... 93
5.1.1
Termómetro de dilatação de líquido ........................................................... 93
5.1.2
Termómetros de dilatação de sólidos (termómetro bimetálico) ................. 98
5.2
Termómetros baseados no efeito Seebeck........................................................... 99
5.2.1
Constituição................................................................................................ 99
5.2.2
Características gerais ................................................................................ 100
5.2.3
Princípio de funcionamento...................................................................... 100
5.2.4
Efeito Seebeck .......................................................................................... 101
5.2.5
O termopar................................................................................................ 103
5.2.6
Efeito Peltier............................................................................................. 105
5.2.7
Efeito de Thomson ................................................................................... 107
5.2.8
As leis do funcionamento dos termopares ................................................ 108
5.2.9
Termopares mais usuais e suas características ......................................... 111
5.3
Termómetro de resistência ................................................................................ 114
5.3.1
Termo-resistências metálicas.................................................................... 115
5.3.2
Termístores ............................................................................................... 120
5.4
Termómetros de pressão de gás ........................................................................ 122
5.5
Termómetro de radiação infravermelha e visível.............................................. 123
5.5.1
Termopilha ............................................................................................... 123
5.5.2
Pirómetro .................................................................................................. 124
5.6
Outros termómetros e algumas curiosidades..................................................... 129
5.6.1
Termómetros baseados em cristais líquidos ............................................. 130
5.6.2
Termómetros baseados em díodos............................................................ 131
5.6.3
Termómetro decorativo de Galileu........................................................... 133
5.6.4
Inferência de temperaturas atmosféricas passadas ................................... 133
5.6.5
Determinação da temperatura do interior da Terra e de formação das rochas
136
5.6.6
Curiosidades ............................................................................................. 136
6
Calibração e intercomparação de termómetros .......................................................... 139
6.1
Calibração de um TRP (Pt-100) ........................................................................ 139
6.1.1
Introdução................................................................................................. 139
6.1.2
Resultado da calibração ............................................................................ 140
6.1.3
Curvas de ajuste dos pontos de calibração ............................................... 141
6.2
Comparação e calibração de diversos termómetros .......................................... 143
6.2.1
Equipamento experimental utilizado ........................................................ 143
6.2.2
Procedimento experimental ...................................................................... 145
6.2.3
Resultados da inter-comparação ............................................................... 146
6.2.4
Análise dos resultados .............................................................................. 146
6.2.5
Caracterização e calibração dos termístores ............................................. 151
6.2.6
Caracterização e calibração do termómetro de mercúrio.......................... 154
6.2.7
Caracterização e calibração de uma rede de Bragg em fibra óptica ......... 155
6.3
Caracterização e calibração de um Termómetro de Brillouin ........................... 160
6.3.1
Princípio de funcionamento...................................................................... 160
6.3.2
Caracterização experimental..................................................................... 161
6.4
Caracterização de uma termopilha usando uma lâmpada de filamento de
tungsténio 164
7
A Temperatura absoluta ............................................................................................. 167
7.1
Definição de temperatura absoluta .................................................................... 167
7.2
O zero absoluto e eficiência de Carnot.............................................................. 171
7.3
A temperatura absoluta e a dada por um gás..................................................... 172
7.4
Temperatura termodinâmica e termómetros primários ..................................... 173
8
Conclusão................................................................................................................... 179
xii
3 Calibração e intercomparação de termómetros
Referências........................................................................................................................ 181
Índice de figuras................................................................................................................ 185
A1
Certificado de calibração do Pt-100......................................................................... 191
A2
Laboratório de Temperatura – IPQ .......................................................................... 193
A3
Laboratórios de Temperatura acreditados................................................................ 195
A4
Procedimento experimental...................................................................................... 197
xiii
1 Introdução
1.1 Objectivos
Com este trabalho pretende-se abordar o conceito de temperatura e a sua medição.
A temperatura é provavelmente a grandeza física mais medida e que se revela importante
em contextos muito diversificados, desde o científico até ao do quotidiano.
A temperatura é uma variável essencial em Termodinâmica, área da Física que
aborda os fenómenos físicos do ponto de vista macroscópico e cujas leis – em particular
a primeira e a segunda leis – ditam a evolução dos sistemas físicos. Por isso, e porque a
Termodinâmica é, com bastante ênfase, parte integrante dos programas do ensino básico
e secundário (sobretudo nos 7º e 10º anos), um outro objectivo do presente trabalho é
uma abordagem sucinta dos conceitos fundamentais da Termodinâmica.
Como qualquer grandeza física, a temperatura precisa de ser traduzida num número
e respectiva unidade o que nos leva ao problema da sua medição. Nesta perspectiva,
pretende-se abordar a metrologia da temperatura e os termómetros utilizados em diversas
situações e gamas de temperaturas. A Metrologia como ciência da medição compreende
todos os aspectos teóricos e práticos relativos à medição pelo que é essencial para
assegurar a qualidade das medições e a sua validade. Assim pretende-se usar um
termómetro de resistência de platina calibrado nas actividades experimentais de
intercomparação de vários termómetros.
Para além dos objectivos específicos referidos, pretende-se também desenvolver
actividades experimentais de medição de temperatura que envolvam uma diversidade
considerável de instrumentação. Em particular o contacto com alguns termómetros que
envolvem tecnologias de fibra óptica.
1.2 A relevância do estudo
O enriquecimento a nível científico e tecnológico justificaria, por si só, a escolha
do tema abordado. Contudo, as vantagens que advêm deste estudo para a actividade
profissional não poderiam deixar de ser realçadas.
1
Temperatura e sua medição
Apesar de estar bem presente no quotidiano, a dificuldade do conceito de
temperatura é bem patente quando se aborda o conceito do ponto de vista científico num
contexto de ensino/aprendizagem. A sua relação com as leis da Termodinâmica deve ser
bem estabelecida o que implica uma compreensão abrangente da teoria, nomeadamente,
de definições, de conceitos e de leis.
No ensino das ciências, em particular da Física, a Metrologia, é um pré requisito
importante para promover a relação ensino/aprendizagem, visto as ciências dependerem
do conhecimento de grandezas que têm de ser medidas.
Os alunos apresentam, frequentemente, desconhecimento de unidades e grandezas,
têm dificuldades em adequar a linguagem ao significado técnico, de acordo com as
normas estabelecidas pelo Sistema Internacional de Medidas (Silva, 2005). Revelam
também dificuldades em realizar procedimentos de medição.
São poucos os processos de controlo ou propriedades físicas e químicas dos
materiais que não dependam da temperatura. Torna-se assim importante realçar a
necessidade da calibração dos sistemas de medição de temperatura, particularmente os
sensores que influenciam o processo que está sob estudo, de forma a obter
rastreabilidade, medir com a exactidão exigida e com uma incerteza conhecida (Castanho
et al, 2004).
A experiência da maioria dos laboratórios de calibração revela que cerca de 15% de
todos os instrumentos, incluindo termómetros, estão fora das especificações dos
fabricantes (Castanho et al, 2004; Nicholas et al, 1995).
1.3 Enquadramento curricular
A reflexão que tem vindo a ser desenvolvida a partir dos anos 80 do século XX, à
escala internacional, sobre as finalidades da educação científica dos jovens levou a que
cada vez mais se acentuem perspectivas mais culturais sobre o ensino das ciências. O seu
objectivo é a compreensão da Ciência e da Tecnologia, das relações entre uma e outra e
das suas implicações na Sociedade e no Ambiente e, ainda, do modo como os
acontecimentos sociais se repercutem nos próprios objectos de estudo da Ciência e da
Tecnologia (Ministério da Educação, 2001). Os pesquisadores têm apontado a
importância das actividades experimentais como estratégia do ensino da Física para
minimizar dificuldades de se aprender e de se ensinar de modo significativo e consistente
(Moraes et al, 2000). As actividades experimentais são ainda, no processo de
ensino/aprendizagem, promotoras do desenvolvimento de competências, permitindo
2
1 Introdução
recuperar atrasos e contribuir para um nível de literacia e cultural mais elevado dos
alunos que frequentam a escola, aproximando-os dos seus colegas de países mais
desenvolvidos (Ministério da Educação, 2001).
Sob o ponto de vista da ciência, a visão do mundo depende da compreensão dos
fenómenos e das leis que regem esses fenómenos. Esse conhecimento, por sua vez, está
vinculado ao conhecimento quantitativo das grandezas que constituem esses fenómenos.
Em Física a dificuldade de aprendizagem conceptual está relacionada com a falta
de compreensão da quantificação de grandezas físicas fundamentais como comprimento,
tempo, massa, temperatura e dos conceitos matemáticos como o da fracção, medida e
número decimal (Cunha et al, 2004). Talvez por isso o tema Grandezas e Medidas é
reconhecido em documentos curriculares oficiais portugueses como sendo promotor da
aprendizagem conceptual.
Medições de grandezas físicas em geral, e em particular de temperatura, estão
intimamente associadas ao trabalho experimental, que está presente em todos os níveis de
ensino associado à Física e à Química.
Assim no Ensino Básico uma das finalidades do ensino é: A compreensão da
importância das medições, classificações e representações como forma de olhar para o
mundo perante a sua diversidade e complexidade (Ministério da Educação, 2001).
No programa de Física e Química A do Ensino Secundário, um dos objectivos é a
realização de registos e de medições, utilizando instrumentos e unidades adequadas, nas
actividades experimentais. Pode ler-se: “As actividades desenvolvem-se em continuidade
e articulação com a parte prática de Química, onde os alunos foram sensibilizados para
o erro inerente à medição, suas causas, assim como aos procedimentos a adoptar com o
fim de o minimizar e ainda para o significado dos algarismos significativos. Os alunos
devem, portanto, continuar a ter em conta estes aspectos em todas as actividades.
Terão oportunidade de, aos poucos, aprofundarem os conhecimentos sobre erros
experimentais”.
Nos erros experimentais está inserida a problemática da calibração dos
instrumentos de medição, mas parte-se do pressuposto que estes estão calibrados,
tendo-se apenas em conta a sensibilidade da escala utilizada para a apresentação dos
resultados. Na verdade, o conceito de calibração, de cadeia metrológica e de
rastreabilidade dos instrumentos não são abordados. Contudo, dever-se-ia transmitir que
estes conceitos são muito importantes e que, em geral, os instrumentos não se adquirem
calibrados. Muitas vezes a calibração de um instrumento tem um custo superior ao do
próprio instrumento e, além disso, a calibração tem de ser realizada periodicamente.
3
Temperatura e sua medição
Os conceitos tratados neste trabalho são estudados, em parte, no ensino básico,
principalmente no 7º ano de escolaridade e no ensino secundário, em toda a componente
de Física do programa de Física e Química A do 10º ano.
No 7º ano de escolaridade um dos temas a estudar é o da “Energia”, tendo,
sobretudo, uma contextualização social. Os conceitos de temperatura, calor e energia
interna já são abordados nesta altura. Estes conceitos também são muito focados na área
da Química, em diversas situações e em vários anos de escolaridade.
No 10º ano de escolaridade, em toda a componente da Física, os conceitos
abordados neste trabalho são aí explorados. Assim, pode ler-se no programa de Física e
Química A, “O programa do 10º ano desenvolve-se em torno da compreensão da Lei da
Conservação da Energia, permitindo o enquadramento de diversos conceitos (de áreas
como a Termodinâmica, a Mecânica e a Electricidade) numa perspectiva de educação
ambiental”. Mais em pormenor, os objectivos de ensino são:
MÓDULO INICIAL – Das fontes de energia ao utilizador
1. Situação energética mundial e degradação da energia
• Fontes de energia e estimativas de “consumos” energéticos nas principais
actividades humanas
• Transferências e transformações de energia
• Degradação de energia. Rendimento
• Uso racional das fontes de energia
2. Conservação da energia
• Sistema, fronteira e vizinhança. Sistema isolado
• Energia mecânica
• Energia interna. Temperatura
• Calor, radiação, trabalho e potência
• Lei da Conservação da Energia. Balanços energéticos
UNIDADE 1 – Do Sol ao aquecimento
Esta unidade tem como objectivo central a compreensão de que os fenómenos que
ocorrem na Natureza obedecem a duas leis gerais – a 1ª e a 2ª leis da Termodinâmica –
que, em conjunto, regem a evolução do Universo: o modo como as mudanças se
processam é condicionado por uma característica sempre presente – a conservação da
energia em sistemas isolados.
4
1 Introdução
1. Energia – do Sol para a Terra
• Balanço energético da Terra
• Emissão e absorção de radiação. Lei de Stefan-Boltzmann. Lei do deslocamento
de Wien
• Sistema termodinâmico
• Equilíbrio térmico. Lei Zero da Termodinâmica
• A radiação solar na produção da energia eléctrica – painel fotovoltaico
2. A energia no aquecimento/arrefecimento de sistemas
• Mecanismos de transferência de calor: condução e convecção
• Materiais condutores e isoladores do calor. Condutividade térmica
• 1ª Lei da Termodinâmica
• Degradação da energia. 2ª Lei da Termodinâmica
• Rendimento
UNIDADE 2- Energia em movimentos
Aqui, pretende-se continuar a explorar a ideia da conservação da energia em
sistemas isolados, dando agora ênfase apenas a sistemas puramente mecânicos.
1. Transferências e transformações de energia em sistemas complexos –
aproximação ao modelo da partícula material
• Transferências e transformações de energia em sistemas complexos (meios de
transporte)
• Sistema mecânico. Modelo da partícula material (centro de massa)
• Validade da representação de um sistema pelo respectivo centro de massa
• Trabalho realizado por forças constantes que actuam num sistema em qualquer
direcção
• A acção das forças dissipativas
2. A energia de sistemas em movimento de translação
• Teorema da energia cinética
• Trabalho realizado pelo peso
• Peso como força conservativa
• Energia potencial gravítica
• Conservação da energia mecânica
• Acção das forças não conservativas
• Rendimento. Dissipação de energia
5
Temperatura e sua medição
1.4 Estrutura da Tese
Embora não sendo a parte central da Tese, optou-se por apresentar a teoria
relacionada com a temperatura e termómetros seguindo algumas obras apresentadas na
bibliografia. Tal opção permite ao leitor encontrar num único lugar não só a parte
inovadora do trabalho como também conceitos com ela relacionada.
Este trabalho está organizado em oito capítulos. No presente capítulo são
apresentados os objectivos do trabalho, a relevância do estudo e a sua inserção nos
currículos da disciplina de Física e Química A.
Os segundo e terceiro capítulos são em grande parte transcrições de (Anacleto,
2004) e enriquecidos com algumas actividades experimentais.
Os conceitos básicos de Termodinâmica são abordados no segundo capítulo, onde
se apresentam as leis fundamentais e as principais definições.
No terceiro capítulo aborda-se conceptualmente o conceito de temperatura e a sua
relação com a lei zero da Termodinâmica. É também apresentada sucintamente uma
interpretação microscópica da temperatura deixando-se uma discussão mais aprofundada
da temperatura absoluta para o sétimo capítulo. Estando a radiação térmica directamente
relacionada com a temperatura dos corpos e, por isso, usada na medição de temperatura,
faz-se também um estudo das principais leis da radiação.
O quarto capítulo é dedicado à Metrologia da temperatura. Inicia-se com uma breve
história da termometria, seguindo-se uma abordagem dos aspectos metrológicos e a
escala ITS-90.
O quinto capítulo aborda tipos de termómetros, a sua constituição e os princípios
físicos que lhes estão associados.
O sexto capítulo é predominantemente de índole prática. São tratadas actividades
experimentais, que incluem a calibração de um termómetro de resistência de platina, a
intercomparação e calibração de diversos termómetros.
O sétimo capítulo é dedicado ao problema teórico da definição de temperatura
absoluta que ainda não está fechado. O problema é actual e enquadra-se num avanço
científico e tecnológico associado à medição de temperatura e à qualidade da medida. A
primeira parte do capítulo aborda a definição encontrada habitualmente na literatura,
seguindo de perto (Zemansky et al, 1997), (Güémez et al, 1998) e (Anacleto, 2004),
havendo transcrições deste último, com o objectivo de confrontá-la com uma nova
redefinição, tratada na segunda parte do capítulo.
6
1 Introdução
Finalmente, na Conclusão apresentam-se as contribuições do trabalho e algumas
dificuldades encontradas.
Como é importante no contexto do trabalho apresenta-se em anexo o documento de
calibração do termómetro de platina utilizado como referência nas actividades
experimentais. Também se apresenta em anexo informação sobre o Laboratório de
Temperatura do IPQ e uma indicação aos laboratórios nacionais de metrologia da
temperatura acreditados.
7
2 Conceitos básicos de Termodinâmica
Este capítulo trata dos conceitos básicos de Termodinâmica e é em grande parte
transcrição de (Anacleto, 2004). Uma das dificuldades no estudo da Termodinâmica é,
muitas vezes, a falta de uma clara compreensão dos seus conceitos e definições. A
reforçar esta dificuldade está também a linguagem usada que, por vezes, conflitua com a
usada no dia-a-dia. Além disso, ainda perpetuam em manuais escolares alguns termos
desadequados, que tiveram origem no percurso histórico da Termodinâmica, em etapas
onde alguns conceitos não eram bem compreendidos.
Por isso, uma clarificação dos conceitos básicos de Termodinâmica, bem como dos
termos e definições usados, afigura-se imprescindível. Uma linguagem pouco reflectida e
usada com ambiguidade, algumas vezes confundindo os significados correntes com os
significados científicos é por vezes utilizada, o que, aliado ao grau de abstracção inerente
a alguns conceitos da Termodinâmica, não facilita o processo de ensino-aprendizagem.
A linguagem não é apenas uma forma convencional de nos exprimirmos, ela é
indissociável da forma de pensar, das representações abstractas inerentes a qualquer
modelo físico-matemático da realidade.
2.1 Domínio da Termodinâmica
Etimologicamente, a palavra Termodinâmica deriva das palavras gregas therme
(calor) e dynamis (potência), sendo uma descrição dos primeiros esforços para converter
“calor em potência” (Çengel et al, 2001). Segundo estes autores, actualmente a palavra
Termodinâmica é utilizada para referir todos os aspectos relacionados com a energia e as
suas transformações.
Encontra-se na literatura várias definições de Termodinâmica. Para além da já
citada, podemos referir outras:
• É definida frequentemente como a Ciência que estuda a dependência com a
temperatura, de certas propriedades da Matéria.
• Segundo Callen a Termodinâmica é o estudo das consequências a nível
macroscópico de um elevadíssimo número de coordenadas atómicas que, em virtude de
9
Temperatura e sua medição
um cálculo estatístico de médias, não aparecem explicitamente na descrição
macroscópica do sistema (Callen, 1985).
• Para J. Deus, a Termodinâmica trata das transformações energéticas dentro de
um sistema e das transformações energéticas, sob a forma de calor e trabalho, entre um
sistema e o exterior (Deus et al, 2000).
• Para Zemansky é o ramo das ciências maturais que trata das propriedades
macroscópicas da natureza e inclui sempre a coordenada macroscópica temperatura
(Zemansky et al, 1997).
Algumas das definições encontradas para Termodinâmica reforçam concepções
existentes nos alunos para o calor, como por exemplo a dada por Tipler: é a investigação
da temperatura, do calor e das trocas de energia (Tipler, 1994).
A Termodinâmica Clássica, ou simplesmente Termodinâmica, ocupa-se do estudo
das propriedades macroscópicas dos sistemas, não assumindo um modelo para a
constituição da matéria. O único requisito para que um sistema esteja sob a alçada da
Termodinâmica é que ele seja macroscópico, característica que requer um critério para
ser verificada. O sistema será macroscópico se puder ser descrito por variáveis cuja
especificação e definição sejam totalmente independentes de qualquer assunção acerca da
constituição da matéria ao nível corpuscular (Güémez et al, 1998).
A compreensão da estrutura íntima da matéria, nomeadamente a certeza científica
de existência dos átomos é muito recente. Feynman referia-se à importância e dificuldade
em se estabelecer cientificamente a teoria atómica considerando que se, por hipótese,
todo o conhecimento fosse destruído, com excepção de apenas um facto científico,
aquele que deveria ser preservado para permitir às gerações vindouras a mais rápida
evolução científica seria o conhecimento de que “a matéria é constituída por átomos”.
É, sem dúvida, um conhecimento recente, embora uma ideia antiga (desde Demócrito).
No entanto, as leis da Termodinâmica são independentes de qualquer conhecimento ou
consideração a nível microscópico.
Há outras áreas da ciência que abordam os sistemas do ponto de vista
macroscópico, como por exemplo a Mecânica e a Óptica Geométrica. O que distingue a
Termodinâmica dessas outras áreas são, basicamente, os seguintes aspectos:
- A variável tempo não é considerada explicitamente em Termodinâmica.
- As coordenadas espaciais não são relevantes, ou seja, a Termodinâmica não é
uma teoria de campos.
- A variável temperatura é essencial em Termodinâmica para descrever os sistemas
e as suas propriedades.
10
2 Conceitos básicos de Termodinâmica
Uma abordagem dos sistemas em que se tenha em conta a constituição da matéria,
e onde se requer o conhecimento sobre propriedades médias das partículas individuais,
baseado no tratamento estatístico do comportamento de grandes grupos de partículas é
chamada Termodinâmica Estatística ou Mecânica Estatística.
Embora se possa questionar se os dois pontos de vista, o macroscópico e o
microscópico, são ou não incompatíveis, verifica-se que ambos, quando aplicados ao
mesmo sistema, levam às mesmas conclusões. Os dois pontos de vista são conciliáveis
porque as poucas propriedades mensuráveis, cuja especificação constitui o ponto de vista
macroscópico, são médias, durante um dado período de tempo, de um grande número de
propriedades microscópicas.
A grandeza física porventura mais largamente utilizada é a energia. Embora se
tenha a percepção intuitiva do que é a energia, esta grandeza é difícil de ser definida, ou
mesmo impossível. Talvez a melhor forma de a definir será pelos princípios da
conservação onde está envolvida. A energia pode ser vista como a capacidade de
provocar alterações (Çengel et al, 2001). Para um sistema, a energia traduz a sua
capacidade, por interacção com o seu meio exterior, de produzir trabalho ou transferir
calor (Deus et al, 2000). Trabalho e calor são assim transferências de energia,
constituindo os dois mecanismos gerais de troca de energia entre sistemas.
O conceito de energia é, sem dúvida, o conceito mais unificador em Física,
obedecendo ao Princípio da Conservação da Energia. Este princípio estabelece que
durante uma interacção, se levarmos em conta todas as transformações, verificamos que
há uma grandeza que permanece constante – a energia. A energia pode mudar de forma,
mas a quantidade total permanece constante, isto é, a energia não pode ser criada nem
destruída. Este princípio está expresso na Primeira Lei da Termodinâmica, que referida a
um sistema fechado pode escrever-se1 DU = Q + W , onde DU é a variação da energia
interna do sistema2 e Q e W são o calor e o trabalho, respectivamente, as duas interacções
fundamentais para as trocas de energia. U é uma propriedade dos sistemas enquanto que
Q e W referem-se a interacções (entre o sistema e a vizinhança) e dependem dos
processos que levam à transformação do sistema. Por outras palavras, U é uma função de
estado e Q e W são funções de processo.
1
Há autores que defendem que uma formulação mais actual desta lei deve incluir o termo radiação
(Caldeira et al, 2007), embora tal formulação seja controversa (Cruz et al, 2004).
2
Admite-se aqui, sem perda de generalidade conceptual, que as energias potencial e cinética
macroscópicas permanecem constantes durante o processo.
11
Temperatura e sua medição
Mesmo observando-se a conservação da energia, nem todos os processos são
possíveis, ou seja, há condições adicionais a impor à forma de como decorrem os
processos
termodinâmicos.
Estas
restrições
constituem
a
Segunda
Lei
da
Termodinâmica. Como consequência desta lei, verifica-se uma diminuição da energia
disponível para produzir trabalho, o que é caracterizado pela grandeza termodinâmica
entropia: num sistema isolado3 a entropia não pode diminuir. Assim, podemos encarar a
Termodinâmica como a ciência que estuda as interacções entre sistemas e as
propriedades dos sistemas numa perspectiva da conservação da energia e da não
diminuição da entropia.
2.2 Definições fundamentais
2.2.1
Sistema, vizinhança e fronteira
O estudo de qualquer ramo das ciências começa com a definição de uma região
restrita do espaço (ou de uma porção de matéria), recorrendo-se a uma superfície
fechada, real ou imaginária, chamada fronteira. Se a fronteira for real tem o nome de
parede. A região dentro da fronteira e sobre qual recai a nosso estudo é o que
designamos por sistema. Tudo fora do sistema e que pode interagir com este chama-se
vizinhança ou exterior, que pode ser considerada outro sistema (ver Figura 2.1). O
conjunto do sistema e exterior é o universo. Um sistema pode ser dividido em
subsistemas ou ele próprio ser um subsistema de um outro maior.
fronteira
exterior
B
A
C
vizinhança
Figura 2.1
3
Sistema termodinâmico constituído pelos subsistemas A, B e C. A
fronteira separa o sistema do meio exterior, e a vizinhança é a
parte do exterior que interage com o sistema (Anacleto, 2004).
Em rigor, basta que o sistema seja isolado termicamente (Güémez et al, 1998).
12
2 Conceitos básicos de Termodinâmica
O sistema pode ser fechado ou aberto e isolado ou não-isolado. É fechado se não
troca substância com o exterior; caso contrário é aberto. É considerado isolado se não
troca energia com o exterior, caso contrário diz-se não-isolado. Encontra-se
frequentemente na literatura, incluindo os manuais escolares, a definição de sistema
fechado como sendo aquele que não troca matéria com o exterior (Güémez et al, 1998).
No entanto o termo matéria não é adequado por estar associado à massa a qual, pela
relação E = mc 2 , é equivalente a energia4. Um sistema termodinâmico fica especificado
se se conhecer as suas propriedades físico-químicas e as características da fronteira que o
separa da vizinhança. Se a composição química e as propriedades físicas locais são iguais
em todos os pontos o sistema é dito homogéneo. Quando o sistema é composto de vários
subsistemas homogéneos é designado heterogéneo.
As interacções entre diferentes sistemas têm o nome de contactos termodinâmicos
e dependem da natureza dos sistemas e do tipo de fronteiras. O estado do sistema é
definido indicando o conjunto de propriedades ou variáveis físico-químicas que o
caracterizam. É uma evidência experimental, o facto de que todos os sistemas
termodinâmicos isolados têm estados, designados por estados de equilíbrio, cujas
propriedades permanecem constantes (Güémez et al, 1998).
2.2.2
Propriedades de um sistema
Qualquer característica de um sistema é chamada propriedade ou variável
termodinâmica. A título de exemplo, os sistemas mais simples podem ser caracterizados
pela pressão P, a temperatura T, o volume V, e a massa m.
Nem todas as propriedades são independentes, algumas são definidas em função
das outras, tal como no caso de um gás a uma pressão muito baixa (gás ideal), para o
qual se verifica a equação de estado PV = n RT , onde n é a quantidade de substância
expressa em moles e R é a constante molar dos gases de valor R = 8,314 J mol -1 K -1 .
Em termodinâmica clássica a estrutura atómica de uma substância não é
considerada, sendo a substância tida como contínua, homogénea, não apresentando
orifícios macroscópicos. Esta idealização é válida desde que se trabalhe com volumes,
áreas e comprimentos que se apresentem demasiado grandes em relação aos espaços
intermoleculares.
4
A relação E = mc 2 , devida a Einstein, estabelece a equivalência entre a massa m de um sistema e
a sua energia total E, onde c é a velocidade da luz no vazio, cujo valor exacto é 299 792 458 m s -1 .
13
Temperatura e sua medição
2.2.3
Variáveis intensivas, extensivas e conjugadas
As propriedades são extensivas se o valor da variável do sistema é igual à soma dos
seus valores em qualquer conjunto de subsistemas no qual o sistema se decomponha.
São, por isso, ditas variáveis globais. Como exemplo, refira-se a massa, o volume e a
entropia. As propriedades são intensivas se assumirem um valor definido em cada parte
do sistema, sendo assim ditas variáveis locais. Como exemplo, temos a temperatura e a
pressão. As propriedades intensivas de um sistema são independentes da massa, ao
contrário das extensivas, que são proporcionais à massa.
É, por vezes, útil exprimir as variáveis extensivas dividindo-as pela quantidade de
substância (o que só é possível se houver uma única substância), obtendo-se então
variáveis molares. Se se dividirem as propriedades extensivas pela massa, obtêm-se as
variáveis mássicas.
Um conceito muito importante em Termodinâmica é o de variáveis conjugadas.
Diz-se que duas variáveis, uma extensiva, X, e outra intensiva, Y, são conjugadas se o
produto Y dX for uma grandeza infinitesimal com dimensões de energia.
As variáveis independentes de um sistema a que se dão valores arbitrários
designam-se por parâmetros de estado. As funções de estado são variáveis do sistema
que não se consideram independentes, uma vez que são funções dos parâmetros de
estado. A distinção entre parâmetros e funções de estado é basicamente uma questão de
conveniência. As equações de estado relacionam as diferentes variáveis de um sistema.
2.2.4
Equilíbrio termodinâmico
Um sistema está em equilíbrio termodinâmico se as variáveis que o caracterizam
estão definidas e permanecem constantes. Por questões conceptuais e de análise, o
equilíbrio termodinâmico divide-se em equilíbrio térmico, mecânico e químico.
A existência de um estado de equilíbrio num sistema depende da sua proximidade
de outros sistemas, e da natureza da fronteira que o separa dos outros sistemas.
Quando a resultante das forças e o momento resultante são nulos, no interior do
sistema e entre este a sua vizinhança, o sistema está num estado de equilíbrio mecânico.
Quando estas condições não são observadas, o sistema e/ou a sua vizinhança sofrem uma
mudança de estado, que cessará quando o equilíbrio mecânico é restabelecido.
Quando um sistema em equilíbrio mecânico não tende a sofrer espontaneamente
uma mudança na sua estrutura interna, tal como uma reacção química, ou uma
14
2 Conceitos básicos de Termodinâmica
transferência de substância de uma parte do sistema para outra, então está num estado de
equilíbrio químico.
Um sistema em equilíbrio mecânico e químico, separado da sua vizinhança por
paredes diatérmicas5, está em equilíbrio térmico quando não há mudança espontânea das
suas coordenadas termodinâmicas. No equilíbrio térmico, todas as partes do sistema
estão à mesma temperatura, sendo esta a mesma que a temperatura da vizinhança.
Quando estas condições não são satisfeitas, ocorre uma mudança de estado até o
equilíbrio térmico ser atingido. Se o sistema estiver separado da vizinhança por paredes
adiabáticas6, não há interacção na forma de calor e o equilíbrio termodinâmico depende
apenas dos equilíbrios mecânico e químico.
Se todos os três tipos de equilíbrio são verificados, o sistema está num estado de
equilíbrio termodinâmico. Estes estados podem ser descritos em termos de coordenadas
macroscópicas que não envolvem o tempo, isto é, em termos de coordenadas
termodinâmicas.
Quando qualquer um dos três tipos de equilíbrio não se verifica, o sistema está num
estado de não-equilíbrio, não podendo ser descrito por coordenadas termodinâmicas
que se referem ao sistema como um todo.
2.2.5
Trabalho e calor
Os termos trabalho e calor têm significados distintos em ciência e na linguagem do
dia-a-dia. Esta razão por si só justifica fazer-se uma referência crítica a estes conceitos.
Contudo, actualmente os conceitos de trabalho e calor e as suas definições científicas
ainda são objecto de debate, conforme mostram algumas publicações recentes (Anacleto
et al, 2007; Gislason et al, 2005; Besson, 2003).
As interacções que permitem modificar o estado de um sistema com base em
variações expressas por um par de variáveis conjugadas mecânicas dizem-se interacções
do tipo trabalho. Distinguem-se duas formas fundamentais de trabalho: trabalho de
configuração e trabalho dissipativo (Güémez et al, 1998). O trabalho de configuração
corresponde à organização macroscópica do sistema, como, por exemplo, no caso da
variação de volume associado ao movimento de um êmbolo. O trabalho dissipativo
5
Paredes diatérmicas são paredes que permitem a transferência de energia por calor entre o sistema
e a vizinhança.
6
Paredes adiabáticas são paredes que não permitem a transferência de energia por calor entre o
sistema e a vizinhança, mesmo havendo entre eles uma diferença de temperatura.
15
Temperatura e sua medição
corresponde a uma transferência de energia para o sistema na forma de trabalho, mas não
implica uma variação de volume. Como exemplo, podemos pensar na agitação de um
líquido com uma vareta.
Pode também modificar-se o estado do sistema de outra forma, por exemplo,
colocando o sistema em contacto com outro sistema a uma temperatura diferente. Este
tipo de interacção, que não se pode identificar com uma interacção do tipo trabalho
designa-se por interacção térmica, por contacto térmico ou simplesmente por calor
(Güémez et al, 1998).
Os conceitos de trabalho e calor referem-se a dois tipos distintos de interacções
termodinâmicas entre o sistema e a sua vizinhança e só têm significado enquanto ocorrer
a transformação do sistema.
Num estado de equilíbrio as grandezas trabalho e calor não têm significado. Ainda
se lê frequentemente “troca (ou fluxo) de calor”, mas o que se quer dizer é “troca (ou
fluxo) de energia por calor”. O mesmo se verifica para a grandeza trabalho: “troca de
trabalho” significa “troca de energia por trabalho”. Assim, os termos calor e trabalho
aparecem-nos, por vezes, com dois significados em simultâneo: o valor da energia
trocada e o tipo de interacção, o que pode sugerir que o calor (ou o trabalho) é uma
substância que pode passar de uns sistemas para outros, o que é errado7.
2.2.6
Ligações
As paredes impõem condições restritivas designadas por ligações. A imposição de
um volume constante é conseguida por meio de paredes rígidas. Caso contrário, as
paredes são móveis ou êmbolos. As paredes rígidas não permitem a troca de energia por
trabalho de configuração.
A condição de sistema fechado é originada por paredes impermeáveis. Os sistemas
abertos, pelo contrário, têm paredes permeáveis.
Pode fabricar-se paredes que reduzem bastante os contactos térmicos. O caso ideal
e limite deste tipo de parede é o conceito de parede adiabática, que é isoladora térmica
total. Diz-se que um sistema está rodeado por uma parede adiabática quando, a partir do
meio exterior, só for possível provocar mudanças no sistema por meio de contactos do
tipo trabalho. Uma parede adiabática impede a troca de energia por calor entre o sistema
e a vizinhança. Uma parede não adiabática designa-se por parede diatérmica.
7
Na literatura anglo-saxónica aparecem frequentemente os termos heat exchange, work exchange,
heat transfer, heat capacity, entre outros.
16
2 Conceitos básicos de Termodinâmica
2.2.7
Processos termodinâmicos
Designa-se por processo termodinâmico uma transformação de um estado de
equilíbrio noutro, durante a qual as propriedades do sistema variam.
Quando o estado final coincide com o estado inicial diz-se que o processo é cíclico,
caso contrário diz-se que é um processo aberto.
Um processo é espontâneo quando ocorre naturalmente em consequência da
eliminação de uma ou mais ligações. Durante um processo espontâneo o sistema passa,
geralmente, mas não necessariamente, por situações de não-equilíbrio.
Um processo infinitesimal é aquele para o qual, ao eliminarmos ou alterarmos uma
ou mais ligações, as variáveis do sistema sofrem variações infinitesimais, não saindo
praticamente o sistema do equilíbrio. Assim, num processo finito que ocorra mediante
sucessivos processos infinitesimais – processo muito lento ou quase-estático – todos os
estados intermédios são (praticamente) de equilíbrio.
A representação dos processos quase-estáticos em diagramas de variáveis
termodinâmicas correspondem a linhas contínuas que ligam os estados de equilíbrio
inicial e final do sistema. Os processos que passam por situações de não-equilíbrio
(processos não quase-estáticos) não podem ser representados por linhas contínuas, e
representam-se, por exemplo, por linhas a tracejado (ver Figura 2.2).
Y
YA
A
Processo quase-estático
(reversível ou não)
dY
YB
Processo infinitesimal
Processo não quase-estático
(necessariamente irreversível)
XA
Figura 2.2
B
dX
XB
X
Representação, num diagrama das variáveis X e Y, de estados de
equilíbrio e de processos termodinâmicos. Os processos quaseestáticos podem ser representados por linhas contínuas definidas;
os processos não quase-estáticos representamos por linhas a
tracejado (Anacleto, 2004).
17
Temperatura e sua medição
De entre os processos termodinâmicos, salienta-se os seguintes:
• Processo reversível e quase-estático. É uma transformação constituída por uma
sucessão de processos infinitesimais que se pode inverter em cada passo
mediante uma mudança infinitesimal da vizinhança. O termo quase-estático não
é equivalente ao termo reversível. Contudo, todos os processos reversíveis são
necessariamente quase-estáticos e, entre o sistema e a vizinhança, as trocas de
energia por calor dão-se sob diferenças infinitesimais de temperatura, e as trocas
de energia por trabalho dão-se por variações simétricas das variáveis
deslocamento e com diferenças infinitesimais entre as forças de interacção.
• Processo irreversível e quase-estático. É uma transformação constituída por
uma sucessão de processos infinitesimais que não podem surgir por ordem
inversa. Os estados são de equilíbrio, mas a troca de trabalho é dissipativa e/ou a
trocas de energia por calor é originada por diferenças finitas de temperatura
entre o sistema e a vizinhança.
• Processo não quase-estático. É uma transformação durante a qual o sistema não
passa por estados de equilíbrio. Todos os processos não quase-estáticos são
irreversíveis e não podem representar-se em diagramas por linhas contínuas. Ao
contrário, um processo quase-estático é uma sucessão de estados de equilíbrio
que requer que as trocas de energia se processem muito lentamente.
A distinção entre reversibilidade e irreversibilidade é crucial em Termodinâmica,
pois nos sistemas isolados termicamente, a entropia mantém-se nos processos
reversíveis, mas aumenta nos processos irreversíveis (Anacleto, 2004).
2.2.8
Fonte de calor e fonte de trabalho
O conceito de fonte tem um papel relevante em Termodinâmica. São sistemas com
características particulares:
• Fonte de calor (ou reservatório de calor). É um sistema em completo equilíbrio
interno que interage com outros trocando energia apenas por calor. Todos os
processos que nele ocorrem são reversíveis por definição. A temperatura de uma
fonte de calor é bem definida.
18
2 Conceitos básicos de Termodinâmica
• Fonte de trabalho. É um sistema que interage com outro trocando energia
apenas por trabalho. Todos os processos que nele ocorrem são reversíveis e a
sua pressão (mais genericamente, a força generalizada de interacção) é bem
definida.
A principal vantagem na descrição das interacções termodinâmicas recorrendo-se
aos conceitos de fontes reside no facto de todos os fenómenos irreversíveis terem lugar
no interior do próprio sistema e nas interacções deste com a sua vizinhança, não havendo
irreversibilidades no exterior do sistema.
2.3 Primeira Lei da Termodinâmica e Calor
A Primeira Lei da Termodinâmica traduz no essencial o Princípio da Conservação
da Energia. Relaciona os conceitos de calor e de trabalho com o conceito de energia
interna do sistema.
2.3.1
Trabalho adiabático e energia interna
Quando um sistema fechado é completamente envolvido por uma fronteira
adiabática, o sistema só pode interagir com a vizinhança através de troca de energia por
trabalho. A experiência mostra que o trabalho adiabático, Wa , é o mesmo para todos os
processos que ligam o mesmo estado inicial ao mesmo estado final. Este resultado
constitui o postulado restrito da Primeira Lei da Termodinâmica (Zemansky et al, 1997):
Quando um sistema fechado sofre processos adiabáticos entre os mesmos
estados inicial e final, havendo portanto apenas trocas de energia por trabalho,
então a energia trocada por trabalho é a mesma para todos os processos
adiabáticos considerados.
Existe, portanto, uma função de estado cuja diferença dos valores correspondentes
aos estados final e inicial é igual à energia trocada por trabalho adiabático entre o sistema
e a sua vizinhança. Esta função é designada por energia interna, U . Temos então
U f - U i = Wa
(2.1)
19
Temperatura e sua medição
2.3.2
Formulação matemática da Primeira Lei
Consideremos agora um processo termodinâmico arbitrário. Na Figura 2.3 está
representado um processo não-adiabático. As paredes do sistema são diatérmicas estando
o gás em contacto térmico com uma chama a uma temperatura superior, ao mesmo tempo
que sofre uma expansão, o que significa que houve troca de energia por trabalho, W .
Gás
Figura 2.3
Um gás que sofre um processo não-adiabático. Há trocas de
energia por calor e por trabalho (Anacleto, 2004).
Para este tipo de processos, o trabalho (diatérmico) W não é igual a U f - U i e o
princípio da conservação da energia leva-nos a ter que concluir que houve transferência
de energia por outros processos diferentes do trabalho. Esta energia transferida entre o
sistema e a vizinhança devido a uma diferença de temperatura entre o sistema e a sua
vizinhança é designada por calor, Q . Temos então a definição de calor dada por
(
)
Q = U f - Ui - W
(2.2)
e a Primeira Lei da Termodinâmica pode ser então escrita como
DU = Q + W
(2.3)
onde DU é a variação da energia interna do sistema durante o processo e Q e W as
energias trocadas por calor e por trabalho, respectivamente. As grandezas energia
interna, trabalho e calor têm como unidade SI o joule (J).
20
2 Conceitos básicos de Termodinâmica
A Primeira Lei expressa três ideias relacionadas entre si (Zemansky et al, 1997):
(1) a existência duma função de estado, a energia interna; (2) o princípio da conservação
da energia; e (3) a definição de calor como a troca de energia que não pode ser descrita
como trabalho termodinâmico.
Historicamente, não foi fácil compreender que calor estava relacionado com
energia. A ideia de que calor é uma transferência de energia foi referida em 1839 por M.
Séguin, um engenheiro Francês. Em 1842, Mayer, um físico Alemão, descobriu a
equivalência entre calor e trabalho e formulou o Princípio da Conservação da Energia
(Primeira Lei da Termodinâmica).
Para um processo infinitesimal (processo que envolve variações infinitesimais das
coordenadas termodinâmicas) a Primeira Lei toma a forma
dU = d Q + d W
(2.4)
A equação (2.4) mostra que a diferencial exacta dU é a soma de duas diferencias
inexactas, d Q e d W . É interessante notar que a inexactidão do lado direito da equação
não seja encontrada no lado esquerdo. Notemos que dU se refere a uma propriedade do
sistema (energia interna), enquanto que d Q e d W não estão relacionados com
propriedades do sistema, mas referem-se à vizinhança, que interage com o sistema por
processos de transferência de energia. d W pode ser representado em termos do produto
de uma grandeza intensiva (força generalizada) pela diferencial de uma grandeza
extensiva (deslocamento generalizado) – variáveis conjugadas. Por sua vez, d Q
também pode ser expresso em termos de coordenadas termodinâmicas conjugadas, a
temperatura e a entropia, d Q = TdS .
2.4 A Segunda Lei da Termodinâmica
Em princípio, podemos ter processos cíclicos para os quais a energia recebida por
trabalho numa parte do ciclo possa ser totalmente cedida por calor noutra parte do ciclo.
Por outras palavras, temos Q = - W com W > 0 , sendo a transformação de trabalho em
calor é obtida com 100 % de eficiência.
A situação inversa é contudo impossível. Para que ciclicamente calor seja
transformado em trabalho é necessário trocar energia por calor com, pelo menos, duas
fontes, uma que cede energia por calor ao sistema e outra que recebe energia por calor do
21
Temperatura e sua medição
sistema. Assim, a eficiência não poderá ser 100 %. A fonte que cede a energia por calor
ao sistema, Q1 , é designada por fonte quente e a fonte que recebe energia por calor do
sistema, Q2 , é designada por fonte fria.
Um sistema que sofra um processo cíclico (designado por máquina) e que troca
energia por calor com apenas duas fontes é designado por máquina ditérmica.
Se Q1 > 0 , Q2 < 0 , W < 0 , sendo, pela Primeira Lei, Q1 > Q2 , então a máquina
que origina o ciclo é chamada uma máquina térmica. O propósito de tal máquina é
fornecer continuamente energia por trabalho ao exterior descrevendo o mesmo ciclo
repetidamente. A energia trocada por trabalho é a energia útil fornecida pelo sistema, e a
energia trocada por calor com a fonte quente é a energia absorvida. A eficiência térmica
da máquina, h , é definida como
Eficiência térmica =
h=
trabalho realizado
, ou seja,
energia recebida por calor
W
Q
W
== 1+ 2
Q1
Q1
Q1
2.4.1
(2.5)
Enunciados de Kelvin-Planck e de Clausius da 2ª Lei
2.4.1.1 Postulado de Kelvin-Planck
A Figura 2.4 a) mostra um esquema de uma máquina térmica. A experiência mostra
que nenhuma máquina converte a energia extraída por calor da fonte quente em energia
cedida por trabalho sem rejeitar alguma energia por calor para a fonte fria. Esta restrição
negativa constitui a Segunda Lei da Termodinâmica e pode ser formulada de várias
formas. Uma delas é o postulado de Kelvin-Planck (PK):
PK: É impossível construir uma máquina térmica que, operando ciclicamente,
não produza nenhum outro efeito para além do de extrair energia por calor de
uma fonte e realizar uma quantidade equivalente de trabalho.
22
2 Conceitos básicos de Termodinâmica
FONTE
QUENTE
FONTE
QUENTE
Q1
Q1
W
W
Sistema
Sistema
Q2
Q2
Figura 2.4
FONTE
FRIA
FONTE
FRIA
a)
b)
Representação esquemática da operação de: a) uma máquina
térmica; e b) uma máquina frigorífica (Anacleto, 2004).
2.4.1.2 Postulado de Clausius
Se imaginarmos um ciclo realizado numa sequência de transformações oposta à da
máquina térmica, obtemos o que se designa por máquina frigorífica, conforme se ilustra
na Figura 2.4 b). Pela Primeira Lei, Q1 + Q2 + W = 0 , sendo agora Q1 < 0 , Q2 > 0 e
W > 0 , o que nos permite escrever
Q1 = W + Q2
(2.6)
O propósito de uma máquina frigorífica é retirar energia por calor da fonte fria ou
ceder energia por calor à fonte quente. No primeiro caso, a eficiência, h F , é definida por
hF =
Q2
Q
= -1 - 1
W
W
(2.7)
No segundo caso, a máquina frigorífica é designada por bomba de calor, e a
eficiência, h BC , é definida mais convenientemente por
h BC =
Q1
Q
= 1+ 2
W
W
(2.8)
23
Temperatura e sua medição
O propósito da máquina frigorífica é extrair a máxima energia por calor Q2 da
fonte fria com o menor dispêndio possível de trabalho. É sempre necessário haver troca
de energia por trabalho para se transferir energia por calor de uma fonte fria para uma
fonte quente. Esta constatação restritiva leva-nos ao postulado de Clausius da Segunda
Lei (PC):
PC: É impossível construir uma máquina frigorífica que, funcionando
ciclicamente, não produza nenhum outro efeito para além do de transferir energia
por calor de uma fonte para outra a uma temperatura superior.
Os dois postulados, sendo à primeira vista diferentes, são equivalentes e constituem
possíveis enunciados da Segunda Lei (Zemansky et al, 1997). Há outros enunciados da
Segunda Lei, tais como o de Sears-Kestin e o de Carathéodory (Güémez et al, 1998).
2.4.2
Processos reversíveis e irreversíveis
O conceito de processo reversível é fundamental em termodinâmica. Um processo
é dito reversível se ocorre de tal forma que, no final do mesmo, quer o sistema quer o
exterior podem ser restituídos aos seus estados iniciais sem produzir quaisquer
mudanças no resto do Universo. Um processo que não satisfaz totalmente estes
requisitos é dito irreversível (Zemansky et al, 1997).
A questão que imediatamente se levanta é se os processos naturais, em particular,
os processos que nos são familiar, são reversíveis ou não. Como fenómenos dissipativos
estão presentes em todos os processos reais, então, todos os processos naturais são
irreversíveis. Contudo, o conceito de processo reversível é uma idealização útil, pois
podemos na prática ter processos aproximadamente reversíveis, e porque permite
introduzir o conceito de entropia.
Um processo será reversível se ocorrer quase-estaticamente e se não for
acompanhado por nenhum efeito dissipativo (por exemplo atrito). Como é impossível
satisfazer estas duas condições perfeitamente, é óbvio que um processo reversível é uma
abstracção ideal, muito útil em cálculos teóricos, mas afastada da realidade.
24
2 Conceitos básicos de Termodinâmica
2.4.3
O ciclo e o teorema de Carnot
Um ciclo de Carnot é um processo cíclico reversível constituído por dois processos
adiabáticos e dois processos isotérmicos. Durante o ciclo o sistema troca energia por
calor com duas fontes. A fonte com maior temperatura, T1 , é a fonte quente e a fonte com
temperatura menor, T2 , é a fonte fria. As energias trocadas por calor com as fontes
quente e fria são denotados por Q1 e Q2 , respectivamente. Em princípio, um ciclo de
Carnot pode ser levado a cabo por qualquer sistema termodinâmico. A Figura 2.5
representa um ciclo de Carnot num diagrama P-V.
Uma máquina que opera num ciclo de Carnot é designada por máquina de Carnot.
A máquina de Carnot é uma máquina reversível. O ciclo pode ser realizado em qualquer
sentido. Quando é realizado no sentido oposto ao considerado na Figura 2.5 obtemos um
frigorífico de Carnot.
P
2
Q1
3
T1
1
Q2
4
T2
V
Figura 2.5
Ciclo de Carnot representado num diagrama P-V (Anacleto,
2004).
A máquina de Carnot tem uma eficiência máxima. Este facto constitui o Teorema
de Carnot, que pode ser enunciado da seguinte forma:
Nenhuma máquina térmica que opere entre duas fontes pode ser mais eficiente
do que uma máquina de Carnot operando entre as mesmas fontes.
25
Temperatura e sua medição
A prova do teorema pode ser encontrada em vários livros de texto de
Termodinâmica (por exemplo, Zemansky et al, 1997). Decorre do teorema de Carnot o
seguinte corolário do teorema de Carnot pode ser demonstrado facilmente (Zemansky et
al, 1997):
Todas as máquinas de Carnot que operam entre as mesmas fontes têm a
mesma eficiência.
A natureza do sistema que realiza o ciclo de Carnot não tem influência na
eficiência da máquina de Carnot. A característica essencial de uma máquina de Carnot é
que é reversível e opera entre duas fontes apenas. Além disso, as características da
máquina de Carnot são independentes do sistema termodinâmico que realiza o ciclo.
26
3 Lei zero da Termodinâmica e Temperatura
A primeira parte deste capítulo contém algumas transcrições de (Anacleto, 2004),
enriquecidas com actividades experimentais.
3.1 Noção intuitiva de temperatura
A temperatura é, talvez, a grandeza física mais considerada no dia-a-dia. No
domínio científico a temperatura está presente em quase todos os fenómenos naturais e
quase todas as grandezas físicas dependem da temperatura. Contudo a sua compreensão
não é fácil e requer uma reflexão demorada.
3.1.1
Temperatura como sensação
O conceito de temperatura teve uma origem nas vivências do homem. Segundo J.
Deus, a noção de temperatura está ligada às sensações de quente e de frio, ou seja, à
quantidade de aquecimento (Deus et al, 2000). Para Abreu, a temperatura é a grandeza
que nos diz quão quente ou frio está um corpo (Abreu et al, 1994). Quando sentimos que
um corpo está “quente”, dizemos que a sua temperatura é elevada. De modo análogo,
quando sentimos que um corpo está “frio”, dizemos que a sua temperatura é baixa. No
entanto, a nossa percepção de quente e frio é, por vezes, enganadora. Por exemplo, sentese a sensação de frio quando se anda descalço e se passa de um chão de alcatifa para um
de tijoleira à mesma temperatura.
A resposta dos sentidos relativamente à temperatura de um corpo é subjectiva e
qualitativa. Além disso, podemos ter sensações que não correspondem à relação entre as
temperaturas dos corpos em que tocamos. Para além das condições fisiológicas do
indivíduo, as sensações são determinadas em função de certas grandezas físicas que, no
caso da temperatura, são fundamentalmente a capacidade térmica mássica e a
condutividade térmica das substâncias. Abordaremos seguidamente estas duas grandezas
e apresentamos a sua determinação experimental para dois metais.
27
Temperatura e sua medição
3.1.2
Capacidade térmica
A capacidade térmica refere-se à quantidade de energia por calor necessária para
que a temperatura de um sistema de massa m aumente de uma unidade (1 K). O termo
“capacidade calorífica”, que ainda é muito utilizado (sobretudo nos manuais do ensino
superior), implica que o sistema possa armazenar calor, o que é uma ideia errada, pois o
calor não é uma função de estado, ao contrário da energia interna. Uma possibilidade
seria dizer-se capacidade energética interna, mas optámos pelo termo capacidade
térmica, porque pretendemos relacionar a energia trocada por calor com a variação de
temperatura do sistema.
Quando um sistema recebe energia por calor, uma mudança da sua temperatura
pode ou não ocorrer, dependendo do processo que o sistema sofre. Se a temperatura de
um sistema variar de Ti para T f durante a troca de Q unidades energia por calor com a
sua vizinhança, a capacidade térmica média do sistema é definida pela razão
Capacidade térmica média =
Q
T f - Ti
(3.1)
Quando a diferença T f - Ti tende para zero, esta razão aproxima-se de um valor
limite, designado por capacidade térmica C,
C = lim
T f ÆTi
Q
T f - Ti
(3.2)
ou, à temperatura Ti ,
C=
dQ
(3.3)
dT
A capacidade térmica C é medida em J K -1 no sistema SI. Notemos que o segundo
membro de (3.3) não é a derivada de uma função, mas sim a razão de duas grandezas
infinitesimais d Q e dT . A capacidade térmica mássica é definida como
c=
C 1 dQ
=
m m dT
(3.4)
onde m é a massa do sistema, tendo c como unidade J K -1 kg -1 .
28
3 Lei Zero da Termodinâmica e Temperatura
Uma mole é definida como a quantidade de substância que contém tantas entidades
elementares (átomos, moléculas, iões, electrões, ou outras partículas) como de átomos
existentes em, exactamente, 0,012 kg de 12C. Este número de átomos de 12C é chamado
número de Avogadro N A e é igual a 6, 022 ¥ 1023 partículas por mole. Se a massa de um
átomo for m, então a massa de uma mole de átomos é M = mN A . Esta quantidade é a
massa molar M, sendo a quantidade de substância n dada por n = (massa total) M . Se C
é a capacidade térmica de n moles, então a capacidade térmica molar c, tendo como
unidade J K -1 mol -1 , é definida por
c=
C 1 dQ
=
n n dT
(3.5)
As capacidades térmicas mássicas e molares eram anteriormente designadas por
calores específicos, mas tal designação é inadequada e prejudicial à compreensão do
conceito de calor, corroborando a teoria do calórico.
A capacidade térmica pode ser negativa, zero, positiva, ou infinita, dependendo do
processo que o sistema sofre durante a transferência de energia por calor. A capacidade
térmica tem um valor definido apenas para um processo definido. Para um sistema
hidrostático8, d Q dT tem um valor único para todas as medições realizadas a pressão
constante. Nestas condições, C é chamado a capacidade térmica a pressão constante e é
denotada por CP , sendo
Êd Qˆ
CP = Á
Ë dT ˜¯ P
(3.6)
Analogamente, a capacidade térmica a volume constante, CV , é o resultado obtido
mantendo o volume constante; assim,
Êd Qˆ
CV = Á
Ë dT ˜¯ V
8
(3.7)
Um sistema hidrostático é um sistema termodinâmico com massa e composição constantes e que
exerce sobre a sua vizinhança uma pressão hidrostática uniforme, na ausência de campos
gravitacionais e electromagnéticos. Os sistemas hidrostáticos são normalmente caracterizados
pelas variáveis pressão, P, volume, V, e temperatura, T (Zemansky et al, 1997).
29
Temperatura e sua medição
Em geral, CP e CV assumem valores diferentes, com CP > CV , e são funções da
pressão e da temperatura9.
A capacidade térmica mássica a volume constante depende da temperatura da
forma como é ilustrada na Figura 3.1. A altas temperaturas o valor de cV é próximo de
3R , onde R = 8,314 J K -1mol -1 é a constante dos gases ideais. As altas temperaturas
também incluem as temperaturas ambiente vulgares. O facto de cV ser aproximadamente
igual a 3R para altas temperaturas independentemente da substância é chamada lei de
Dulong et Petit.
O desvio desta lei a temperaturas baixas é evidente da Figura 3.1, quando T
decresce, cV também decresce, e anula-se no zero absoluto. Perto do zero absoluto a
capacidade térmica mássica cV é proporcional a T 3 . A explicação deste comportamento
é dada pela teoria quântica, por exemplo, pelos modelos de Einstein e Debye para a
capacidade térmica mássica (Omar, 1993).
cV
3R
0
Figura 3.1
T/K
Capacidade térmica mássica a volume constante, cV , em função
da temperatura. cV tende para zero quando T tende para zero.
A determinação da capacidade térmica mássica de uma substância pode ser obtida
pelo método das misturas (ver anexo A4). No caso da determinação da capacidade
térmica de um sólido, recorre-se a um calorímetro de capacidade térmica conhecida, onde
se mistura uma dada quantidade de água, à temperatura q água , com uma amostra do
9
Uma questão interessante a colocar aos alunos é: por que é que CP é maior que CV ?
30
3 Lei Zero da Termodinâmica e Temperatura
sólido, à temperatura q sólido , obtendo-se a temperatura final da mistura no equilíbrio q f .
Usando o princípio da conservação da energia, a capacidade térmica mássica do sólido,
c , é dada pela expressão
c=
(m
água
)(
+ E q f - q água
msólido (q sólido - q f )
)
(3.8)
cágua
onde mágua e msólido são as massas da água e do sólido, respectivamente; cágua é a
capacidade térmica mássica da água e E é a capacidade térmica do calorímetro expressa
em quantidade equivalente de água.
O equivalente em água do calorímetro, E , pode ser determinado misturando no
calorímetro quantidades de água a temperaturas diferentes e medindo o desvio da
temperatura final da mistura em relação ao valor esperado. O conhecimento deste valor é
importante para minimizar o erro experimental, e, para o calorímetro usado nesta
actividade, foi obtido um valor de E = 1,23 g .
Para um sólido teoricamente feito de aço, dos valores da Tabela 3.1, considerando
cágua = 4,186 J ºC -1 g -1 e E = 1,23 g e utilizando a expressão (3.8), obtivemos para a
capacidade térmica mássica do aço o valor de c = 0, 46 kJ kg -1 ºC -1 .
Para calcularmos a incerteza do valor calculado, analisemos os erros dos termos da
equação (3.8). Os aparelhos usados nas medições eram digitais, pelo que tomamos a
incerteza no último algarismo do número lido. Assim, os erros relativos, Er , dos termos
da
equação
(3.8)
são:
(
)
Er ÈÎ q f - q água ˚˘ = 0, 07 ,
(
Er ÈÎ(q sólido - q f )˘˚ = 1, 7 ¥ 10-3 ,
)
Er [msólido ] = 2, 00 ¥ 10 -4 e Er ÈÎ mágua + E ˘˚ = 4,85 ¥ 10 -5 . O termo que tem maior
(
)
contribuição para o erro do resultado é q f - q água , cujo valor é de apenas 1,5 ºC. O erro
relativo total é 0,072, o que corresponde termos para valor da capacidade térmica mássica
do aço o valor de c = (0, 46 ± 0, 03) kJ kg -1 ºC -1 .
O valor tabelado é c = 0, 469 kJ kg -1 ºC -1 , que está dentro do intervalo de erro.
31
Temperatura e sua medição
Determinação da capacidade térmica mássica do aço
mágua
maço
q água
q aço
qf
206,17 g
50, 04 g
16,9 ºC
74,3 ºC
18, 4 ºC
Tabela 3.1
3.1.3
Valores medidos das grandezas intervenientes na determinação
experimental da capacidade térmica mássica do aço.
Capacidade térmica mássica da água; a caloria
Quando a calorimetria foi desenvolvida em meados do séc. XVIII, as medições
eram restritas à gama de temperaturas entre os pontos de fusão e ebulição da água. A
unidade de calor julgada mais conveniente foi chamada caloria (abreviadamente cal) e
foi definida como a energia por calor necessária para elevar a temperatura de 1 ºC de um
sistema constituído por 1 g de água. Para medir a energia por calor transferida da
vizinhança para a amostra da água, era apenas necessário fazer duas medições: a da
massa da água e a da variação de temperatura da água. Mais tarde, as medições
aperfeiçoaram-se, tornando-se mais precisas, e foram feitas correcções, verificando-se
que a energia por calor necessária para elevar 1 g de água de 0 a 1 ºC era diferente da
energia por calor necessária para elevar, por exemplo, de 30 a 31 ºC. A caloria foi
definida então como sendo a energia por calor necessária para elevar 1 g de água de 14,5
a 15,5 ºC.
A energia por trabalho que tem de ser dissipada na água, por unidade de massa,
para elevar a temperatura de 14,5 a 15,5 ºC foi chamada o equivalente mecânico do
calor, o qual foi medido como sendo 4,1860 J cal -1 . Nos anos 20 do séc. XX, foi
reconhecido que a medição do equivalente mecânico do calor era realmente uma medição
da capacidade térmica mássica da água, usando o joule como unidade de calor. Como o
calor é energia que se transfere e o joule é a unidade SI de energia, a caloria tornou-se
dispensável. Actualmente, entre os físicos e os químicos, a caloria não é usada, e todas as
quantidades térmicas são expressas em joule. Não há nenhum equivalente mecânico do
calor, mas sim capacidade térmica mássica da água, cuja variação com a temperatura de
0 a 100 ºC é mostrada na Figura 3.2.
32
3 Lei Zero da Termodinâmica e Temperatura
Figura 3.2
3.1.4
Capacidade térmica mássica da água em função da temperatura
à pressão atmosférica normal (Zemansky et al, 1997).
Condutividade térmica
Como se refere na secção 3.2.4., a temperatura de um corpo está relacionada como
o estado de vibração das partículas que o constituem.
No processo de calor por condução, as partículas do sistema que está a uma maior
temperatura vibram com uma energia cinética média maior, relativamente ao sistema que
está a uma temperatura menor. Por contacto, as partículas do sistema a uma temperatura
menor, adquirem maior energia de vibração que se transmite às partículas adjacentes,
sendo este mecanismo um processo de transferência de energia por calor, designado por
condução.
O calor por condução, que é característico essencialmente dos sólidos, é um
fenómeno que ocorre sem transporte de matéria e que depende da diferença de
temperatura, das substâncias que constituem os sistemas e da área de contacto.
Os metais são bons condutores térmicos. Além disso, como sabemos, são também
bons condutores eléctricos, o que indicia que há um mecanismo subjacente comum aos
dois fenómenos. De facto, para além da transmissão de energia devido às vibrações dos
iões da rede, os metais têm electrões livres, os quais têm um papel preponderante no
calor por condução, permitindo uma transmissão rápida da energia de uns átomos para os
outros. Portanto, a condução térmica nos metais resulta da combinação dos efeitos da
vibração dos iões na rede cristalina e da energia transportada pelos electrões livres. Os
sólidos não metálicos são, geralmente, maus condutores térmicos, porque a transmissão
de energia se faz apenas entre átomos, moléculas ou iões.
33
Temperatura e sua medição
Nos fluidos, que são os líquidos e os gases, o calor por condução também ocorre.
Neste caso, deve-se às colisões das moléculas durante o seu movimento aleatório. Nos
fluidos, contudo, o mecanismo do calor mais relevante é a convecção.
Consideremos uma porção de um material, na forma de um paralelepípedo, como se
mostra na Figura 3.3. A energia por calor Qcd por condução que atravessa a área A num
intervalo de tempo Dt é dado por
Qcd
DT
= -k A
Dt
Dx
(3.9)
onde DT = T2 - T1 , k é a condutividade térmica do material e Dx é a espessura do
material.
A condutividade térmica, k , define-se como a energia transmitida por segundo
através de uma camada de material de 1 m2 de área e de 1 m de espessura, quando a
diferença de temperatura entre as duas superfícies é 1 K. A unidade SI da condutividade
térmica é W m -1 K -1 .
x
T2
T1
Energia
por calor
Área
A
Dx
Figura 3.3
Fluxo de energia por calor através de uma camada de espessura
Dx e área A, submetida a uma diferença de temperaturas
DT = T2 - T1 .
Fazendo tender para zero a espessura e a área da camada, Dx Æ 0 e A Æ 0 , a
equação (3.9) transforma-se na forma diferencial
d Qcd
dA dt
= -k
dT
dx
(3.10)
34
3 Lei Zero da Termodinâmica e Temperatura
A equação anterior é designada por Lei de Fourier da condução por calor. Fazendo
uma generalização para o caso tridimensional obtém-se a seguinte equação vectorial
(Feynman et al, 1975)
G
G
Ê dT dT dT ˆ
J = -k Á
,
, ˜ = -k —T
Ë dx dy dz ¯
(3.11)
G
onde J é o vector densidade de fluxo de energia por calor, cujo módulo é dado por
J = d Qcd dA dt . A constante de proporcionalidade κ é a condutividade térmica, e é uma
grandeza positiva pois o escoamento da corrente térmica dá-se no sentido contrário ao do
gradiente de temperatura.
Um dos vários métodos para medirmos a condutividade térmica de metais consiste
em utilizarmos os materiais em forma de barra, sendo uma das extremidades aquecida
electricamente (por exemplo) enquanto que a outra extremidade é mantida a uma
temperatura constante, por exemplo, utilizando gelo fundente (0ºC), conforme mostra a
Figura 3.5. A superfície da barra é isolada termicamente, e as perdas de energia através
do isolamento são calculadas subtraindo a taxa a que a energia entra na água da taxa a
que a energia eléctrica é fornecida. Em muitas situações, a perda de energia através da
superfície é muito pequena em comparação com a que flúi através da barra.
Quando a substância a investigar é um não-metal, usamos uma amostra em forma de
um disco fino, e o mesmo método geral é utilizado. O disco é colocado entre dois blocos
de cobre, um dos quais é aquecido electricamente e o outro arrefecido a uma determinada
temperatura usando água. Na maioria dos casos, a taxa a que a energia é fornecida é
praticamente igual à taxa a que entra na água, o que mostra que as perdas pelos bordos
são desprezáveis.
A condutividade térmica dos metais é bastante sensível às impurezas. A mudança de
estrutura devida a um aquecimento contínuo ou um aumento grande de pressão também
afecta o valor da condutividade térmica, k . Contudo, nos sólidos e nos líquidos o valor
de k não muda apreciavelmente com variações moderadas de pressão. A liquefacção
provoca sempre uma diminuição de k , e para um líquido k usualmente aumenta com o
aumento da temperatura. Os sólidos não-metálicos têm um comportamento idêntico ao
dos líquidos. À temperatura ambiente, estes são maus condutores térmicos. Em geral, a
condutividade térmica diminui à medida que a temperatura aumenta. Para temperatura
muito baixas, contudo, o comportamento é bastante diferente, como se vê na Figura 3.4.
35
Temperatura e sua medição
k / W m -1 K -1
T/K
Figura 3.4
Condutividade térmica em função da temperatura para algumas
substâncias (adaptado de Zemansky et al, 1997).
A condutividade térmica de alguns metais mantém-se aproximadamente constante
num grande intervalo de temperatura. Assim, a prata, o cobre, e o ouro, por exemplo, têm
elevadas condutividades térmicas de 100 a 1000 K. Como regra geral, a condutividade
térmica dos metais aumenta à medida que a temperatura diminui, até ser atingido um
máximo. A continuação da diminuição da temperatura origina uma diminuição da
condutividade térmica para zero.
Os gases são os piores condutores do calor. Para pressões acima de certo valor,
dependendo da natureza do gás e das dimensões do recipiente que o contém, a
condutividade térmica é independente da pressão. A condutividade térmica de um gás
aumenta sempre com o aumento da temperatura.
Seguindo um procedimento semelhante ao descrito anteriormente, determinou-se a
condutividade térmica de alguns condutores, utilizando a montagem da Figura 3.5 (ver
anexo A4). Apresenta-se os resultados obtidos para o cobre.
A barra de cobre utilizada tinha um diâmetro médio de 2,5 cm e estava furada para
que se pudesse medir a temperatura na direcção longitudinal, introduzindo-se nos
orifícios um termopar. A distância entre os furos era de 3,5 cm. Para se determinar a
36
3 Lei Zero da Termodinâmica e Temperatura
variação da temperatura ao longo da barra, uma das extremidades era aquecida com água
em ebulição e na outra extremidade era mantida à temperatura do gelo fundente.
Figura 3.5
Fotografia da montagem experimental para a determinação da
condutividade térmica de uma barra condutora.
Quando se atinge o regime estacionário, estabelece-se uma variação linear da
temperatura ao longo da barra, como se mostra na Figura 3.6. Podendo esta situação ser
tratada a uma dimensão, o declive do gráfico corresponde a - dT dx na equação (3.10).
Figura 3.6
Variação da temperatura ao longo da barra depois de atingido o
regime estacionário de propagação de energia por calor.
37
Temperatura e sua medição
A área é obtida a partir do conhecimento do diâmetro da barra e o fluxo de energia
ao longo desta é determinado medindo o aumento de temperatura em função do tempo de
uma dada massa de água (a uma temperatura próxima de 0 ºC) em contacto com a
extremidade fria. O fluxo de energia ao longo da barra é, portanto, dado pelo produto do
declive do gráfico da Figura 3.7 pela capacidade térmica da água, C
(C = m c , sendo
)
m = 335g e c = 4,186 J ºC -1 g -1 .
Da lei de Fourier, expressa pela equação (3.10), obtivemos para a condutividade
térmica da barra (teoricamente feita de cobre) o valor de k = 4,9 J s -1 cm -1 ºC -1 .
Figura 3.7
Aumento da temperatura da água em função do tempo. O declive
é proporcional à taxa de propagação da energia por calor na
barra.
O erro relativo do resultado é dado pela soma dos erros relativos dos termos da
equação (3.10). Os erros absolutos dos declives das rectas dos gráficos foram obtidos a
partir da aplicação Origin (da OriginLab Corporation): dT dx = ( -1,154 ± 0, 023) K cm -1
e dT dt = (0, 0200 ± 0, 0007 ) K s -1 . As outras grandezas que contribuem para o erro final
têm os seguintes valores: diâmetro da barra = (2,5 ± 0,1) cm e m = (335 ± 1) g . Somando
os erros relativos correspondente aos termos da equação (3.10) obtemos para erro relativo
do resultado o valor 0,10.
38
3 Lei Zero da Termodinâmica e Temperatura
Assim, o resultado final vem k = (4,9 ± 0,5) J s -1 cm -1 ºC -1 . O valor tabelado para
o cobre é k = 3,851 J s -1 cm -1 ºC -1 , que não pertence ao intervalo de incertezas do valor
calculado. Uma explicação possível pode ser o facto de que a barra não ser de cobre puro
e, como se referiu anteriormente, a condutividade térmica dos metais é bastante sensível
às impurezas. Outro aspecto a considerar é o facto de que ao medirmos o fluxo de energia
por calor na barra, a extremidade à temperatura mais baixa não era exactamente 0 ºC
(gráfico da Figura 3.7).
3.2 Conceito de temperatura
Antes da compreensão do conceito científico de temperatura procurou-se dar um
carácter quantitativo à distinção subjectiva entre quente e frio, aprendendo a medir a
temperatura de um corpo muito antes de compreendermos a sua natureza física.
A temperatura pode ser vista como um indicador da energia cinética molecular
média de um corpo (Tipler, 1994). No entanto, só a energia cinética de translação
contribui para a grandeza temperatura, aspecto que por vezes não é referido.
3.2.1
Equilíbrio térmico
A abordagem do conceito de temperatura sem se recorrer ao de equilíbrio térmico e
à Lei Zero resulta em ideias confusas, reforçadas pela nossa intuição e percepções
sensoriais. Por isso, é importante introduzir e discutir a temperatura numa base
cientificamente correcta, pois tal atitude trará num médio prazo aos alunos uma
compreensão confortável, e menos conflituosa do ponto de vista conceptual.
O equilíbrio térmico é atingido por dois sistemas depois de estes estarem em
contacto através de uma parede diatérmica. No equilíbrio térmico as coordenadas
termodinâmicas de ambos os sistemas não podem ter valores quaisquer, pois a condição
de equilíbrio térmico impõe uma relação restritiva para os seus valores. O conceito de
equilíbrio térmico traduz uma relação de equivalência com as seguintes propriedades
(Güémez et al, 1998):
a) Reflexiva: todo o sistema está em equilíbrio térmico consigo próprio.
b) Simétrica: se um sistema A está em equilíbrio térmico com sistema B, então B
também está em equilíbrio térmico com A.
39
Temperatura e sua medição
c) Transitiva: verifica-se experimentalmente que, se A está em equilíbrio térmico
com B, e se B está em equilíbrio térmico com C, então A está em equilíbrio térmico com
C (Lei Zero da Termodinâmica).
A Figura 3.8 ilustra a evolução da temperatura de dois sistemas constituídos por
água a diferentes temperaturas, colocados em contacto térmico dentro de um calorímetro.
Utilizou-se dois sensores de temperatura e um sistema automático de aquisição de dados,
verificando-se a evolução no sentido de uma temperatura de equilíbrio comum a ambos
os sistemas.
É importante que os alunos tomem contacto com diferentes tecnologias de
equipamentos laboratoriais, nomeadamente de aquisição automática de dados e diferentes
tipos de termómetros. A observação da necessidade de tempo para se atingir o equilíbrio
térmico é também importante para que compreendam a necessidade de levar em conta o
tempo de resposta de um termómetro.
Esta actividade foi realizada em contexto de aula e insere-se no currículo de Física
e Química A, componente de Física, do 10º ano de escolaridade.
Figura 3.8
3.2.2
Fotografias que ilustram a actividade experimental do estudo do
equilíbrio térmico.
Lei zero da Termodinâmica
A última propriedade da relação de equivalência referida constitui a Lei Zero da
Termodinâmica e está na base do conceito de temperatura, na construção de termómetros
e escalas de temperatura.
A temperatura é pois definida como a propriedade que indica se um sistema está ou
não em equilíbrio térmico com outros sistemas. É uma grandeza escalar e intensiva. A
40
3 Lei Zero da Termodinâmica e Temperatura
atribuição de um número à temperatura consiste na construção de um termómetro e no
estabelecimento de uma escala de temperatura.
3.2.3
Definição de temperatura
A Lei Zero implica a existência de uma função de estado, chamada temperatura.
Suponhamos dois sistemas, A e B, em equilíbrio térmico, e consideremos, por
simplicidade, que os estados de equilíbrio são determinados pelas variáveis X e Y.
Existe, portanto, uma função f AB ( X A , YA , X B , YB ) = 0 tal que a variável YA do
sistema A se pode escrever em função de X A , X B e YB ,
YA = hAB ( X A , X B , YB )
(3.12)
Por outro lado, se os sistemas A e C estiverem também em equilíbrio térmico,
verifica-se a equação f AC ( X A , YA , X C , YC ) = 0 e, analogamente, podemos escrever
YA = hAC ( X A , X C , YC )
(3.13)
Então, pela Lei Zero, B e C estão em equilíbrio térmico, e deve verificar-se a
equação f BC ( X B , YB , X C , YC ) = 0 (independentemente das propriedades de A), pelo que
X A não deve aparecer na equação
YA = hAB ( X A , X B , YB ) = hAC ( X A , X C , YC )
(3.14)
Existe, portanto, uma função, q B ( X B , YB ) = q C ( X C , YC ) , que depende apenas do
estado de cada sistema. Pelo mesmo raciocínio, mas agora partindo de B em equilíbrio
térmico com A e C, e considerando, pela Lei Zero, também A e C em equilíbrio térmico,
obtemos, quando os três sistemas se encontrarem em equilíbrio térmico,
q A ( X A , YA ) = q B ( X B , YB ) = q C ( X C , YC ) .
41
(3.15)
Temperatura e sua medição
Existem, assim, funções das coordenadas X e Y (funções do estado de cada
sistema), sendo estas funções todas iguais quando os sistemas estão em equilíbrio
térmico entre si.
A função q é a temperatura. A temperatura de um sistema é pois a propriedade
que indica se ele está ou não em equilíbrio térmico com outros sistemas. Tem um
carácter escalar, sendo indicada por um número. Como cada subsistema deve estar em
equilíbrio com os outros, uma consequência da propriedade reflexiva, a temperatura tem
de ser uma grandeza intensiva, tomando o mesmo valor em qualquer ponto do sistema. A
forma da função θ, e o número de variáveis necessárias para a especificar, dependem do
sistema termodinâmico em causa.
A Lei Zero da Termodinâmica pode enunciar-se, portanto, numa formulação mais
recente, do seguinte modo:
Existe uma grandeza escalar, chamada temperatura, que é uma propriedade
intensiva dos sistemas termodinâmicos em equilíbrio, tal que a igualdade de
temperatura é a condição necessária e suficiente de equilíbrio térmico.
Nas classes de equivalência referidas anteriormente existe uma Relação de Ordem.
Uma classe de equivalência q1 , classifica-se como de ordem superior à classe q 2 se,
colocando em contacto qualquer sistema da classe q 2 com qualquer sistema da classe q1 ,
o primeiro ( q 2 ) aumentar a sua temperatura e o segundo ( q1 ) a diminuir. Esta relação de
ordem satisfaz as seguintes propriedades:
a) Antissimétrica: se o sistema A aumenta a sua temperatura em contacto com o
sistema B, B não a aumenta em contacto com A.
b) Transitiva: se o sistema A aumenta a sua temperatura em contacto com o
sistema B, e B aumenta a sua temperatura em contacto com o sistema C, então A
também aumenta a sua temperatura em contacto com C.
As relações de equivalência e de ordem referidas estão na base da construção das
escalas termométricas.
3.2.3.1 Isotérmicas
Consideremos um sistema A, no estado X 1 , Y1 , em equilíbrio térmico com outro
sistema B, no estado X 1¢, Y1¢ . Se A é tirado do contacto de B e o seu estado é alterado, é
possível obter um segundo estado X 2 , Y2 que esteja em equilíbrio térmico com o estado
42
3 Lei Zero da Termodinâmica e Temperatura
original X 1¢, Y1¢ do sistema B. A experiência mostra que há um conjunto de estados
X 1 , Y1 ; X 2 , Y2 ; X 3 , Y3 ; ... , cada um em equilíbrio térmico com o estado X 1¢, Y1¢ de B, e
todos eles, pela Lei Zero, estão em equilíbrio uns com os outros. Todos esses estados,
quando representados num diagrama Y -X , pertencem a uma curva como a I representada
na Figura 3.9. Tal curva é chamada isotérmica. Uma isotérmica é o conjunto de todos os
pontos que representam estados de um sistema em equilíbrio térmico com um dado
estado de outro sistema.
Analogamente, em relação ao sistema B, encontramos um conjunto de estados –
X 1¢, Y1¢ ; X 2¢ , Y2¢ ; X 3¢ , Y3¢ ; ... – todos em equilíbrio térmico com um estado X 1 , Y1 do
sistema A, e, portanto, em equilíbrio térmico uns com os outros. Estes estados,
representados no diagrama Y ¢-X ¢ da Figura 3.9, constituem a isotérmica I¢ . Pela Lei
Zero, todos os estados da isotérmica I do sistema A estão em equilíbrio térmico com
todos os estados da isotérmica I¢ do sistema B. I e I¢ são isotérmicas correspondentes
dos dois sistemas.
Sistema A
Y
Y¢
Sistema B
III¢
II¢
I¢
III
X 1 , Y1
X 3¢ , Y3¢
II
X 2 , Y2
X 3 , Y3
X 2¢ , Y2¢
I
X 1¢, Y1¢
X¢
X
Figura 3.9
Isotérmicas correspondentes de dois sistemas termodinâmicos
diferentes A e B (Anacleto, 2004).
Se a experiência fosse repetida com condições iniciais diferentes, outro conjunto de
estados do sistema A pertencentes à curva II podiam ser encontrados, cada um em
equilíbrio térmico com cada estado do sistema B pertencente à curva II¢ . Assim, a
família de isotérmicas I, II, III, ... , do sistema A e a família correspondente I¢ , II¢ , III¢ ,
... , do sistema B podem ser encontradas. Pela Lei Zero da Termodinâmica, podem ser
obtidas isotérmicas correspondentes em outros sistemas C, D, ... .
Notemos que a metrologia da temperatura através da utilização de um termómetro
é uma aplicação directa da Lei Zero e do conceito de equilíbrio térmico. Se o termómetro
43
Temperatura e sua medição
(sistema A) tiver estado em equilíbrio térmico com um padrão à temperatura T0 (sistema
B), e se agora está em contacto térmico com um sistema cuja temperatura queremos
medir (sistema C) e indica o valor T0 , então a temperatura a determinar é a mesma que a
temperatura do padrão, T0 , pois, pela Lei Zero, o sistema cuja temperatura queremos
medir está em equilíbrio térmico com o padrão, embora estes nunca tenham estado em
contacto térmico.
3.2.3.2 Equação de estado térmica
Para além do conceito de temperatura, a Lei Zero permite introduzir o conceito de
equação de estado ou equação de estado térmica, que relaciona, no equilíbrio, as
propriedades de um sistema termodinâmico.
Para o sistema A, a temperatura é dada por q ( X 1 , Y1 ) = q ( X 2 , Y2 ) = q ( X 3 , Y3 ) , ou
seja, podemos escrever a seguinte relação
f ( X , Y ,q ) = 0
(3.16)
que é a equação de estado térmica. A existência de uma equação deste tipo é geral não se
limitando a sistemas termodinâmicos particulares, podendo envolver outras variáveis
para além das X e Y consideradas.
A Termodinâmica, através da Lei Zero, garante a existência de uma equação de
estado para todos os sistemas em equilíbrio, embora não especifique a sua forma. Esta
equação permite relacionar variações de grandezas termodinâmicas.
3.2.3.3 Pontos fixos
Uma questão diferente da definição conceptual de temperatura é a construção
efectiva de uma escala termométrica empírica, usando um termómetro particular. É
necessário encontrar um ou mais estados de referência e substâncias com propriedades
termométricas adequadas. Os estados escolhidos para referência são designados por
pontos fixos, e devem ter como principal característica a sua fácil reprodutibilidade.
Costumava tomar-se o gelo fundente e água em ebulição como pontos fixos, mas
actualmente toma-se só um ponto fixo como referência, o ponto triplo da água. Este
estado corresponde ao estado de equilíbrio entre as três fases da água, ou seja, o ponto
em que a água está em equilíbrio com o gelo e o seu vapor. Este estado termodinâmico é
realizado à pressão de 0,612 kPa e é-lhe atribuído a temperatura de 273,16 K (0,01 ºC).
44
3 Lei Zero da Termodinâmica e Temperatura
Por outro lado, a propriedade da substância usada no termómetro deve variar muito
quando a temperatura varia pouco (elevada sensibilidade).
Convém chamar a atenção que se dois sistemas estão à mesma temperatura, isto
não significa necessariamente que se encontrem em equilíbrio termodinâmico completo.
Para que tal aconteça devem verificar-se mais duas condições: a de equilíbrio mecânico e
a de equilíbrio químico.
Na Figura 3.10 mostra-se os registos de um aluno e a montagem experimental para
a determinação dos pontos de fusão e de ebulição da água.
Partindo de uma mistura de água (líquida) e gelo, aqueceu-se até se obter o estado
de ebulição.
Figura 3.10 Fotografias de um caderno de um aluno (à esquerda) e da
montagem experimental (à direita) relativas à actividade da
determinação dos pontos de fusão e de ebulição da água.
Os resultados são os que se mostram no gráfico da Figura 3.11. Os pontos fixos
correspondentes ao gelo fundente e à água em ebulição correspondem aproximadamente
às temperaturas de 0 ºC e 100 ºC, respectivamente.
45
Temperatura e sua medição
Figura 3.11 Gráfico da evolução da temperatura no aquecimento da água
desde o ponto de fusão até ao ponto de ebulição.
3.2.4
O ponto de vista microscópio
Notemos que o conceito de temperatura apresentado é muito abstracto, o que se
revela no facto de os alunos, sobretudo do ensino básico, sentirem muita dificuldade em
compreender este conceito desta forma. Mesmo insistindo exaustivamente nesta
abordagem do conceito de temperatura, os alunos pautam os seus raciocínios para
explicar certos fenómenos por ideias intuitivas e conceptuais alicerçadas nas suas
experiências vividas e na linguagem que usam de forma sistemática.
A abordagem da temperatura recorrendo-se a uma descrição microscópica é uma
tentativa para facilitar a compreensão do conceito, de uma forma menos abstracta, por
isso, mais intuitiva. Notemos contudo, que o conceito de temperatura é um conceito
macroscópico.
Experimentalmente, observa-se que desde que não haja transição de fase, quando
se fornece energia ao sistema a temperatura aumenta. A sua energia interna também
aumenta originando um aumento da energia das partículas constituintes do sistema.
A energia média de uma partícula, num sistema em equilíbrio estatístico, tem um
valor bem definido dado por:
E=
n E +n E +n E +"
E
= 1 1 2 2 3 3
N
n1 + n2 + n3 + "
(3.17)
onde ni é o número de partículas com energia Ei , sendo  ni = N o seu número total.
46
3 Lei Zero da Termodinâmica e Temperatura
De acordo com a estatística de Maxwell-Boltzmann (ver secção 3.3.2), o número
de partículas correspondentes à energia Ei na distribuição mais provável para a
temperatura T é dado pela expressão
ni = Ae - Ei
kT
(3.18)
onde k é a constante de Boltzmann, e A é uma constante que depende da temperatura,
do número total de partículas e de outras propriedades das partículas do sistema. O valor
de A é determinado impondo a condição de que o número total de partículas do sistema
seja N (conservação do número de partículas).
O valor da exponencial e - Ei
kT
da eq. (3.18) aumenta (diminui) à medida que
Ei kT diminui (aumenta). Podemos concluir que, à medida que Ei kT aumenta
(diminui), a ocupação do estado com energia Ei torna-se menor (maior).
Esta definição de temperatura pode harmonizar-se com a que está associada às
sensações de “calor” e de “frio”, uma vez que o nosso sistema nervoso é afectado pela
energia média das moléculas, o que origina diferentes sensações.
No entanto, relacionar a temperatura com as propriedades microscópicas não é
tarefa fácil, apesar de se aceitar que “a temperatura é uma medida da energia cinética
média das partículas que constituem o sistema”.
Da equação (3.18) e considerando uma distribuição contínua de energia ( N de
valor muito grande), obtemos a lei da distribuição das velocidades para a estatística de
Maxwell-Boltzmann (Deus et al, 2000),
n (v ) =
4N Ê m ˆ
Á
˜
p Ë 2kT ¯
32
Ê m v2 ˆ
v 2 exp Á Ë 2 k T ˜¯
(3.19)
onde m é a massa de cada partícula e n (v ) é o número de partículas com velocidades de
módulo compreendido entre v e v + dv . Na Figura 3.12 apresenta-se o gráfico da
equação (3.19) para o Hélio em equilíbrio termodinâmico a três temperaturas diferentes.
Como se pode observar, à medida que aumenta a temperatura do equilíbrio, a velocidade
média também aumenta.
47
Temperatura e sua medição
Figura 3.12 Distribuição das velocidades de Maxwell-Boltzmann para as
temperaturas de 300 K, 900 K e 1500 K.
A temperatura é um conceito macroscópico (uma partícula não tem temperatura10),
que se pode relacionar com propriedades médias microscópicas. É uma propriedade dos
sistemas termodinâmicos, portanto, propriedade macroscópica que não depende (embora
possa ser relacionada) com a estrutura microscópica da matéria.
Quando se pergunta, mesmo depois de se ter explicado o conceito de temperatura
com base no equilíbrio térmico, se a madeira e o metal (constituintes de dois corpos que
permanecem numa sala durante um longo período de tempo) têm ou não a mesma
temperatura, a resposta parece ser quase uma fatalidade: “o metal está a uma
temperatura inferior à da madeira”.
A medição de temperatura pode ser feita com termómetros de contacto, que
funcionam com base no facto de que dois corpos em contacto adquirem, após um certo
período de tempo, a mesma temperatura, isto é, ficam em equilíbrio térmico11. Há vários
tipos de termómetros que se baseiam no facto de poderem seleccionar numa propriedade
dos materiais que varia com a temperatura de uma forma previsível e reprodutível,
chamada propriedade termométrica.
10
No entanto o conceito de temperatura pode ser aplicado a certas propriedades das partículas. Por
exemplo, há estudos da medição da temperatura de núcleos atómicos em função da sua energia
de excitação (Melby et al, 1999). Outro exemplo interessante, é atribuir uma temperatura aos
electrões livres num metal a 0 K, cujo valor máximo é designada por temperatura de Fermi, que
está associada à energia de Fermi, mas que não tem uma relação com a temperatura do metal
como um todo (Omar, 1993).
11
Os pirómetros não são termómetros de contacto. Medem a temperatura com base na radiação
emitida pelos corpos (ver secção 5.5).
48
3 Lei Zero da Termodinâmica e Temperatura
3.3 Radiação térmica
Os corpos emitem radiação electromagnética pelo facto de estarem a uma dada
temperatura. Esta radiação é designada por radiação térmica. Por outro lado, os corpos
também absorvem radiação electromagnética. Em equilíbrio termodinâmico há um
balanço perfeito entre a energia emitida e a energia absorvida. Contudo, se um corpo está
inicialmente a uma temperatura superior à da sua vizinhança, irá arrefecer, pois a sua
taxa de emissão de radiação é maior do que a sua taxa de absorção. Se o corpo estiver
inicialmente a uma temperatura inferior à da sua vizinhança irá aquecer. Quando o corpo
e o meio ficam à mesma temperatura, é atingido o equilíbrio térmico e as taxas de
emissão e absorção são iguais.
A Figura 3.13 mostra a evolução temporal da temperatura do ar contido dentro de
latas pintadas (branca e preta), quando, nas mesmas condições, se fez incidir radiação
emitida por uma lâmpada, sobre cada uma delas. A montagem experimental é mostrada
na Figura 3.14 e a actividade insere-se no currículo de 10º ano da disciplina de Física e
Química A, componente da Física.
Figura 3.13 Evolução temporal da temperatura do ar no interior de duas latas
de cores diferentes, quando incide nelas radiação nas mesmas
condições.
Analisando os resultados podemos concluir que o ar contido na lata recebe, através
desta, parte da energia emitida pela lâmpada, aumentando assim a sua temperatura. Essa
energia recebida depende da cor da superfície, já que estas têm a mesma área e a mesma
textura. Com o decorrer do tempo, o aumento de temperatura é cada vez menor, o que se
explica pelo facto de a lata também emitir radiação. A intensidade da energia emitida por
49
Temperatura e sua medição
unidade de tempo e de área da superfície emissora é tanto maior quanto maior for a
temperatura a que o corpo se encontra. Assim a diferença entre a energia que a lata
absorve e a que ele emite é cada vez menor, num mesmo intervalo de tempo, até que essa
diferença se anula, quando é atingido o equilíbrio térmico. Neste estado, a rapidez com
que a energia é absorvida é igual àquela com que é emitida.
Figura 3.14 Fotografia da montagem experimental para a comparação do
poder de absorção de radiação por diferentes superfícies.
A matéria na fase sólida ou líquida emite um espectro contínuo de radiação. O
perfil do espectro de radiação emitida depende fundamentalmente da sua temperatura,
sendo praticamente independente do material de que o corpo é composto. Para
temperaturas baixas a maioria dos corpos são visíveis, não pela radiação que emitem,
mas devido à luz que reflectem. Se não houver nenhuma luz a incidir sobre eles, não
podem ser vistos. Todavia, a temperaturas muito altas, os corpos têm luminosidade
própria. Podem ser vistos a brilhar num ambiente escuro, pois a radiação térmica por eles
emitida começa a ser significativa na região do espectro visível.
A radiação visível12, emitida por corpos mesmo a temperaturas de alguns milhares
de Kelvin, é menor que 10% da radiação total emitida, sendo esta fundamentalmente
radiação infravermelha. Podemos ilustrar este facto com uma actividade experimental
que consiste no aquecimento de água colocando uma lâmpada acesa no seu seio, cuja
montagem se mostra na Figura 3.15.
12
O olho humano é sensível ao espectro electromagnético na banda espectral de 400 nm a 700 nm.
50
3 Lei Zero da Termodinâmica e Temperatura
Figura 3.15 Fotografias da montagem experimental para estudo do
aquecimento da água com uma lâmpada.
A experiência foi repetida com a mesma lâmpada e nas mesmas condições de
alimentação, mas envolvida com folha de alumínio.
O gráfico da Figura 3.16 apresenta a evolução da temperatura da água em função
do tempo. O aquecimento é devido essencialmente à emissão na banda do infravermelho.
A diferença entre os declives corresponde à emissão no visível, que é pequena quando
comparada com a potência total emitida.
Figura 3.16 Gráfico comparativo do aquecimento da água com uma lâmpada
com e sem folha de alumínio.
O facto de existir uma relação entre temperatura e emissão de radiação não é em si
surpreendente. De acordo com a teoria corpuscular da matéria, a temperatura relaciona-se
com a agitação das partículas constituintes da matéria. Como estas têm carga eléctrica e
como uma carga em movimento acelerado emite radiação (Eisberg et al, 1979), o
51
Temperatura e sua medição
fenómeno da emissão da radiação térmica é qualitativamente explicado pelas leis do
Electromagnetismo13. Porém, como veremos, esta teoria revela-se insuficiente para
explicar o espectro de emissão observado experimentalmente.
Em rigor, o perfil do espectro da radiação térmica emitida por um corpo quente,
depende de algum modo da composição desse corpo, em particular das características da
sua superfície. No entanto, podemos imaginar o caso ideal de corpos que emitem
espectros térmicos com características universais, independentes do material de que são
constituídos. Um corpo com essas propriedades é designado por corpo negro, e a sua
superfície absorve toda a radiação térmica incidente. O nome é sugerido pelo facto de tal
corpo não reflectir a luz, sendo percepcionado como sendo negro. Na natureza não se
conhece nenhum corpo perfeitamente negro, apenas existindo boas aproximações que nos
permitem estudar as suas propriedades. Uma boa aproximação a um corpo negro obtém-se cobrindo um objecto com uma camada de fuligem. Verifica-se que todos os corpos
negros à mesma temperatura emitem radiação térmica com o mesmo espectro.
A distribuição espectral da radiação do corpo negro é descrita pela radiância
espectral, RT (n ) . A radiância espectral é definida como a energia emitida por um corpo,
à temperatura T , com frequência compreendida entre n e n + dn , por unidade de tempo
e por unidade de área. As primeiras medidas precisas desta grandeza foram feitas por
Lummer e Pringsheim em 1899 (Alonso et al, 1978).
Conforme se observa na Figura 3.17, RT (n ) depende da temperatura do corpo
emissor e da frequência da radiação. Além disso, vemos que a radiância espectral do
corpo negro tende para zero, tanto para frequências muito grandes como para frequências
muito pequenas, e exibe um máximo para uma certa frequência, cujo valor aumenta com
a temperatura.
A energia total emitida pelo corpo negro, ER , à temperatura T , por unidade de
tempo e de área, designa-se por radiância e é obtida integrando a função RT (n )
•
ER = Ú RT (n ) dn
(3.20)
0
13
As leis do Electromagnetismo são unificadas pelas equações de Maxwell (Alonso et al, 1977).
52
3 Lei Zero da Termodinâmica e Temperatura
Figura 3.17. Radiância espectral do corpo negro para quatro temperaturas
diferentes.
O valor de ER é proporcional à quarta potência da temperatura (Alonso et al, 1978).
Esta relação é chamada a lei de Stefan-Boltzmann, e foi enunciado pela primeira vez em
1879 sob a forma da seguinte equação empírica
ER = s T 4
(3.21)
onde s é a constante de Stefan-Boltzmann, cujo valor é 5, 670 ¥ 10 -8 Wm -2 K -4 . Da
análise da Figura 3.17 também se pode concluir que o valor máximo do espectro se
desloca para maiores frequências à medida que a temperatura aumenta. Este resultado é
chamado lei do deslocamento de Wien e estabelece que a frequência correspondente ao
máximo de RT é proporcional à temperatura:
n max μ T
(3.22)
Como ln = c , onde l é o comprimento de onda da radiação e c a velocidade de
propagação das ondas electromagnéticas no vazio, a lei de Wien pode ser escrita em
termos do comprimento de onda assumindo a forma
lmaxT = constante
(3.23)
53
Temperatura e sua medição
onde lmax é o comprimento de onda correspondente ao máximo da radiância espectral, a
uma dada temperatura T . O valor determinado experimentalmente para a constante de
Wien é de 2,898 ¥ 10-3 m K .
Uma excelente aproximação de um corpo negro, de grande importância no estudo
da teoria da radiação, pode ser obtida a partir de um objecto que contém uma cavidade
ligada ao exterior por um pequeno orifício, como se ilustra na Figura 3.18.
A radiação térmica que incide sobre o orifício, vinda do exterior, entra na cavidade e
é completamente absorvida por ela devido às sucessivas reflexões nas suas paredes
interiores. Se a área do orifício for muito pequena comparada com a área da superfície
interna da cavidade, apenas uma fracção desprezível da radiação incidente sobre o
orifício sai da cavidade e portanto o orifício deve ter propriedades da superfície de um
corpo negro.
T
Figura 3.18 Cavidade que com um orifício. A radiação que entra é totalmente
absorvida devido às sucessivas reflexões no interior da cavidade,
que se aproxima a um corpo negro.
Se as paredes da cavidade forem uniformemente aquecidas até atingirem uma dada
temperatura T , emitirão radiação térmica que vai encher a cavidade. Uma pequena
fracção dessa radiação, vinda do interior da cavidade incide sobre o orifício e vai
atravessá-lo. Portanto este actua como um emissor de radiação térmica. Como ele tem as
propriedades do corpo negro, a radiação emitida por ele deve ter um espectro de corpo
negro. Mas como o orifício está apenas a deixar passar para fora uma pequena amostra da
radiação do interior da cavidade, é natural que a radiação no seu interior também tenha o
espectro do corpo negro. De facto, ela terá um espectro de corpo negro característico da
54
3 Lei Zero da Termodinâmica e Temperatura
temperatura T das suas paredes. O espectro de radiação emitido pelo orifício da cavidade
pode ser especificado em termos da função radiância espectral, RT (n ) . No entanto, é
mais útil especificar o espectro da radiação dentro da cavidade, chamada radiação de
cavidade, em termos de uma densidade de energia, rT (n ) , que é definida como a energia
contida por unidade de volume da cavidade, à temperatura T , no intervalo de frequência
n e n + dn . É evidente que as duas quantidades são proporcionais entre si, isto é,
rT (n ) μ RT (n )
(3.24)
Portanto, a radiação dentro da cavidade cujas paredes estão a uma temperatura T
tem as mesmas propriedades que a radiação emitida pela superfície de um corpo negro à
mesma temperatura.
3.3.1
A teoria clássica da radiação do corpo negro
No início do século XX, Rayleigh e Jeans fizeram o cálculo da densidade de
energia da radiação de uma cavidade (ou de um corpo negro), o que mostrou uma séria
discordância com os resultados experimentais. De facto, esta divergência pôs em causa a
teoria da Física Clássica e foi o início do desenvolvimento da Física Quântica.
Rayleigh e Jeans consideraram uma cavidade com paredes metálicas em equilíbrio
térmico à temperatura T . Nestas condições, as paredes emitem radiação térmica que
enche a cavidade, sendo o seu espectro o de um corpo negro à temperatura T . No regime
estacionário a radiação electromagnética dentro da cavidade deverá existir na forma de
ondas estacionárias com nós nas superfícies metálicas.
Admitamos que a cavidade cheia de radiação electromagnética tem a forma de um
cubo14 de lado igual a a , conforme se ilustra na Figura 3.19. A radiação reflectida de um
lado para o outro entre as paredes pode ser dividida em três componentes ao longo das
três direcções perpendiculares definidas pelas arestas da cavidade, que podem ser
tratadas separadamente. Se se considerar a componente segundo x e a parede metálica
em x = 0 , toda a radiação que incide na parede é reflectida por esta e as ondas incidente
e reflectida combinam-se para formar uma onda estacionária.
14
A função densidade de energia dentro da cavidade deve ser independente da sua forma. A
escolha da forma cúbica deve-se a uma conveniência do ponto de vista matemático.
55
Temperatura e sua medição
z
z=a
y=a
y
0
x=a
x
Figura 3.19 Uma cavidade cúbica, com aresta de comprimento a, preenchida
por radiação electromagnética.
Mas como a radiação electromagnética é uma onda transversal com o vector campo
G
eléctrico E perpendicular à direcção de propagação, e como a direcção de propagação é
perpendicular à parede em questão, o seu vector campo eléctrico é paralelo à parede. Mas
uma parede metálica não pode suportar um campo eléctrico paralelo à sua superfície, já
que isso produzia uma corrente eléctrica no sentido de anular tal campo. A superfície de
um condutor em equilíbrio é uma superfície equipotencial e se existir campo eléctrico na
superfície terá que lhe ser perpendicular. Portanto, a conciliação do equilíbrio eléctrico
das paredes e a transversalidade da onda electromagnética exige que o vector campo
eléctrico seja nulo nas paredes. Assim, a onda estacionária associada à componente
segundo x deve ter um nó em x = 0 e outro em x = a . Analogamente, as componentes
segundo y e z , têm nós em y = 0 e y = a , e em z = 0 e z = a , respectivamente.
Estas condições colocam limitações nos comprimentos de onda possíveis da
radiação contida na cavidade. Se a radiação de comprimento de onda l e frequência
n = c l se propagara na direcção definida pelos ângulos a , b e g , tal como mostra a
Figura 3.20, e for uma onda estacionária, então as suas componentes segundo x , y e z
também são ondas estacionárias. Na Figura 3.20 estão indicadas algumas localizações
dos nós fixos desta onda estacionária onde se fez passar em cada um deles um plano
perpendicular à direcção de propagação. A distância entre eles é de l 2 , onde l é o
comprimento de onda.
56
3 Lei Zero da Termodinâmica e Temperatura
z
ly
lz
y
2
2
Direcção de
propagação
lz
2
l
2
g
a
b
lx
lx
2
2
x
Figura 3.20 Planos nodais de uma onde estacionária que se propaga numa
dada direcção na cavidade cúbica.
Os nós das componentes segundo x , y e z podem ser dados por:
Ïlx 2 = (l 2) cos (a )
Ô
Ô
Ìl y 2 = (l 2) cos ( b )
Ô
ÔÓlz 2 = ( l 2) cos (g )
(3.25)
As componentes do campo eléctrico da onda estacionária segundo os três eixos são
dadas pelas expressões
Ï E ( x, t ) = A sin (2p x lx ) sin (2p n t )
Ô
Ô
Ì E ( y, t ) = B sin 2p y l y sin (2p n t )
Ô
Ô E ( z , t ) = C sin (2p z l ) sin (2p n t )
z
Ó
(
)
(3.26)
A componente x é uma onda de amplitude variável, cujo valor máximo é A, com
variações espaciais dadas por sin (2p x lx ) e com frequência temporal n . Como
sin (2p x lx ) se anula para 2 x lx = 0, 1, 2, 3, ... , trata-se de uma onda estacionária cujo
comprimento de onda é lx , uma vez que tem nós separados por uma distância de
57
Temperatura e sua medição
Dx = lx 2 . As expressões correspondentes às componentes y e z representam ondas
estacionárias de amplitudes máximas B e C e comprimentos de onda l y e lz ,
respectivamente. É de notar que as equações (3.26) satisfazem as condições de que a
componente x tenha um nó em x = 0 , a componente y em y = 0 e a componente z em
z = 0 . No entanto, para que a componente x tenha um nó em x = a , a componente y
em y = a e a componente z em z = a , é necessário impor as seguintes condições
Ï 2 a l x = nx
Ô
Ô
Ì 2a l y = n y
Ô
ÔÓ2a lz = nz
(3.27)
onde nx = 0, 1, 2, 3, ... ; n y = 0, 1, 2, 3, ... ; nz = 0, 1, 2, 3, ...
Resolvendo o sistema de equações (3.25) em ordem a lx , l y e lz e substituindo
os seus valores na equação (3.27), obtemos
Ï( 2a l ) cos (a ) = nx
Ô
Ô
Ì( 2a l ) cos ( b ) = n y
Ô
ÔÓ( 2a l ) cos (g ) = nz
(3.28)
o que elevadas ao quadrado e somadas, resultam na seguinte equação
2
(
)
Ê 2a ˆ
2
2
2
2
2
2
ÁË ˜¯ cos a + cos b + cos g = nx + n y + nz
l
(3.29)
Mas os ângulos a , b e g satisfazem a relação cos 2 a + cos 2 b + cos 2 g = 1 , o que
permite escrever
2a
l
= nx2 + n y2 + nz2
(3.30)
onde nx , n y e nz podem tomar qualquer valor inteiro. Esta equação descreve a restrição
a impor aos comprimentos de onda para a radiação electromagnética contida na cavidade.
58
3 Lei Zero da Termodinâmica e Temperatura
Por conveniência continuamos a discussão em termos de frequências possíveis em
vez de comprimentos de onda.
n=
c
l
=
c
nx2 + n 2y + nz2
2a
(3.31)
Determinemos o número de frequências contidas num intervalo de n a n + dn .
Para isso definimos uma grelha de forma cúbica desenhada no primeiro octante de um
sistema de coordenadas rectangular, de tal modo que as três coordenadas de cada ponto
da grelha correspondam a um possível valor para os três inteiros nx , n y e nz . Por
construção, cada ponto da grelha corresponde a uma frequência, portanto o número de
frequências possíveis entre n e n + dn , N (n ) dn , é igual a N (r ) dr , que corresponde ao
número de pontos contidos entre volumes de forma esférica de raios r e r + dr ,
respectivamente, onde
r = nx2 + n y2 + nz2 ,
ou seja, usando a equação (3.31),
r=
2a
n
c
(3.32)
Então N (r ) dr é igual ao produto do volume entre as esferas pela densidade de
pontos da grelha, que por construção é de um ponto por unidade de volume, ou seja, um
ponto por frequência de onda estacionária.
O elemento de volume em coordenadas cartesianas é dada por dV = dx dy dz , onde
dx , dy e dz são os deslocamentos elementares segundo x , y e z . Em coordenadas
esféricas (r ,q , f ) o elemento de volume é dado por
dV = r 2 sin (f ) dr df dq
(3.33)
Para calcular o volume elementar entre as duas esferas é necessário integrar a
expressão anterior no primeiro octante:
59
Temperatura e sua medição
p p
2 2
N (r ) dr = Ú Ú r 2 sin (f ) d f dq dr
0 0
obtendo-se como resultado
N (r ) dr =
p
2
r 2 dr
(3.34)
Da equação (3.32) temos dr = (2a c ) dn , obtendo-se a expressão final de N (n )dn
3
Ê 2a ˆ
N (n ) dn = p Á ˜ n 2 dn
Ë c ¯
(3.35)
Com isto fica concluído o cálculo do número de ondas estacionárias contidas numa
cavidade cúbica de aresta a . O resultado da equação (3.35) vem multiplicado por dois já
que, considerando uma radiação segundo o eixo dos xx , por exemplo, o seu vector
campo eléctrico, tendo uma direcção perpendicular, pode tomar qualquer direcção entre
os eixos yy e zz (dois modos de polarização). A amplitude da radiação pode ser escrita
da seguinte forma:
A=
Ay2 + Az2
Se for considerado que o número de radiações é suficientemente elevado, pode-se
dizer que em média Ay = Az , o que faz que a amplitude média das radiações, A , possa
ser escrita por
A = 2 Ay
Sendo a energia de uma radiação dada pelo quadrado da sua amplitude, essa energia
será então de 2 Ay2 , o que significa que se pode multiplicar o número de ondas por um
factor de dois e calcular de seguida o valor da energia média de cada componente da
radiação.
60
3 Lei Zero da Termodinâmica e Temperatura
Sendo conhecido o número de ondas estacionárias contidas na cavidade, agora só é
necessário saber qual é a energia média de cada onda para que seja possível calcular a
densidade de energia, por unidade de volume, num certo intervalo de frequências.
Mas segundo a teoria cinética clássica, mais concretamente segundo a lei da
equipartição da energia, a energia cinética média de uma entidade em equilíbrio térmico
à temperatura T é de kT 2 por grau de liberdade, onde k = 1,38065 ¥ 10-23 J K -1 é a
constante de Boltzmann. Como cada uma das ondas estacionárias tem apenas um grau de
liberdade, a amplitude do seu campo eléctrico, a sua energia cinética média é de kT 2 .
Facilmente se chega à conclusão que para um sistema oscilante com apenas um grau de
liberdade, a energia total é o dobro da energia cinética média. A energia total de cada
onda estacionária é dada por
e = kT
(3.36)
Voltando à equação (3.35), que relaciona o número de frequências possíveis com o
volume da cavidade, e sabendo que em média a energia de uma radiação é dada pela lei
da equipartição da energia traduzida pela equação (3.36), a primeira ideia que surge é que
a densidade de energia por unidade de volume de uma cavidade à temperatura T será
( )
dada pela multiplicação das duas expressões, a dividir pelo volume da cavidade a 3 , ou
seja,
8p n 2 k T
dn
rT (n ) dn =
c3
(3.37)
Esta ideia surgiu pela primeira vez a Rayleigh e Jeans, e embora aparentemente
baseada em teorias sólidas, não coincide com os resultados experimentais. A Figura 3.21
faz a comparação entre as previsões da equação (3.37) e a experiência. Como se pode
observar da figura, a discrepância é enorme. A baixas frequências as duas curvas são
aproximadamente iguais, no entanto, à medida que a frequência cresce, a previsão teórica
aponta que a energia tende para infinito, enquanto que na prática todas as experiências
conduzem ao resultado de que essa energia tende para zero. A previsão da Física clássica
é conhecida por catástrofe do ultravioleta.
61
Temperatura e sua medição
Figura 3.21 Comparação entre a previsão da Física clássica e os resultados
experimentais para a densidade de energia numa cavidade.
3.3.2
A distribuição de Boltzmann
A lei da equipartição da energia surge também no resultado de um cálculo bastante
credível da Mecânica Estatística designado por distribuição de Boltzmann e que é
considerado seguidamente.
Considere-se um sistema que contem um número elevado de entidades físicas do
mesmo tipo em equilíbrio térmico à temperatura T. Para estarem em equilíbrio
necessitam de trocar energia entre si. Nas trocas efectuadas, a energia de cada entidade
flutua em torno de um valor médio. Em cada instante algumas partículas têm mais
energia do que o valor médio e outras menos. Segundo a teoria clássica da mecânica
estatística essas energias, e , tomam valores de acordo com uma função de distribuição
de probabilidade, cuja forma depende da temperatura. O valor médio da energia, e , de
cada partícula é determinado pela distribuição de probabilidade e deverá ter um valor
definido para uma temperatura particular (Eisberg et al, 1979).
Consideremos um sistema de partículas do mesmo tipo às quais se pode associar
uma dada energia. Se o sistema for isolado do ambiente que o rodeia, a sua energia total
permanece constante, podendo apenas ocorrer trocas de energia entre as partículas. Para
simplificar os cálculos, admitamos que a energia de cada partícula toma valores discretos
e múltiplos de De , ou seja, e = 0 , De , 2 De , 3De , 4 De , … . Nos resultados obtidos,
fazendo tender De para zero obteremos os resultados correspondentes à possibilidade de
uma partícula poder ter um valor contínuo para a sua energia. Também para simplificar,
admitimos que o sistema é constituído por um número pequeno de partículas (quatro, por
62
3 Lei Zero da Termodinâmica e Temperatura
exemplo) e que a sua energia total é 3De . Tem-se em mente a generalização posterior
para sistemas com grande número de partículas e para qualquer valor de energia total.
e = 0 e = De e = 2 De e = 3De e = 4 De
i =1
3
i=2
2
1
i=3
1
3
n ¢ (e )
40 20
24 20
Tabela 3.2
1
1
12 20
4 20
Nº de
possibilidades
Pi
4
4 20
12
12 20
4
4 20
0 20
Cálculo da distribuição de Boltzmann.
Uma vez que as quatro partículas podem trocar energia entre si, todas as divisões
possíveis da energia 3De entre as quatro entidades podem ocorrer. Na Tabela 3.2
mostra-se todas as possibilidades de distribuição da energia total pelas quatro partículas,
identificadas pela letra i . Para i = 1 , três partículas têm energia nula, tendo a quarta
energia igual a 3De , tendo o sistema a energia e = 3De . Nesta situação podem existir
quatro possibilidades diferentes, uma vez que qualquer uma das quatro entidades pode
ser a que tem energia de 3De .
No caso de i = 2 , duas partículas têm energia nula, a terceira e a quarta têm,
respectivamente, energias e = De e e = 2 De . Nesta situação podem existir doze
possibilidades distintas de distribuição da energia (qualquer uma das quatro partículas
pode ter energia e = 2 De e qualquer uma das restantes três pode ter energia e = De , ou
seja, 4 ¥ 3 = 12 possibilidades).
Para i = 3 , existem quatro modos distintos de fazer uma partícula com energia
e = 0 e as restantes três partículas com energia e = De .
A última hipótese a considerar é a de que todas as possibilidades de dividir a
energia pelas partículas ocorrem com igual probabilidade. Então a probabilidade de
ocorrerem as divisões de determinado tipo ( i = 1 , 2 ou 3) é proporcional ao número de
divisões distintas desse mesmo tipo. A probabilidade relativa, Pi , é então igual ao
número de divisões de determinado tipo a dividir pelo número total de divisões. As
probabilidades relativas estão calculadas na coluna da direita da Tabela 3.2.
O parâmetro que falta calcular é o número provável de entidades num dado estado
de energia e , n ¢ (e ) . Para o nível de energia e = 0 existem três entidades em divisões do
63
Temperatura e sua medição
tipo i = 1 , com uma probabilidade de ocorrência de 4/20, duas entidades do tipo i = 2
com probabilidade de 12 20 e uma entidade do tipo i = 3 com probabilidade de 4 20 , o
que faz com que n ¢ (e ) seja igual a 3 ¥ 4 20 + 2 ¥ 12 20 + 1 ¥ 4 20 = 40 20 . Os restantes
valores de n ¢ (e ) estão calculados na última linha da Tabela 3.2. É de notar que a soma
dos n ¢ (e ) é quatro, já que existem quatro partículas no sistema. Na Figura 3.22 estão
marcados os valores de n ¢ (e ) . A curva a cheio da mesma figura é a representação da
função exponencial negativa
n (e ) = Ae - e
e0
(3.38)
onde A e e 0 são constantes que foram calculadas de modo que a curva se ajuste o melhor
possível aos pontos calculados correspondentes a n ¢ (e ) .
Figura 3.22 Comparação entre os resultados de um cálculo simples e a
distribuição de Boltzmann.
Diminuindo o intervalo De , aumentando assim o número de estados possíveis, a
função n ¢ (e ) fica definida para valores de e cada vez mais próximos e no limite quando
De Æ 0 , a energia e de uma partícula fica uma variável contínua, como é suposto na
Física clássica e a distribuição n ¢ (e ) torna-se uma função contínua. Se, finalmente, o
64
3 Lei Zero da Termodinâmica e Temperatura
número de partículas do sistema for muito grande, chega-se à conclusão de que a função
que se encontraria para n ¢ (e ) é idêntica à exponencial negativa da equação (3.38).
No exemplo apresentado anteriormente, outro método para se calcular a energia
total do sistema seria multiplicar cada nível de energia pelo número provável de
entidades com essa energia. No final, a energia total do sistema, e s , é dada pela soma de
todas as multiplicações, ou seja, pode ser calculada pela expressão
es =
N De
 e n ¢ (e )
0
= 0 ¥ 40 20 + De ¥ 24 20 + 2De ¥ 12 20 + 3De ¥ 4 20 = (60 20) De = 3De
A energia média de cada partícula também pode ser obtida dividindo o resultado
anterior pelo número total de entidades, que no exemplo apresentado são quatro. Portanto
a energia média de cada entidade será dada por
N De
e =
 e n¢ (e )
0
N De
(3.39)
 n¢ (e )
0
que neste caso dá (3 4) De . Com a generalização para De Æ 0 e um número de
partículas muito elevado, o valor da energia média de cada partícula será dado por
•
e =
Ú e n (e ) d e
0
•
(3.40)
Ú n (e ) d e
0
Substituindo n (e ) pelo valor da equação (3.38),
•
e =
Ú Ae e
0
•
Ú Ae
-e e0
d
-e e0
e
(3.41)
de
0
65
Temperatura e sua medição
Se se resolverem os integrais, chega-se à conclusão de que e = e 0 , ou seja, a
constante e 0 da exponencial negativa da equação (3.38) é igual à energia média de cada
entidade e não é necessário saber do valor de A.
Mas segundo a lei da equipartição da energia, o valor médio de energia de uma
partícula é proporcional à sua temperatura. Então como o parâmetro e 0 tem o mesmo
valor que e , a equação (3.38) pode ser escrita da seguinte forma:
n (e ) = Ae - e
kT
(3.42)
A equação anterior é a famosa distribuição de Boltzmann. Como o valor de A não
é especificado, na realidade apenas sabemos que, à temperatura T , o número de
entidades com um determinado nível de energia, n (e ) , é proporcional a e - e
kT
.
Em termos de cálculo probabilístico, facilmente se chega à conclusão de que o
número provável de partículas com um determinado nível de energia é proporcional à
probabilidade de ser encontrada uma determinada partícula com esse mesmo nível de
energia, ou seja, P (e ) μ n (e ) e se n (e ) = Ae - e
kT
, então P (e ) = B e - e
kT
, desde que a
constante B seja escolhida apropriadamente. Para que B seja calculado basta resolver a
equação em que a soma de todas as probabilidades de algo acontecer é igual a 1, ou seja,
•
•
Ú P (e ) d e = 1 ¤ B Ú e
0
- e kT
0
=1¤ B =
1
kT
(3.43)
e daqui se pode concluir que
e - e kT
P (e ) =
kT
3.3.3
(3.44)
A teoria de Planck da radiação do corpo negro
Para solucionar a discrepância entre a teoria e a experiência, Planck considerou a
hipótese de que a lei da equipartição da energia não estava correcta. Como a distribuição
de Boltzmann (que usa a dita lei) parece baseada em pressupostos bastante credíveis,
Planck partiu da equação (3.44) para estudar a discrepância entre a teoria e a prática.
66
3 Lei Zero da Termodinâmica e Temperatura
A energia média de uma radiação pode ser dada por
•
e =
Ú e P (e ) d e
0
•
(3.45)
Ú P (e ) d e
0
Como o integral do denominador representa a probabilidade da energia ter qualquer
valor de zero a infinito, o seu resultado vai ser igual a um.
Se se resolver o integral do numerador, obtemos e = kT .
Observando o gráfico da Figura 3.21, chega-se à conclusão de que a lei clássica dá
resultados satisfatórios para baixas frequências: lim e = k T , isto é, a energia média de
n Æ0
uma radiação tende para kT quando a frequência tende para zero. Também se pode
observar a partir dos resultados experimentais que lim e = 0 .
n Æ•
Ao tentar encontrar uma solução para o problema, Planck supôs que a energia e
poderia ter apenas certos valores discretos, em vez de qualquer valor, e que esses valores
discretos eram múltiplos de um valor mínimo: e = 0 , De , 2 De , 3 De , 4 De , … ,ou seja
e = n De , n Π` .
Planck chegou à conclusão de que para a energia média dum sistema tender para
zero quando a frequência tende para infinito bastava fazer De proporcional à frequência,
ou seja, De = hn e e = n hn , n Œ ` , onde h = 6, 626 ¥ 10 -34 J s é hoje conhecida como a
constante de Planck.
A equação (3.45) dará lugar a uma forma discreta em que os integrais darão lugar a
somatórios
•
e =
 e P (e )
n =0
•
 P (e )
n=0
•
=
 n hn
n=0
•
Â
n=0
e - nhn kT
kT
(3.46)
e - nhn kT
kT
67
Temperatura e sua medição
Depois de resolvidos os somatórios, é obtida uma expressão para a energia média
que é a seguinte (Alonso et al, 1978)
e (n ) =
hn
e
hn kT
(3.47)
-1
e a fórmula que se obtém para a densidade de energia da cavidade com o espectro de
corpo negro é:
rT (n ) dn =
8p h n 3
dn
c3 e hn kT - 1
(3.48)
Esta fórmula, conhecida como lei de Planck está em excelente acordo com as
experiências feitas até ao momento.
Em grande parte da literatura a lei de Planck aparece como função do comprimento
de onda e não como função da frequência. Para se obter tal expressão basta saber que:
n=
c
l
dn = -
e
c
l2
dl
Então, temos
rT (l ) d l =
8p hc
l
5
dl
e
hc l kT
(3.49)
-1
A lei de Stefan-Boltzmann, dada pela equação (3.21), traduz a radiação total
emitida por um corpo à temperatura T e é obtida a partir da lei de Planck integrando a
densidade de radiação para todas as frequências. Obtêm-se que a densidade de radiação é
proporcional à quarta potência da temperatura (Alonso et al, 1978). Do mesmo modo, a
lei do deslocamento de Wien, dada pela equação (3.22), é obtida igualando a primeira
derivada de rT (n ) a zero. Obtêm-se assim que o máximo da curva é proporcional à
temperatura.
O conceito de corpo negro é uma idealização útil, mas os corpos reais afastam-se
do comportamento do corpo negro em maior ou menor grau. O comportamento real é
descrito introduzindo um coeficiente, designado por emissividade e denotado por e ,
obtendo-se a lei de Stefan-Boltzmann para corpos reais, onde e < 1 ,
ER = e s T 4
(3.50)
68
3 Lei Zero da Termodinâmica e Temperatura
Na Tabela 3.3 são apresentados os valores de emissividade para vários materiais,
no estado sólido e líquido, para um comprimento de onda de 0, 65μm .
Tabela 3.3
Emissividade de alguns materiais a l = 0, 65μm .
69
4 Metrologia da temperatura
4.1 Introdução
Através dos sentidos o homem trava conhecimento com o mundo físico que o
rodeia. A primeira noção de temperatura de um sistema é estabelecida a partir da
sensação térmica que o tacto proporciona, sendo traduzida pelos termos frio, quente,
gelado, morno, etc.
No entanto, a nossa percepção de quente e frio é, por vezes, enganadora. Por
exemplo, sente-se a sensação de frio quando se mergulha uma mão em água morna
depois de a ter mergulhado durante algum tempo em água quente e sente-se a sensação
de quente quando se mergulha a mão na mesma água morna depois de a ter mergulhado
durante algum tempo em água fria.
Portanto o carácter “sensitivo” não pode, para fins científicos, ser utilizado como
um termómetro pois é um instrumento diferencial, pois só consegue distinguir entre
“mais frio” e “mais quente” em relação à sua própria temperatura. Além disso tem um
carácter relativo que depende da pessoa, da condição fisiológica em que se encontrava
anteriormente e da natureza dos objectos tocados. Por exemplo, uma maçaneta metálica
“parece mais fria” ao tacto do que a porta onde está colocada, apesar de estarem ambas à
mesma temperatura. A explicação tem a ver com os valores das suas condutividades e
capacidades térmicas.
Surge, portanto, a necessidade de se estabelecer um instrumento normalizado de
medição de temperatura que seja independente do operador – o termómetro. A
metrologia da temperatura antecede a compreensão do conceito científico de temperatura.
De entre todas as grandezas físicas, a temperatura é provavelmente aquela que é
medida com mais frequência, pois é relevante em muitas áreas científicas e tecnológicas.
Citam-se como exemplo de actividades onde é essencial a medição de temperatura, as
indústrias químicas, siderúrgicas, de plástico e de papel, alimentar, farmacêutica,
automóvel, aviação, entre outras. Também na meteorologia, na medicina e investigação
científica em geral.
71
Temperatura e sua medição
Os termómetros baseiam-se na dependência com a temperatura de propriedades das
substâncias tais como volume, pressão, resistência eléctrica, variação de cor, etc.
Há vários tipos de termómetros, que diferem na exactidão, no método, na gama de
medição, etc. O tipo de termómetro a ser utilizado para a determinação da temperatura de
um sistema depende da aplicação particular pretendida.
4.2 Breve história da medição de temperatura
Esta secção baseou-se em algumas fontes, nomeadamente (Pires et al, 2006),
http://home.comcast.net/~igpl/Temperature.html, tendo alguma sobreposição com o texto
de Paulo Cabral “Breve História da Medição de Temperaturas”.
Primórdios (séculos XVI – XVIII)
Os registos históricos existentes situam a primeira tentativa
de estabelecer uma “escala de temperaturas” por volta de 170 d.c.
O médico grego Claudius Galenus de Pergamum (129 – 201) terá
sugerido que as sensações de quente e de frio fossem medidas
com base numa escala com quatro divisões numeradas acima e
abaixo de um ponto neutro. A essa escala termométrica atribuiu a
temperatura de “4 graus de calor” à água a ferver, a temperatura
Claudius Galenus
de “4 graus de frio” ao gelo e a temperatura de “neutra” à mistura de iguais quantidades
daquelas duas substâncias.
Não obstante a termometria anteceder a épocas tão remotas,
a invenção do primeiro termómetro é atribuída ao Físico italiano
Galileu Galilei (1564 – 1642). O equipamento consistia de um
recipiente aberto contendo água colorida e sobre a qual se inseria a
extremidade de um tubo fino de vidro suspenso, tendo na
extremidade superior uma esfera oca.
Pensa-se que Galileu tenha usado vinho ao invés de água.
Galileu Galilei
Antes da imersão do tubo, de alguma forma, foi expelida uma
parte do ar contida no seu interior, criando naquela câmara uma pressão menor do que a
atmosférica, fazendo com que o líquido subisse dentro do tubo. Um aumento de
temperatura do ar no interior da esfera provocava uma expansão do ar e,
consequentemente uma movimentação no nível do líquido para baixo e, por outro lado,
uma queda de temperatura resultava no movimento do nível do líquido para cima. As
flutuações da temperatura da esfera podiam assim ser observadas, anotando a posição do
72
4 Metrologia da temperatura
líquido dentro do tubo. Este primeiro instrumento foi designado por termoscópio
(instrumento que indica variações temperatura por mudança de volume).
Figura 4.1
Termómetro de
Galileu Galilei.
Em 1611, Bartolomeu Telioux, de Roma, desenhou um termoscópio dotado de uma
escala. Mas o verdadeiro “termómetro” foi inventado pelo médico Sanctorius Sanctorius,
que, cerca de 1612, desenvolveu um termómetro de ar equipado
com uma escala para leitura da temperatura.
Na segunda metade do século XVII o termómetro a ar era
já muito conhecido, embora a sua eficácia não fosse muito boa.
Em 1644, Evangelista Torricelli descobriu a variabilidade da
pressão do ar e, cerca de 1660, comprovou-se que o termómetro
a ar reagia não só à variação de temperatura mas também à
variação de pressão. A solução para esse problema (e também o
Torricelli
passo seguinte na medição de temperatura) fora dado em
1651 por Ferdinando II (1610 – 1670), Gran Duque da
Toscânia, que desenvolveu o primeiro termómetro que usava
líquido em vez de ar como meio termométrico. Selou um
tubo contendo álcool e tendo gravada uma escala arbitrária,
dividida em 50 graus. Não era referido nenhum ponto fixo
como sendo o zero da escala. Nascia assim o termómetro
Ferdinando II
Florentino.
73
Temperatura e sua medição
Em 1664, Robert Hook (1635 – 1703), da London Royal
Society, usou tinta vermelha no álcool. A sua escala, em que os
graus representavam um incremento no volume equivalente a
cerca de 1/500 do volume total do líquido no termómetro,
necessitava apenas de um ponto fixo. O ponto fixo que ele
escolheu foi o ponto de solidificação da água. Hook reparou que
a mesma escala poderia ser usada por termómetros de vários
Robert Hooke
tamanhos.
Em 1702, o astrónomo Olef Roemer (1644 – 1710), oriundo de
Copenhaga, utilizou dois pontos fixos na sua escala (o ponto de
solidificação e o ponto de ebulição da água), dando início à criação
de escalas termométricas que se assemelham às que se conhecem
hoje em dia e à construção de termómetros muito próximos dos
Olef Roemer
modelos actuais.
Século XVIII: a profusão das escalas termométricas
O uso sistemático de termómetros teve um início bastante difícil. Face a problemas
culturais, de comunicação, guerras, diferentes interpretações do fenómeno da temperatura
e diferentes maneiras de construir o instrumento, uma enorme quantidade de escalas
termométricas foram propostas ao longo do século XVIII, situação que dificultava
enormemente a comparação de resultados obtidos em diversos países. Há referência a 27
escalas em uso na Europa em 1778 (Pires et al, 2006). Três delas difundiram-se no meio
científico, sendo bastante usadas ao longo dos séculos XIX e XX.
A escala Réaumur (ºR), do francês René-Antoine F. de
Réaumur (1683 – 1757), apresentada em 1730, era baseada na
expansão térmica do álcool (etanol). Os pontos fixos eram o ponto
de congelamento da água (0 ºR), e o ponto de ebulição desta
(80 ºR). Como o álcool tem ponto de ebulição baixo (78,3 ºC),
tornava-se difícil medir altas temperaturas. Para resolver o
problema, os cientistas misturavam água ao álcool, mas tinha o
inconveniente de a dilatação não ser uniforme.
74
Réne Réamur
4 Metrologia da temperatura
Cerca de 1714, Daniel Gabriel Fahrenheit (1686 – 1736), um
fabricante holandês de instrumentos de precisão, fabricou um
termómetro de líquido em vidro, com mercúrio (em vez de álcool),
cuja repetibilidade era a principal qualidade. De considerar ainda
que o mercúrio não adere ao vidro, permanece líquido entre uma
vasta gama de temperaturas e a sua aparência prateada torna fácil a
Daniel Fahrenheit
leitura. Fahrenheit obteve o primeiro ponto da sua escala a partir de
uma mistura de água, gelo e sal (era a temperatura mais baixa que ele conseguia
produzir) e atribuiu-lhe o valor 0 ºF. O segundo ponto era obtido apenas com água e gelo
(30 ºF). E o terceiro ponto da escala era obtido colocando o reservatório do termómetro
na boca de um ser humano desejando-lhe medir a temperatura interna (96 ºF). Na sua
escala, Fahrenheit atribuiu o ponto de ebulição da água a 212 ºF. Mais tarde alterava o
ponto de solidificação da água para 32 ºF, de forma que o intervalo entre o ponto de
solidificação e o de ebulição da água fosse de 180 graus. A unidade atribuída a essa
escala é o grau Fahrenheit.
As pesquisas de Fahrenheit com termómetros confirmaram que cada líquido
possuía um ponto de ebulição fixo e que este variava com a pressão. A escala de
Fahrenheit ganhou popularidade, principalmente devido à reprodutibilidade e à qualidade
de construção dos termómetros por ele produzidos.
Cerca de 1742, Anders Celsius (1701 – 1744) propôs que o
ponto de fusão do gelo e o ponto de ebulição da água fossem
adoptados para definir uma escala de temperaturas. Curiosamente,
atribuiu zero graus ao ponto de ebulição da água e 100 graus ao
ponto de solidificação. Mais tarde Carolus Linnaeus (1707 – 1778)
de Upsula, Suécia, definiu a sua escala utilizando, também, o ponto
Anders Celsius
de fusão do gelo e o ponto de ebulição da água, sendo 0 e 100 graus,
respectivamente (oposta da de Celsius).
Em 1780, J. A. C. Charles, físico francês, verificou que para o
mesmo aumento de temperatura, todos os gases têm o mesmo
Carl Linnaeus
aumento de volume. Devido ao coeficiente de expansão dos gases
serem muito próximos, é possível estabelecer uma escala de temperatura baseada num
ponto fixo único ao invés de usar uma escala de dois pontos fixos. Isto traz de volta os
termómetros que usam um gás como meio termométrico.
Em 1794, definiu-se que o grau termométrico seria a centésima parte da distância
entre as marcas correspondentes ao ponto de fusão do gelo e ao ponto de ebulição da
75
Temperatura e sua medição
água. Surgia assim a escala centígrada, a outra denominação da escala Celsius (até 1948,
quando a IX Conferência Internacional de Pesos e Medidas mudou o nome para grau
Celsius, ºC).
Século XIX: A consolidação da termometria e o zero absoluto
A partir do momento em que a temperatura passou a ser determinada com precisão
satisfatória, várias grandezas ganharam um importante significado prático no
desenvolvimento da Física e da Química a partir do final do século XVIII. Conceitos
como capacidade térmica mássica, calores latentes de fusão e de vaporização,
condutividade térmica, etc., foram estabelecidos e ganharam metodologias práticas de
medição, inviáveis se a termometria não tivesse atingido o grau de desenvolvimento
verificado a partir da época de Fahrenheit (Pires et al, 2006). As experiências em que o
termómetro desempenhava papel primordial eram bastante numerosas.
Em 1821 Sir Humphrey Davy (1778 – 1829) descobriu que a resistividade dos
metais apresentava uma forte dependência da temperatura.
Em 1826 T. J. Seebeck (1770 – 1831) descobriu que a força
electromotriz gerada, quando dois fios de metais diferentes são
unidos em duas extremidades e um dos extremos é aquecido, pode
ser relacionada quantitativamente com a temperatura e o sistema
pode ser usado como termómetro – designado por termopar. Hoje
em dia o termopar é um importante sensor de temperatura para
Thomas Seebeck
aplicações industriais. Merece referência o termopar de platina com
10% de ródio/platina desenvolvido em 1886 por Le Chatelier que foi durante largos anos
usado em laboratórios primários como instrumento de interpolação de escalas
internacionais de temperatura, acima dos 630 ºC.
No início do século XIX, William Thomson (Lord Kelvin)
(1824 – 1907) desenvolveu uma escala termodinâmica universal
baseada no coeficiente de expansão de um gás ideal. Kelvin
verificou que a pressão de um gás diminuía de 1/273 do valor
inicial quando arrefecido a volume constante de 0 a -1ºC .
Concluiu que a pressão seria nula quando o gás estivesse a
-273ºC e como consequência a temperatura também o seria, visto
Lord Kelvin
não haver agitação das moléculas (à luz da Física Clássica). A escala criada por Kelvin
tem origem (zero) no zero absoluto e adopta como unidade o kelvin (K). A sua escala
veio a tornar-se a base da moderna termometria.
76
4 Metrologia da temperatura
Em 1859, William John Macquorn Rankine (1820 – 1872)
propôs outra escala de temperatura na qual especificava 0 para o
zero absoluto, mas usava como base a escala graus Fahrenheit.
Devido à escala de Rankine ter o mesmo tamanho da escala de
Fahrenheit, o ponto de congelamento da água (32 ºF) e o ponto
de ebulição da água (212 ºF) correspondem respectivamente a
William Rankine
491,67 °Ra e 671,67 °Ra. Esta escala foi mais tarde renomeada
Rankine e sua unidade designada graus Rankine (símbolo °Ra).
Em 1871 Sir William Siemens (1823 – 1883), propôs o uso
de termómetros de resistência de platina, com a qual a medição da
temperatura seria feita à custa da variação da resistência eléctrica
de um fio de platina com a temperatura. A escolha da platina
deveu-se ao facto de não oxidar a altas temperaturas e de ter uma
relação entre a resistência e a temperatura bastante uniforme
William Siemens
numa vasta gama de temperaturas. Os termómetros de resistência
de platina são termómetros que apresentam excelentes características metrológicas.
Século XX: Revisões e redefinições
1. Termómetro de gás a volume constante
Baseado nos resultados dos estudos feitos por P. Chappuis, em 1887, dos
termómetros de gás com pressão constante ou com volume constante, usando hidrogénio,
azoto e dióxido de carbono como meio termométrico, o Comité Internacional de Pesos e
Medidas (CGPM) adoptou o termómetro de hidrogénio de volume constante (sendo a
propriedade termométrica a pressão) e uma escala baseada nos pontos de solidificação da
água (a 0 ºC) e de ebulição (a 100 ºC) como escala prática para a meteorologia.
As experiências com termómetros de gás mostraram que a diferença nas escalas
para diferentes gases é muito pequena. As experiências também mostraram que é
possível definir uma escala que é independente do gás, se este estiver a baixa pressão.
Neste caso, todos os gases se comportam como um gás ideal e tem uma relação muito
simples entre a sua pressão, P , o seu volume, V , e a sua temperatura, T ,
PV = (constante) T
(4.1)
77
Temperatura e sua medição
Esta é chamada de “temperatura termodinâmica” e é considerada como a medida
fundamental de temperatura. Com um ponto fixo na escala, necessitava-se de outro para
que toda a escala estivesse definida. Em 1933 o Comité Internacional de Pesos e Medidas
adoptou o ponto triplo da água como ponto fixo desta escala, o seu valor é 273,16 K,
sendo o kelvin (K) a unidade de temperatura desta escala.
2. Escala Prática Internacional de Temperatura
Constatou-se a necessidade da existência de uma escala de temperaturas universal,
definida de tal modo que fosse precisa, reprodutível, simples de utilizar e que fornecesse
valores de temperatura tão próximos quanto possível da temperatura termodinâmica.
Foi em 1927 que o CGPM adoptou a primeira Escala Internacional de Temperatura
(ITS-27). Essa escala estendia-se desde os -190 ºC até acima dos 1063 ºC . Esta escala
foi revista em 1948, passando a ser designada por ITS-48, novamente alterada em 1960,
adoptando nesse ano a designação de IPTS-48; uma revisão mais profunda ocorreu em
1968, sendo adoptada a Escala Internacional Prática de Temperaturas (IPTS-68).
Pouco tempo após a sua adopção, constataram-se muitas limitações e deficiências,
sendo-lhe introduzidas não só algumas correcções, em 1975, como também lhe foi
acrescentada a Escala Provisória de Temperatura de 0,5 K a 30 K (EPT-76), em 1976.
Em 1987, a 18ª CGPM decidiu que fosse desenvolvida uma nova escala de
temperaturas, que viria a entrar oficialmente em vigor em 1 de Janeiro de 1990 sob a
designação de Escala Internacional de Temperatura de 1990 (ITS-90). Esta escala foi
definida com base em fenómenos determinísticos de temperatura, e redefiniu alguns
pontos fixos de temperatura. A Tabela 4.1 mostra algumas alterações introduzidas na
escala ITS-90 relativamente à IPTS-68.
Pontos fixos
Ebulição do oxigénio
IPTS-68
ITS-90
– 182,962 ºC
– 182,954 ºC
+ 0,010 ºC
+ 0,010 ºC
Solidificação do estanho
+ 231,968 ºC
+ 231,928 ºC
Solidificação do zinco
+ 419,580 ºC
+419,527 ºC
Solidificação da prata
+ 961,930 ºC
+ 961,780 ºC
Solidificação do ouro
+ 1064,430 ºC
+ 1064,180 ºC
Ponto triplo da água
Tabela 4.1
Pontos fixos estabelecidos na ITS-90, comparados com os seus
valores na IPTS-68.
78
4 Metrologia da temperatura
4.3 Termometria e escalas termométricas
4.3.1
Escalas de temperaturas e princípios gerais
Para estabelecer uma escala empírica de temperatura, seleccionamos um sistema
caracterizado pelas coordenadas X e Y como padrão, ao qual chamamos termómetro, e
adoptamos um conjunto de regras para atribuir um valor numérico à temperatura
associada a cada uma das suas isotérmicas. A cada sistema em equilíbrio térmico com o
termómetro, atribuímos o mesmo valor para a temperatura. O procedimento mais simples
é escolher qualquer caminho conveniente no plano X -Y , tal como é mostrado na Figura
4.2 pela linha a tracejado Y = Y1 , a qual intersecta as isotérmicas em pontos com a mesma
coordenada Y, mas a diferentes coordenadas X. A temperatura associada a cada
isotérmica é tomada como o valor, neste ponto de intersecção, de uma função
de X adequada.
Y
Isotérmica correspondente
ao ponto triplo da água
Y = Y1
Figura 4.2
Estabelecimento de uma
escala de temperatura
(Anacleto, 2004).
X PT
X
A coordenada X é chamada a propriedade termométrica, e a forma da função
termométrica q ( X ) determina a escala empírica de temperatura. Há muitos tipos de
termómetros diferentes, cada um com a sua propriedade termométrica específica.
Consideremos X uma propriedade termométrica e tomemos arbitrariamente uma
escala de temperatura empírica q directamente proporcional a X. Assim, a temperatura
comum ao termómetro e a todos os sistemas em equilíbrio térmico com ele pode ser dada
pela função termométrica
79
Temperatura e sua medição
q (X ) = a X
(Y constante) ,
(4.2)
onde a é uma constante arbitrária. De notar que à medida que X se aproxima de zero, a
temperatura também tende para zero, porque não há nenhuma constante somada à
função. Deve ser notado, ainda, que quando esta relação arbitrária é aplicada a diferentes
tipos de termómetros se obtém escalas empíricas de temperatura diferentes. A equação
(4.2) aplica-se, em geral, a um termómetro posto em contacto com um sistema cuja
temperatura q ( X ) queremos medir. Portanto, aplica-se quando o termómetro é colocado
em contacto com um dado sistema padrão num estado reproduzível. Este estado do
sistema padrão, escolhido arbitrariamente, é designado por ponto fixo, isto é, tem uma
temperatura fixa. Os pontos fixos permitem temperaturas de referência para a construção
de escalas de temperatura.
Antes de 1954, a escala de temperatura internacional era a escala Celsius, a qual
era baseada no intervalo de temperatura entre dois pontos fixos: (1) a temperatura à qual
o gelo puro coexiste em equilíbrio, à pressão atmosférica normal15, com o ar saturado de
vapor de água (o ponto do gelo) – ao qual era atribuída a temperatura q PG = 0 ∞C ; e (2) a
temperatura de equilíbrio, à pressão atmosférica normal, entre a água pura e vapor puro
(o ponto de vapor) – ao qual era atribuída a temperatura q PV = 100 ∞C . Por esta razão esta
escala era também designada por escala centígrada de temperatura.
Em 1954, foi escolhido um outro ponto fixo de referência, como base de uma nova
escala de temperatura, baseada nas propriedades dos gases. Esse ponto corresponde à
temperatura do estado onde gelo, água líquida, e vapor de água coexistem em equilíbrio,
e é designado por ponto triplo (PT) da água.
Quando um gás é mantido a volume constante, a sua temperatura varia linearmente
com a pressão, se esta for suficientemente baixa. É esta propriedade que torna os gases
importantes em termometria. Utilizando gases diferentes, todos a uma pressão muito
baixa, obtém-se experimentalmente o gráfico da temperatura em função da pressão, para
cada gás, conforme se ilustra na Figura 4.3.
As rectas de ajuste dos valores experimentais intersectam-se no mesmo ponto do
eixo das temperaturas, obtendo-se a menor temperatura teórica possível, q = -273,15 ∞C .
Considera-se então uma escala de temperatura (escala Kelvin) com a mesma amplitude
15
A pressão atmosférica normal tem o valor exacto de 1, 01325 ¥ 105 Pa .
80
4 Metrologia da temperatura
em termos de unidade, mas com a origem ( T = 0 K ) em -273,15 ∞C . Assim, o valor da
temperatura do ponto triplo da água é, nesta nova escala, TPT = 273,16 K , o que
corresponde a 0,01 ºC. A temperatura do ponto triplo da água pode ser medida com
precisão e reproduzida facilmente. De notar ainda que a palavra “grau” foi suprimida da
escala Kelvin.
P
Gás A
Gás B
Extrapolação
para P = 0
Gás C
Gás D
0 q PT = 0, 01 q PV = 100
-273,15
Figura 4.3
θ / ºC
Gráfico de P em função de θ, obtido experimentalmente com o
termómetro de gás a volume constante, utilizando quatro gases
diferentes a baixas pressões (Anacleto, 2004).
Denotando por X PT é o valor da propriedade termométrica no ponto triplo, da
equação (4.2), obtemos
a=
273,16 K
X PT
(4.3)
e podemos escrever então a função termométrica como
q ( X ) = 273,16 K
X
X PT
(Y constante) .
(4.4)
A temperatura do PT da água é o ponto fixo padrão da termometria. Para obtermos
a temperatura correspondente ao ponto triplo da água, utilizamos uma célula, como se
mostra na Figura 4.4.
81
Temperatura e sua medição
Selado
Termómetro
Vapor
de água
Camada
de água
Gelo
Água
Figura 4.4
Célula de ponto-triplo da água (Anacleto, 2004).
A relação entre os valores numéricos da temperatura expressos em graus Celsius e
em Kelvin é dada por
T ( ºC) = T (K ) - 273,15
(4.5)
A escala Fahrenheit, escala muito utilizada nos países de cultura anglo-saxónica,
em particular nos EUA, aparece com muita frequência nas especificações e
características de equipamentos, por isso é importante conhecê-la. A fixação da escala
Fahrenheit, em 1715, é anterior à definição da escala centígrada. É baseada nas mesmas
referências que a escala centígrada, apenas os valores numéricos atribuídos são
diferentes. Assim, a escala Fahrenheit atribui ao ponto de fusão do gelo o valor 32 ºF e ao
ponto de ebulição da água, a 1 atmosfera, o valor 212 ºF. A diferença entre estes dois
valores é de 180 ºF. A divisão da escala em 180 partes seguiu um critério análogo ao da
divisão da semicircunferência em graus. A relação entre os valores numéricos da
temperatura expressa em ºF e em ºC é dada por
Ê 5º C ˆ
¥ (º F - 32º F)
ºC = Á
Ë 9º F ˜¯
(4.6)
A Tabela 4.2 apresenta algumas conversões entre escalas de temperatura.
82
4 Metrologia da temperatura
Conversão de
Para
Celsius
Fahrenheit
ºF = ºC ¥ 1,8 + 32
Celsius
Kelvin
K = ºC + 273,15
Celsius
Rankine
ºRa = ºC ¥ 1,8 + 32 + 459, 67
Celsius
Réaumur
ºR = ºC ¥ 0,8
Kelvin
Fahrenheit
Kelvin
Rankine
ºRa = K ¥ 1,8
Kelvin
Réaumur
ºR = (K - 273,15) ¥ 0,8
Tabela 4.2
4.3.2
Equação
ºF = K ¥ 1,8 - 459, 67
Algumas conversões de unidades de temperatura.
Termómetro de gás a volume constante
É mostrado na Figura 4.5 um esquema simplificado de um termómetro de gás a
volume constante. Os materiais, a construção, e as dimensões variam de laboratório para
laboratório e dependem da natureza do gás e da gama de temperaturas para a qual o
termómetro é concebido.
Reservatório
de mercúrio
Tubo capilar
h
Ponteiro
Gás
M
Figura 4.5
M¢
Representação esquemática de um termómetro de gás a volume
constante, sendo a propriedade termométrica a pressão
(Anacleto, 2004).
83
Temperatura e sua medição
O gás está contido num reservatório que comunica com a coluna de mercúrio M
através dum tubo capilar. O volume do gás é mantido constante por ajustamento da
coluna de mercúrio M até tocar num pequeno ponteiro que se encontra no espaço acima
de M. A coluna M é ajustada elevando ou baixando o reservatório do mercúrio.
A pressão no sistema é igual à pressão atmosférica mais a que é devida à diferença
de altura entre M¢ e M, h, e é medida duas vezes: quando o gás está rodeado pelo
sistema cuja temperatura queremos medir, obtendo-se P, e quando está rodeado por água
no ponto triplo, obtendo-se PPT . A temperatura é, então, dada por
q ( P ) = 273,16 K
P
PPT
(V constante) .
(4.7)
No séc. XIX, o termómetro mais preciso era o termómetro de gás. Foi oficialmente
adoptado pelo Comité Internacional de Pesos e Medidas em 1887 como o termómetro
padrão, substituindo o termómetro de mercúrio-num-tubo. A base teórica para o
termómetro de gás é a relação entre a pressão, volume, e temperatura expressa pela lei
dos gases ideais,
PV = n RT ,
(4.8)
onde P é a pressão, V é o volume, n é a quantidade de gás, e R a constante molar dos
gases. A temperatura T é a temperatura termodinâmica teórica.
Meçamos a temperatura absoluta, dada por um termómetro de gás ideal, no ponto
de ebulição normal (PEN) da água (o ponto de vapor). É introduzida uma quantidade de
gás no reservatório do termómetro de gás a volume constante, e medimos PPT quando o
reservatório do gás está inserido numa célula de ponto triplo. Suponhamos que PPT é
igual a 120 kPa. Mantendo o volume constante, seguimos os seguintes procedimentos:
1. Envolvemos o gás com vapor de água em ebulição, à pressão atmosférica
normal, medimos a pressão do gás PPEN , e calculamos a temperatura empírica θ,
usando a equação (4.7),
q ( PPEN ) = 273,16 K
PPEN
.
120
84
4 Metrologia da temperatura
2. Retiramos algum gás de tal maneira que PPT tenha um valor inferior, por
exemplo, 60 kPa. Medimos o novo valor de PPEN e calculamos um novo valor
para θ,
q ( PPEN ) = 273,16 K
PPEN
.
60
3. Continuamos a reduzir a quantidade de gás no reservatório de tal forma que PPT
e PPEN tenham cada vez valores menores, por exemplo, PPT tenha os valores
40 kPa, 20 kPa, etc. Para cada valor de PPT , calculamos o valor correspondente
da temperatura q ( PPEN ) .
4. Representamos graficamente q ( PPEN ) versus PPT e extrapolamos a curva
resultante para obtermos a intersecção no eixo onde PPT = 0 , lendo do gráfico o
valor do lim q ( PPEN ) .
PPT Æ0
Os resultados de uma série de testes desta natureza estão esboçados na Figura 4.6
para três gases diferentes com o objectivo de medir q ( P ) para o ponto de ebulição
normal da água. O gráfico indica que, embora as leituras do termómetro de gás a volume
constante dependam da natureza do gás a valores ordinários de PPEN , todos os gases
indicam a mesma temperatura se PPT diminuir e tender para zero.
q /K
373,60
373,50
N2
T (vapor) = 373,124 K
373,40
373,30
373,20
H2
He
373,10
0
Figura 4.6
20
40
60
120
PPT / kPa
Temperatura do PEN da água dada por diferentes termómetros
de gás, no limite quando PPT Æ 0 (Anacleto, 2004).
85
Temperatura e sua medição
Assim, definimos a temperatura absoluta, T, dada por um termómetro de gás
ideal, pela equação
Ê P ˆ
T = 273,16 K lim Á
PPT Æ 0 Ë P ˜
PT ¯
(V constante)
(4.9)
Embora a escala de temperatura termodinâmica dada por um gás ideal seja
independente das propriedades de um gás particular, ela depende ainda das propriedades
dos gases em geral. O hélio é o gás mais indicado para termometria por duas razões. A
altas temperaturas o hélio não se difunde através da platina, ao contrário do hidrogénio.
O hélio torna-se líquido a uma temperatura menor que qualquer outro gás, e, por isso, o
termómetro de hélio pode ser usado para medir temperaturas menores do que as que são
possíveis com outro gás.
4.3.3
Calibração e padrões de medida
Entende-se por padrão de medida o instrumento de medição ou sistema de medição
destinado a definir ou materializar, conservar ou reproduzir uma unidade ou um ou
vários valores conhecidos de uma grandeza para as transmitir por comparação a outros
instrumentos de medição (VIM, 2005).
Consoante as suas características metrológicas um padrão pode ter várias
designações. Podemos classificá-los em:
• Padrão internacional: é um padrão reconhecido por um acordo internacional
para servir de base internacional à fixação dos valores de todos os outros padrões da
grandeza a que respeita.
• Padrão primário: é um padrão que apresenta as mais elevadas características
metrológicas num dado domínio.
• Padrão secundário: é um padrão cujo valor é fixado por comparação com um
padrão primário.
• Padrão de trabalho: é um padrão que, habitualmente calibrado por comparação
com um padrão de referência, sendo utilizado para calibrar ou verificar os instrumentos
de medida de utilização mais comum.
86
4 Metrologia da temperatura
Vê-se assim que os diferentes padrões estão hierarquizados de acordo com as
qualidades metrológicas segundo uma escala decrescente dos primários para os de
trabalho, agrupando-se em uma das três categorias apresentadas. No que respeita aos
padrões internacionais não faz sentido, em geral, falar-se da sua exactidão, uma vez que
eles constituem a base de todas as comparações; exceptuam-se os casos em que é
possível reportar os seus valores directamente aos das unidades a que respeitam
realizando as chamadas medidas de acordo com a definição dessas unidades. Pode então
pôr-se a questão de saber qual o critério ou critérios que levam à escolha de um padrão
para padrão internacional. Se excluirmos critérios de escolha marginalmente importantes,
como por exemplo os da facilidade de realização ou praticabilidade de utilização, é óbvio
que a escolha terá a ver com dois aspectos: a exactidão desse padrão e a conformidade
entre as medições com ele obtidas e os valores previstos pelas teorias pertinentes na
análise de fenómenos em que intervém a grandeza em causa. Assim, quanto menor for o
desvio padrão experimental de um conjunto de intercomparações entre padrões iguais,
melhor será esse padrão do ponto de vista de constituir base para a fixação dos valores de
outros instrumentos de medida.
Em relação aos padrões primários, secundários e de trabalho o conceito de
exactidão é pertinente, uma vez que se pode tomar como base os padrões internacionais.
Deste modo, e uma vez que a qualidade metrológica mais importante de um padrão é a
sua exactidão, à hierarquia primário, secundário e de trabalho corresponde uma escala
crescente de imprecisões. A essa hierarquia corresponde também uma escala decrescente
de custos dos padrões; genericamente, e para uma mesma grandeza, um padrão de
trabalho é mais barato do que um secundário e este mais barato que um primário. Como
tal, e também porque as precisões exigidas não são as mesmas em todas as situações de
medida, os diferentes tipos de padrão encontram-se em diferentes tipos de laboratório:
um laboratório nacional de padrões disporá de padrões primários, laboratórios privados
ou industriais disporão de padrões secundários, os quais são utilizados como referência
para ajuste e calibração de padrões de trabalho. Este tipo de organização, que pode
revestir diferentes formas, deverá em qualquer caso permitir reportar o valor medido com
um padrão de trabalho a um padrão pelo menos primário mediante uma cadeia
ininterrupta de comparações que se designa por rastreabilidade. O National Institute of
Standards and Technology (NIST)16 tem uma organização hierárquica das referências
utilizadas nos Estados Unidos da América em três escalões como se segue:
16
http://www.nist.gov
87
Temperatura e sua medição
Escalão I
1. Padrões internacionais.
2. Padrões primários (padrões nacionais).
3. Padrões secundários (padrões de referência do NIST).
4. Padrões de trabalho (utilizados pelo NIST para serviços de calibração).
Escalão II
1. Padrões de referência; padrões secundários mantidos por laboratórios
particulares e industriais.
2. Padrões de trabalho; padrões usados para calibrar e verificar aparelhos de
laboratório de uso geral.
Escalão III
Instrumentos de uso geral para produção, manutenção e ensaios externos.
A designação de padrão de referência diz respeito a um padrão, em geral da mais
elevada qualidade metrológica, disponível num dado local, do qual derivam as medições
efectuadas nesse local. Por vezes utiliza-se um conjunto de instrumentos de medição
idênticos, associados para desempenhar em conjunto o papel de padrão. Ao padrão assim
realizado chama-se padrão colectivo. Reserva-se a designação de colecção padrão para o
conjunto de padrões com valores escolhidos especialmente para reproduzir
individualmente, ou por combinação adequada, uma série de valores de uma grandeza
numa dada gama. As caixas de blocos padrão, usadas em metrologia dimensional,
constituem exemplo típico deste tipo de padrão.
A calibração é um conjunto de operações que estabelecem, em condições
especificadas, a relação entre os valores indicados por um instrumento de medição e os
correspondentes valores conhecidos da grandeza a medir. São utilizados dois tipos de
padrões: o padrão de transferência, utilizado como intermediário na comparação de
padrões ou instrumentos de medição entre si e o padrão itinerante, padrão, por vezes de
construção especial, previsto para ser transportado entre diferentes locais.
A conservação do padrão é o conjunto de todas as operações necessárias à
preservação das características metrológicas do padrão dentro de limites adequados.
Destaca-se a sua calibração, a qual é feita comparando esse padrão com um da mesma
unidade, mas de maior exactidão. A calibração deve ser periódica, dependendo do tipo,
utilização e tempo de vida os intervalos de tempo entre calibrações. Como valor típico,
um padrão de trabalho deve ser calibrado utilizando um secundário de 6 em 6 meses.
88
4 Metrologia da temperatura
Além disso, deve ser dado especial cuidado aos aspectos de utilização e armazenamento
do padrão de modo a manter as suas qualidades metrológicas ao longo da sua vida útil.
4.3.4
Padrão de temperatura termodinâmica
Os padrões de temperatura são termómetros de diferentes tipos. Assim, o padrão
primário é constituído por um termómetro de resistência de platina de construção
especial de modo a que o fio não seja sujeito a esforços mecânicos. A escala deste
termómetro, usualmente graduada em ºC (escala prática), é estabelecida com base nos
seguintes valores (à pressão atmosférica normal, 1,01325 ¥ 105 Pa ):
• Fundamental:
ponto triplo da água: 0, 01ºC
• Primários: ponto de ebulição do oxigénio: -182,954 ºC
ponto de ebulição do enxofre: 444, 72 ºC
ponto de congelação da prata: 961, 78 ºC
ponto de congelação do ouro: 1064,18 ºC
Os valores intermédios são calculados a partir de fórmulas de ajuste baseadas nas
propriedades do fio de resistência de platina.
4.4 A Escala Internacional de Temperatura (ITS-90)
A ITS-90 consiste num conjunto de pontos fixos medidos com o termómetro de gás
primário, e em procedimentos para interpolação entre os pontos fixos usando
termómetros secundários. Embora a ITS-90 não tencione suplantar a escala
termodinâmica Kelvin, é construída de forma a ser uma aproximação elevada daquela.
As diferenças entre a escala prática de temperatura T90 e a escala de temperatura
termodinâmica Kelvin T estão dentro dos limites de incerteza das medições em 1990. A
medição precisa de temperatura com um termómetro de gás requer anos de trabalho
laboratorial e de computação e, quando completo, torna-se um acontecimento
internacional. Foram medidas as temperaturas de estados de equilíbrio de vários
materiais, constituindo pontos fixos para a ITS-90.
89
Temperatura e sua medição
O limite inferior da ITS-90 é 0,65 K. Abaixo desta temperatura, a escala é,
actualmente, indefinida em termos de um termómetro padrão. Vários intervalos de
temperatura na ITS-90 e termómetros secundários foram estabelecidos:
1. De 0,65 K a 5,0 K. Entre 0,65 K e 3,2 K, a ITS-90 é definida pelas relações
pressão de vapor - temperatura do 3He, e entre 1,25 K e 5,0 K pelas relações de
pressão de vapor - temperatura do 4He.
2. De 3,0 K a 24,5561 K, a ITS-90 é definida pelo termómetro de gás a volume
constante de 3He ou 4He.
3. De 13,8033 K a 1234,93 K (–259,3467 ºC a 961,78 ºC), a ITS-90 é definida pela
razão R (T ) RPT do termómetro de resistência de platina, utilizando-se os
pontos fixos determinados pelo termómetro de gás a volume constante.
Acima de 1234,93 K (961,78 ºC), a ITS-90 é definida por um pirómetro óptico.
Podemos encontrar mais informações sobre a ITS-90 no endereço de Internet
http://www.its-90.com.
Os pontos fixos usados na ITS-90 são os que se apresentam na Tabela 4.3.
90
4 Metrologia da temperatura
Temperatura
a
a
Nº
T90/K
t90/°C
Substância
Estado
1
3a5
– 270,15 a – 268,15
He
V
2
13,8033
– 259,3467
e-H2
T
3
~ 17
~ – 256,15
e-H2 (ou He)
V (ou G)
4
~ 20,3
~ – 252,85
e-H2 (ou He)
V (ou G)
5
24,5561
– 248,5939
Ne
T
6
54,3584
– 218,7916
O2
T
7
83,8058
– 189,3442
Ar
T
8
234,3156
– 38,8344
Hg
T
9
273,16
0,01
H20
T
10
302,9146
29,7646
Ga
F
11
429,7485
156,5985
In
S
12
505,078
231,928
Sn
S
13
692,677
419,527
Zn
S
14
933,473
660,323
Al
S
15
1234,93
961,78
Ag
S
16
1337,33
1064,18
Au
S
17
1357,77
1084,62
Cu
S
Os símbolos têm os seguintes significados:
V – ponto de pressão de vapor;
T – ponto triplo (temperatura à qual as fases sólida, líquida e vapor coexistem em
equilíbrio);
G – ponto do termómetro de gás;
F, S – ponto de fusão, ponto de solidificação (temperatura, à pressão de 101 325 Pa, à qual
as fases sólida e líquida coexistem em equilíbrio).
Tabela 4.3
Os pontos fixos usados na ITS-90 (www.its-90.com).
Consequências práticas da adopção da ITS-90
A introdução dessa nova escala de temperaturas trouxe como consequência a
modificação da quase totalidade dos valores numéricos de temperatura. Uma dada
temperatura expressa com base na ITS-90 tem um valor numérico diferente daquele que
tinha quando era expressa a partir da IPTS-68, excepto nos casos do zero absoluto (0 K),
da temperatura do ponto triplo da água e de alguns outros pontos. A título de exemplo, o
ponto de ebulição da água, à pressão atmosférica "normal" era de 100 ºC pela IPTS-68,
sendo agora 99,974 ºC. Outras grandezas muito utilizadas nos vários domínios técnicos e
científicos, que também são afectadas por estas alterações são, por exemplo, a capacidade
térmica mássica e a entropia.
91
5 Tipos mais usuais de termómetros e sua aplicação
Na medição de temperatura o termómetro, em muitas situações, está em contacto
físico com o sistema do qual se quer saber a temperatura, mas situações há em que isso
não é possível, por exemplo se o sistema estiver em movimento ou se a temperatura a
medir for muito elevada como nas siderurgias. Aos termómetros que não estão em
contacto físico com o sistema aquando da medição da temperatura chama-se pirómetros e
utilizam a radiação emitida pelos corpos para medir a temperatura.
Os termómetros de contacto podem ser de dois tipos: mecânico e eléctrico. Estes
termómetros requerem o equilíbrio térmico com o corpo cuja temperatura queremos
medir, equilíbrio esse que pode ser atingido mais ou menos rapidamente dependendo do
tempo de resposta do termómetro (capacidade térmica do sensor).
5.1 Termómetros de dilatação
Os materiais, sólidos e líquidos, de um modo geral, aumentam de volume com o
aumento da sua temperatura, pois aumenta a distância média entre as partículas
constituintes do material. Esta propriedade pode ser utilizada como propriedade
termométrica, principalmente para os materiais em que essa variação se faz de uma
forma uniforme, dentro de uma dada gama de temperaturas. De seguida veremos
exemplos de termómetros que se servem dessa propriedade.
5.1.1
Termómetro de dilatação de líquido
Princípio de funcionamento
Os termómetros de dilatação de líquidos, baseiam-se na lei de expansão
volumétrica de um líquido com a temperatura dentro de um recipiente fechado.
A equação que rege esta relação é:
2
3
Vq = V0 È1 + b1Dq + b 2 ( Dq ) + b 3 ( Dq ) ˘
Î
˚
93
Temperatura e sua medição
onde q é a temperatura do líquido em ºC; V0 é o volume do líquido à temperatura inicial
de referência q 0 ; Vq é o volume do líquido à temperatura q ; b1 , b 2 e b 3 são os
coeficientes de expansão do líquido em ºC -1 , ºC -2 , e ºC -3 , respectivamente; e
Dq = q - q 0 .
Teoricamente esta relação não é linear, porém como os termos de segunda e
terceira ordem são desprezíveis (Fialho, 2007), por serem relativamente pequenos, na
prática consideramos linear. Temos assim a equação
Vq = V0 [1 + b Dq ]
Dependendo da sua construção podemos ter termómetros de dilatação de líquido
em recipiente de vidro transparente ou em recipiente metálico.
5.1.1.1 Termómetros de dilatação de líquido em recipiente de vidro
Os termómetros de dilatação de líquido em recipiente de vidro são constituídos por
um reservatório, cujo tamanho depende da sensibilidade desejada, soldada a um tubo
capilar (de secção o mais uniforme possível) fechado na parte superior. O reservatório e
parte do capilar são preenchidos com um líquido. Na parte superior do capilar existe um
alargamento que protege o termómetro no caso da temperatura ultrapassar seu limite
máximo. A Figura 5.1 mostra termómetros de dilatação de líquido em vidro.
Figura 5.1
Termómetros de dilatação em recipiente de vidro.
Após a calibração, a parede do tubo capilar é graduada em graus ou fracções deste.
A medição de temperatura faz-se pela leitura da escala no ponto em que se tem o topo da
coluna líquida.
94
5 Tipos mais usuais de termómetros e sua aplicação
Os líquidos mais usados são: Mercúrio, Álcool, Tolueno e Acetona. O álcool etílico
é usado para medições de temperaturas baixas (-38,9 ºC). Costumam-se adicionar
corantes para visualizar a leitura (Pires et al, 2006), visto que o álcool etílico é incolor.
Foi muito utilizado o mercúrio por possuir um coeficiente de expansão uniforme,
não molhar o vidro, purificar-se facilmente e tornar fácil a leitura (devido à sua aparência
metálica), mas o seu uso traz problemas ambientais, motivo pelo qual tem sido
substituído por outros.
O termómetro clínico de mercúrio, que foi muito utilizado, é um termómetro de
máxima. O tubo capilar apresenta nas proximidades do reservatório um estrangulamento.
Quando a temperatura aumenta, o mercúrio dilata-se, subindo na haste, mas, se a
temperatura diminuir, fica o mercúrio no tubo, devido ao estrangulamento, o que permite
determinar a maior temperatura atingida pelo corpo do paciente.
Termómetro de máxima e de mínima
A primeira concepção de um termómetro deste tipo parece ser devida a Robert
Hooke que procurou determinar a temperatura do fundo do mar (termómetro de mínima).
Contudo, o modelo de dupla marcação foi introduzido por Rutherford, combinando um
de mercúrio (temperatura máxima) e outro de álcool (temperatura mínima) (Pires et al,
2006).
Este termómetro dá as temperaturas máximas e mínimas ocorridas durante certo
período, por exemplo, durante um dia. O reservatório deste termómetro é alongado e o
seu tubo é recurvado em forma de U. Na curvatura inferior existe uma pequena porção de
mercúrio que é impelida pelo álcool para o tubo das temperaturas máximas, a
temperatura aumenta, ou para o das temperaturas mínimas, quando a temperatura
diminui. O mercúrio, por sua vez, impele dois índices, colocado cada um num ramo do
tubo. Estes índices deslocam-se, no interior do tubo, com leve atrito; e fixam-se na
posição em que o mercúrio os deixa, marcando deste modo as temperaturas máxima e
mínima. No início de um novo período de observação reconduzem-se os índices, que são
de ferro esmaltado, para junto do mercúrio, por meio de um pequeno íman.
Este tipo de termómetro, Figura 5.2, foi muito usado dentro do campo da
Meteorologia e no controle de processos químicos em escala piloto e industrial onde a
temperatura é um parâmetro crítico.
95
Temperatura e sua medição
Figura 5.2
Termómetro de máxima e de mínima.
5.1.1.2 Termómetros de dilatação de líquido em recipiente metálico
No termómetro de dilatação de líquidos em recipiente metálico, Figura 5.3 A, o
líquido preenche todo o recipiente que sob o aumento de temperatura se dilata,
deformando um elemento extensível (sensor volumétrico).
O recipiente que contem o líquido varia de dimensão, de acordo com o tipo de
líquido e com a sensibilidade pretendida.
O tubo capilar deve ter o menor diâmetro interno possível a fim de evitar a
influência da temperatura ambiente, mas não deve oferecer resistência à passagem do
líquido quando este se está a expandir.
O elemento de medição utilizado é o Tubo de Bourdon, Figura 5.3 B, que pode ser
dos tipos: C, Helicoidal e Espiral.
Este tipo de termómetro é geralmente aplicado na indústria para indicação e
registo, pois permite leituras remotas e por ser o mais preciso dos sistemas mecânicos de
medição de temperatura (Fialho, 2007).
96
5 Tipos mais usuais de termómetros e sua aplicação
B
A
Figura 5.3
A – Termómetro de dilatação de líquido em recipiente metálico;
B – Tubos de Bourdon utilizados como elementos de medição.
Como exemplo deste termómetro temos o termómetro registador, Figura 5.4.
Neste modelo, o termómetro registra as temperaturas durante todo um período, por
exemplo, uma semana. É muito usado nos observatórios de Meteorologia, mas também
encontra emprego industrial, no controlo de processos. Ele é provido de um cilindro
giratório. A agulha contendo a tinta é movida por um tubo metálico, flexível, recurvado e
cheio de petróleo. As dilatações do petróleo obrigam o tubo a distender-se, sendo os seus
movimentos transmitidos à agulha por um sistema de pequenas alavancas (Pires e tal,
2006).
Figura 5.4
Termómetro registador.
97
Temperatura e sua medição
5.1.2
Termómetros de dilatação de sólidos (termómetro
bimetálico)
O termómetro bimetálico é constituído por duas ou mais lâminas com coeficientes
de dilatação diferentes, soldadas umas às outras, como se representa na Figura 5.6. Ao
dar-se uma variação na temperatura os metais dilatam-se de forma desigual, como se
pode observar na Figura 5.5, obrigando o conjunto a deformar-se e a actuar um contacto
eléctrico (termóstato) ou a posicionar um ponteiro indicador.
Figura 5.5
Flexão da lâmina bimetálica quando aquecida.
B
A
Figura 5.6
A - Termóstato; B - Termómetro bimetálico.
Na prática o par bimetálico é enrolado em forma de espiral ou hélice, o que
aumenta bastante a sensibilidade. A sua extremidade é fixa a um eixo o qual possui na
ponta um ponteiro que girará sobre uma escala de temperatura.
Qualquer deles tem grande difusão na indústria e em aplicações domésticas: citemse os termóstatos das máquinas de lavar roupa e louça, dos aquecedores e dos
frigoríficos.
98
5 Tipos mais usuais de termómetros e sua aplicação
5.2 Termómetros baseados no efeito Seebeck
5.2.1
Constituição
Um termopar é um sensor de temperatura, constituído por dois materiais diferentes,
condutores ou semicondutores17, ligados entre si. As extremidades onde estão ligados
constituem as junções que vão ser submetidas a temperaturas diferentes, originando uma
força electromotriz. Uma das junções é designada por junção de teste e é submetida à
temperatura que se deseja medir, T . A outra é denominada junção de referência e é
mantida a uma temperatura de referência, TRef , normalmente um banho de gelo fundente
(Zemansky et al, 1997), conforme se ilustra na Figura 5.7.
Metal A
TRef
T
Metal B
Figura 5.7
eS
Metal B
Termopar constituído por duas junções dos metais A e B, a
junção de medição e a junção de referência.
As junções podem ser feitas por vários métodos, sendo os mais importantes os
apertos dos materiais e as soldaduras. Embora se possa, em princípio, construir um
termopar com dois metais quaisquer, utilizam-se normalmente algumas combinações
normalizadas de metais, porque possuem tensões de saída previsíveis e suportam grandes
gamas de temperatura.
O termopar é um sensor activo, isto é, ele próprio gera uma força electromotriz18
(f.e.m.), não sendo portanto necessário alimentá-lo.
17
Os termopares com semicondutores têm um comportamento não linear, pelo que são pouco
utilizados na medição de temperatura.
18
Em rigor dever-se-ia dizer tensão electromotriz, em vez de força electromotriz, mas o seu uso
está generalizado.
99
Temperatura e sua medição
5.2.2
Características gerais
Os termopares podem ser utilizados para medição de temperaturas desde cerca de
-200 ºC até temperaturas superiores a 1000 ºC . Para temperaturas muito elevadas são
utilizados termopares de platina e uma liga de platina e ródio.
As vantagens dos termopares como termómetros são várias, das quais se destacam:
• Curtos tempos de resposta (o equilíbrio térmico é atingido rapidamente).
• Elevadas gamas de temperatura.
• Construção compacta.
• Elevada resistência à vibração.
• Estabilidade duradoura.
• Elevada robustez.
5.2.3
Princípio de funcionamento
A termoelectricidade tem a sua origem em Alessandro Volta (1800), físico italiano.
Volta concluiu que a electricidade causadora dos espasmos nas pernas de sapo, estudadas
por Luigi Galvani (1780), era devida a um contacto entre dois metais diferentes. Essa
conclusão foi a precursora do princípio do termopar.
Após a descoberta de Volta, outros cientistas passaram a pesquisar os efeitos
termoeléctricos, dos quais podem ser destacados Thomas Seebeck19 (1821), Jean Peltier20
(1834) e William Thomson (Lorde Kelvin)21 (1848-1854), e que deram origem às
denominações dos três efeitos básicos da termometria termoeléctrica. Estes efeitos
podem ser relacionados entre si e são conhecidos como efeitos termoeléctricos porque
envolvem temperatura e electricidade.
Os três efeitos referidos são o efeito Seebeck, que é o relevante para os termopares,
e os efeitos Peltier e Thomson, que descrevem o transporte de energia por calor por
intermédio de uma corrente eléctrica. Os efeitos Peltier e Thomson não são importantes
na metrologia da temperatura e quando presentes originam erros na medição.
A força electromotriz que é gerada num termopar é função da diferença de
temperatura entre as junções de medição e de referência e é medida usando um
voltímetro, ligado convenientemente no circuito termoeléctrico. Em medições precisas de
19
Thomas Johann Seebeck foi um físico alemão (1770-1831).
20
Jean Peltier foi um físico francês (1785-1845).
21
William Thomson (Lord Kelvin) foi um físico britânico (1824-1907).
100
5 Tipos mais usuais de termómetros e sua aplicação
temperatura deve usar-se um bom voltímetro (com elevada resistência interna), para que
a corrente eléctrica no circuito seja suficientemente pequena para que os efeitos Peltier e
Thomson sejam desprezáveis.
Para que sejam evitados possíveis erros causados por efeitos decorrentes da lei das
temperaturas sucessivas ou intermédias (ver secção 5.2.8), convencionou-se que o ponto
de abertura do circuito seria a própria junção de referência, onde fios de cobre seriam
ligados para que esses pontos fossem ligados ao voltímetro, conforme se ilustra na Figura
5.8. Como é descrito pela lei dos metais homogéneos (ver secção 5.2.8), a presença
desses fios de cobre não altera a f.e.m. lida no voltímetro.
Figura 5.8
Termopar onde a junção dos fios A e B constitui a junção de teste
e a junção de referência consiste em duas junções com fios de
cobre (Anacleto, 2004).
O termopar é, portanto, diferente da maioria dos sensores de temperatura uma vez
que a sua resposta está directamente relacionada com a diferença de temperatura entre as
junções de medição e de referência.
5.2.4
Efeito Seebeck
Thomas Seebeck descobriu a existência de correntes termoeléctricas enquanto
observava efeitos electromagnéticos associados a circuitos de bismuto/cobre e
bismuto/antimónio. As experiências feitas mostraram que, quando as junções de dois
metais distintos formavam um circuito fechado e são submetidas a temperaturas
diferentes, uma força electromotriz é gerada, originando o aparecimento de uma corrente
eléctrica contínua nessa malha.
101
Temperatura e sua medição
Uma diferença de temperatura entre dois pontos de um condutor (ou semicondutor)
origina uma diferença de potencial eléctrico entre esses pontos. De outra forma, um
gradiente de temperatura num condutor origina um campo eléctrico. Este fenómeno é
designado por efeito Seebeck ou efeito termoeléctrico, e está ilustrado na Figura 5.9. O
princípio do termopar é baseado no efeito Seebeck.
Diferença de temperatura DT
E
EF
Frio
Quente
E
EF
Diferença de potencial De
1 f (E )
1 f (E )
Figura 5.9
O efeito Seebeck: um gradiente de temperatura origina uma
diferença de potencial (em circuito aberto).
A tensão termoeléctrica por unidade de diferença de temperatura é o coeficiente de
Seebeck, e é definido de forma que o sinal representa o potencial eléctrico do lado frio
em relação ao lado quente,
a =-
de
dT
(5.1)
Se os electrões se difundem do lado quente para o lado frio, então o coeficiente de
Seebeck é negativo. Se a difusão se der em sentido contrário, o coeficiente de Seebeck é
positivo. O coeficiente a é normalmente designado por potência termoeléctrica, o que é
uma designação incorrecta, pois este coeficiente refere-se a uma diferença de potencial e
não a uma potência. A designação mais apropriada é, portanto, coeficiente de Seebeck.
Este coeficiente, dado por (5.1) e com valores da ordem de alguns μV K -1 , é uma
propriedade do material e depende da temperatura.
Conhecendo o coeficiente de Seebeck a (T ) para um material, a diferença de
potencial entre dois pontos a temperaturas T0 e T é dado por
102
5 Tipos mais usuais de termómetros e sua aplicação
T
De = Ú a dT
(5.2)
T0
A energia média por electrão, E , num metal no qual a densidade de estados de
energia é g ( E ) μ E é dada por (Kasap, 2002; Kittel, 1986)
2
3 È 5p 2 Ê k T ˆ ˘
˙
E = EF Í1 +
5 Í
12 ÁË EF ˜¯ ˙
Î
˚
(5.3)
onde EF é a energia de Fermi (definida a T = 0 K ). Da equação (5.3) a energia média
por electrão no lado quente é maior que no lado frio e, como consequência, os electrões
mais energéticos no lado quente difundem-se para o lado frio até que a diferença de
potencial que se cria ponha fim ao processo de difusão. Notemos que a energia média por
electrão também depende do material através da energia de Fermi, EF . Mostra-se
(Kasap, 2002) que o coeficiente de Seebeck é dado aproximadamente por
a=
p 2k 2 T
(5.4)
2 e EF
Devemos referir que o raciocínio apresentado é baseado assumindo que os
electrões de condução num metal comportam-se como “electrões livres”. Esta
aproximação só se aplica satisfatoriamente a metais “normais”, como, por exemplo, ao
sódio, potássio e alumínio. A difusão dos electrões do lado quente apara o lado frio
pressupõe que na região quente os electrões têm velocidades maiores, de acordo com a
teoria dos electrões livres nos metais. Contudo, teremos que considerar as interacções dos
electrões de condução com os iões e as vibrações da rede para compreender alguns
resultados experimentais, como por exemplo, o facto de alguns metais apresentarem
coeficientes de Seebeck positivos.
5.2.5
O termopar
Consideremos uma barra de um metal A aquecido numa das extremidades e
arrefecido na outra. Se quisermos medir a diferença de potencial De através da barra
usando ligações ao voltímetro feitas do mesmo metal, não o conseguiremos porque
103
Temperatura e sua medição
aparece uma diferença de potencial simétrica nos fios de ligação ao voltímetro, conforme
se ilustra na Figura 5.10.
Metal A
Quente
+
-
+
-
eS = 0
Metal A
Frio
Metal A
Figura 5.10 Para um termopar constituído por duas junções de um mesmo
metal A não é possível medir a diferença de potencial.
É possível, contudo, medir uma diferença de potencial se ligarmos o voltímetro
utilizando fios de um metal diferente, mais propriamente, utilizando um metal com um
coeficiente de Seebeck diferente. O termopar usa precisamente, pelo menos, dois metais
A e B diferentes e duas junções, sendo uma mantida a uma temperatura de referência T0
e a outra é usada para medir a temperatura T , conforme se ilustra na Figura 5.11.
Metal A
Quente +
T +
-
+
eS π 0
Metal B
-
Frio
- T0 = TRef
Metal B
Figura 5.11 Um termopar tem que ser constituído por duas junções de dois
metais diferentes A e B.
A diferença de potencial em cada elemento metálico depende do seu coeficiente de
Seebeck e consequentemente a f.e.m. do termopar, e AB = e A - e B , depende da diferença
a A - a B , e, pela equação (5.2), é dada por
T
T
T0
T0
e AB = Ú (a A - a B ) dT = Ú a AB dT
(5.5)
onde a AB = a A - a B é definido como a potência termoeléctrica do termopar A-B.
Se considerarmos a AB aproximadamente constante, podemos escrever
104
5 Tipos mais usuais de termómetros e sua aplicação
e AB = a AB DT = a AB (T - T0 ) = a ABT + a BAT0
(5.6)
Os dois termos da direita na equação anterior, a ABT e a BAT0 , são as diferenças de
potencial geradas nas junções à temperatura T e T0 , respectivamente.
O valor de a AB pode ser obtido por duas formas: a) como a diferença entre os
coeficientes Seebeck dos dois metais relativos a um metal de referência R arbitrário, a AR
e a BR ; ou b) por diferenciação numérica de valores tabelados de e S versus T, para uma
determinada temperatura de referência, conforme a relação (5.5).
De qualquer forma, o coeficiente Seebeck representa, para uma determinada
combinação de materiais, a razão entre a variação na f.e.m. de uma malha e a variação na
temperatura, ou seja:
De AB d e AB
=
Dt Æ 0 DT
dT
a AB = lim
Deste modo, se uma função e AB = aT + bT 2 é obtida através de uma calibração,
temos a AB = d e AB dT = a + 2bT e podemos então afirmar que para uma determinada
combinação de metais, o coeficiente de Seebeck é função apenas da temperatura.
Uma consequência imediata do efeito Seebeck é o facto de que, conhecida a
temperatura de uma das junções pode-se, através da f.e.m. produzida, saber a temperatura
da outra junção. As medições de temperatura são, na realidade, a maior aplicação do
termopar, bastando conhecer a relação f.e.m. versus a variação de temperatura na junção
do termopar. Esta relação pode ser obtida por calibração, ou seja, uma comparação com
um padrão de temperatura.
Os outros dois efeitos termoeléctricos – os efeitos de Peltier e de Thomson – são
apresentados a seguir, apenas porque estão relacionados com o efeito Seebeck, pois não
têm grande importância para a medição de temperatura.
5.2.6
Efeito Peltier
Jean Peltier descobriu efeitos termoeléctricos interessantes quando introduziu
pequenas correntes eléctricas externas num termopar de bismuto-antimónio. As
experiências feitas mostraram que, quando uma pequena corrente eléctrica atravessa a
105
Temperatura e sua medição
junção de dois metais diferentes numa direcção, a junção arrefece, absorvendo energia
por calor do meio em que se encontra. Quando a direcção da corrente é invertida, a
junção aquece, aquecendo o meio em que se encontra. Este efeito está presente quer a
corrente seja gerada pelo próprio termopar quer seja originada por uma fonte de tensão
externa. Por isso, na utilização de um termopar deve-se reduzir tanto quanto possível esta
corrente, utilizando voltímetros com elevada resistência interna.
A potência trocada por calor (libertada ou absorvida), d QP dt , é proporcional à
intensidade de corrente eléctrica, I , no circuito
d QP
dt
= p AB I
(5.7)
onde p AB é o coeficiente (ou tensão) de Peltier.
Podemos relacionar os coeficientes de Peltier e de Seebeck, tendo em conta que a
potência é dada pelo produto da diferença de potencial pela corrente. Para uma junção
com uma diferença de potencial de Seebeck e S e percorrida por uma corrente eléctrica I
temos, atendendo à equação (5.6),
d QP
dt
= e S I = a AB T I
(5.8)
E pela equação (5.7) obtemos
p AB = a AB T
(5.9)
O significado físico do coeficiente p AB é a energia libertada ou absorvida por calor
pela junção por unidade de tempo e por unidade de corrente eléctrica. Tem as unidades
de uma tensão eléctrica. A polaridade e o valor da tensão Peltier, p AB , depende da
temperatura da junção e dos materiais usados na sua construção, sendo, no entanto,
independente da temperatura da outra junção.
Aquecimento ou arrefecimento exterior da junção provoca o efeito contrário ao
efeito Peltier. Mesmo na ausência de todos os outros efeitos termométricos, quando a
temperatura de uma junção (a junção de referência) é mantida constante e a temperatura
da outra junção é aumentada por calor externo, uma corrente eléctrica será induzida na
106
5 Tipos mais usuais de termómetros e sua aplicação
malha numa direcção. Se a temperatura desta última diminuir abaixo da primeira por
arrefecimento externo, o sentido da corrente eléctrica será invertido. Portanto, o efeito
Peltier está intimamente relacionado ao efeito Seebeck.
O efeito de Peltier aparece adicionado ao efeito de Joule, no qual a passagem de
uma corrente através de uma resistência, neste caso a junção, dá origem à produção de
uma libertação de energia por calor proporcional ao quadrado da corrente I. No caso dos
metais vulgares, e para as intensidades de corrente eléctrica normalmente usadas, a
potência trocada por calor devida ao efeito de Peltier, d QP dt , é muito menor do que a
originada por efeito de Joule, d QJ dt . O mesmo já não se passa com a junção de
determinados materiais semicondutores, para os quais poderá ter-se d QP dt d QJ dt .
O efeito de Peltier é utilizado em electrónica para o controlo de temperatura de
componentes de circuitos. Na indústria é utilizado em pequenos frigoríficos estáticos
(sem compressor).
5.2.7
Efeito de Thomson
William Thomson concluiu que os coeficientes a AB e p AB estão relacionados
através da temperatura absoluta. Thomson chegou à conclusão que uma corrente eléctrica
produz diferentes efeitos térmicos, dependendo da direcção de sua passagem do ponto
quente para o ponto frio ou do frio para o quente, num mesmo metal. Aplicando os
princípios da Termodinâmica aos termopares e desprezando o termo I 2 R e outros
processos de troca de energia por calor, Thomson concluiu que, se uma corrente eléctrica
produz somente os efeitos Peltier de aquecimento, então a tensão Peltier na malha seria
igual à tensão Seebeck e seria proporcional à diferença de temperatura das junções do
termopar.
Este raciocínio conduz a um desacordo com os efeitos observados, isto é,
d e S dT π constante . Por essa razão, Thomson concluiu que a tensão Peltier na malha
não seria a única tensão gerada num circuito termopar, mas que um único condutor por si
só, quando exposto a um gradiente de temperatura longitudinal, seria também uma fonte
de tensão.
O efeito Thomson é a libertação ou a absorção de energia por calor que ocorre
quando uma corrente eléctrica atravessa um material condutor homogéneo, através do
qual um gradiente de temperatura é mantido, não importando se a corrente é introduzida
externamente ou induzida pelo próprio termopar.
107
Temperatura e sua medição
A potência por calor libertada ou absorvida num condutor é proporcional à
diferença de temperatura, DT , e à corrente eléctrica no condutor, I , ou seja,
d QT
dt
= s I DT
(5.10)
onde s é o coeficiente de Thomson.
Por analogia entre s e a usual capacidade térmica mássica, c , Thomson referiu-se
a s como o calor específico de electricidade. É importante realçar que s representa a
taxa de absorção ou emissão de energia como calor por unidade de gradiente de
temperatura e por unidade de corrente eléctrica; ao passo que c representa a energia
transferida como calor por unidade de gradiente de temperatura por unidade de massa. O
coeficiente Thomson é visto também como uma representação de f.e.m. por unidade de
diferença de temperatura. Portanto, a tensão Thomson total gerada num condutor pode
ser expressa como:
T2
e T = Ú s dT
(5.11)
T1
onde a sua polaridade e valor dependem do valor da temperatura, da diferença de
temperatura e do material. Deve-se notar que a tensão de Thompson não pode manter
uma corrente com apenas um condutor homogéneo formando um circuito fechado, pois
duas forças electromotrizes iguais e opostas serão geradas nos dois sentidos entre as
partes quente e fria.
Mais tarde Thomson conseguiu demonstrar indirectamente a existência da tensão
de Thomson. Ele aplicou uma corrente eléctrica externa num circuito fechado, formado
por um único condutor homogéneo, submetido a um gradiente de temperatura e percebeu
que o calor produzido por I 2 R aumentava ou diminuía levemente por causa do calor
Thomson nos sentidos de quente para frio ou de frio para quente, dependendo do sentido
da corrente e do metal do condutor.
5.2.8
As leis do funcionamento dos termopares
O funcionamento dos termopares pode ser sistematizado pelo enunciado de
algumas leis, que se apresentam seguidamente e se ilustram na Figura 5.12.
108
5 Tipos mais usuais de termómetros e sua aplicação
•
Dois metais e duas junções
Um circuito que utilize termopares deve conter pelo menos dois metais distintos e
pelo menos duas junções (Figura 5.12a).
•
Independência da temperatura do percurso
A tensão de saída do termopar, e 0 , depende apenas das temperaturas das junções,
T1 e T2 , sendo independente da forma como a temperatura se distribui pelos condutores,
desde que não haja corrente eléctrica no circuito (Figura 5.12b).
•
Lei dos metais intermédios 1
Se um terceiro metal homogéneo for inserido no condutor A ou no condutor B de
um circuito com termopares (Figura 5.12c), a tensão de saída e 0 permanece inalterada,
desde que as novas junções estejam à mesma temperatura, Ti = Tj .
•
Lei dos metais intermédios 2
A instalação de um material intermediário C numa junção AB (Figura 5.12d) não
modifica a tensão de saída e 0 , desde que as novas junções criadas sejam mantidas à
temperatura T2 .
•
Lei das temperaturas sucessivas
Um circuitos de termopares com temperaturas T1 e T2 (Figura 5.12e), origina uma
tensão de saída e12 = f (T1 , T2 ) . O mesmo circuito submetido às temperaturas T2 e T3
produz uma tensão e 23 = f (T2 , T3 ) . Se o circuito for submetido às temperaturas T1 e T3 a
tensão de saída é dada por
e13 = f (T1 , T3 ) = e12 + e 23
Essa lei permite que um termopar calibrado numa determinada referência de
temperatura, seja usado com qualquer outra referência de temperatura, aplicando-se a
correcção adequada.
109
Temperatura e sua medição
T3
A
T1
T1
T2
+
B
e0
-
T2
T6
B
+
B
a)
A
T1
B
-
e0
B
B
T2
+
B
A
T3 = T1
-
T2
-
e0
A
T1
e13
T5
d)
A
+
B
T1
c)
B
-
A
A
T2
+
e0
b)
C T
j
Ti
T4
A
B
T2 + T2
B
+
e12
-
T3
B
B
+
e 23
-
B
e)
A
C
A
T2 = T1
T1
B
+
e AB
-
B
T2 + T1
C
+
e AC
-
C
T2
B
+
e CB
-
B
f)
Figura 5.12 Ilustração das leis de funcionamento dos termopares.
Uma outra consequência dessa lei é que fios ou cabos de extensão, que tenham as
mesmas características termoeléctricas dos fios do termopar, podem ser ligados a ele sem
que a f.e.m. térmica da malha seja modificada. Isso é aplicado principalmente em
termopares nobres, em virtude do custo dos termoelementos.
•
Lei dos metais sucessivos
Um termopar constituído pelos materiais A e C e com as junções submetidas às
temperaturas T1 e T2 gera uma tensão e AC (Figura 5.12f). Um circuito semelhante
constituído por materiais C e B gera, submetido às mesmas temperaturas, uma tensão
110
5 Tipos mais usuais de termómetros e sua aplicação
e CB . Um termopar semelhante na configuração e constituído pelos materiais A e B, gera,
quando submetido ás mesma temperaturas, uma tensão dada por
e AB = e AC + e CB
5.2.9
Termopares mais usuais e suas características
Vários tipos de pares termoeléctricos foram estudados e, de acordo com a
aplicação, alguns foram normalizados. Os tipos mais comuns de termopares são
identificados através de letras (T, J, K, E, N, R, S, B), originalmente atribuídas pela
Instrument Society of America (ISA). A aplicação de cada um deles depende de vários
factores, sendo a atmosfera (ambiente) e a gama de temperatura, os principais. As
características de cada um deles são:
• O tipo T (Cu-Cu45%Ni) (Cobre-Constantan) é resistente à corrosão em ambientes
húmidos e é excelente para aplicações em temperaturas abaixo de 0°C. O seu limite
superior de temperatura é de 400°C e pode ser usado em vácuo ou atmosferas oxidante,
redutora ou inerte.
• O tipo J (Fe-Cu45%Ni) (Ferro-Constantan) é apropriado para uso em vácuo ou
atmosferas oxidante, redutora ou inerte até 760°C. A taxa de oxidação do termoelemento
Fe é alta acima de 530°C, portanto o uso de fios de maiores diâmetros é recomendado se
houver necessidade de uso prolongado em alta temperatura. Termopares tipo J de fio nu
não devem ser usados em ambientes sulfurosos acima de 530°C. Pode ser usado em
temperaturas abaixo de 0°C, mas a possibilidade de oxidação do fio de Fe sob essas
condições torna o seu uso menos interessante que o do tipo T em baixas temperaturas.
• O tipo K (Ni10%Cr-Ni5%Al,Si) (Cromel-Alumel) é recomendado para uso
contínuo em atmosferas oxidante e inerte até 1372°C. Em virtude da sua característica de
resistência à oxidação ser superior à dos outros termopares básicos, ele tem grande
aplicação em temperaturas acima de 530°C. O tipo K também pode ser usado em
temperatura negativa até -270°C, mas não pode ser aplicado em: a) atmosferas redutoras
ou que estejam alternando entre redução e oxidação, sem um tubo de protecção
apropriado; b) atmosferas sulfurosas, sem um tubo de protecção adequado; c) vácuo,
excepto por curto período de tempo, pois a vaporização preferencial do crómio irá alterar
a calibração; d) atmosferas que promovem a deterioração esverdeada do termoelemento
111
Temperatura e sua medição
positivo. Essa corrosão ocorre devido à oxidação preferencial do crómio quando o
ambiente em torno do termopar tem baixa percentagem de oxigénio numa determinada
gama de temperatura. Normalmente é notada quando o termopar é usado em tubo de
protecção longo e de diâmetro reduzido.
• O tipo E (Ni10%Cr-Cu45%Ni) (Cromel-Constantan) é recomendado para
aplicações e uso na gama de -250°C a 870°C em atmosferas oxidante ou inerte. Em
atmosfera redutora, alternando-se entre redutora e oxidante, pouco oxidante ou vácuo, o
tipo E está sujeito às mesmas limitações do tipo K.
• O tipo N (Ni14%Cr1,5%Si-Ni4,5%Si0,1%Mg) (Nicrosil-Nisil) foi construído
como uma alternativa ao tipo K e sua gama de operação está entre –270°C e 1300°C. Em
comparação com o tipo K, possui uma menor potência termoeléctrica, um coeficiente de
Seebeck bastante semelhante, porém uma maior estabilidade no tempo durante do seu
uso. Assim como o tipo K, não deve ser usado em vácuo.
• O tipo R (Pt13%Rh-Pt) (Platina, Ródio-Platina) e o tipo S (Pt10%Rh-Pt) (PlatinaRhodio) são recomendados para aplicações de uso contínuo em ambientes oxidante e
inerte, numa gama de temperatura de –50°C a 1768°C. Não devem ser usados em
atmosferas redutoras ou que contenham vapores metálicos ou não metálicos, a menos que
seja utilizado um tubo de protecção não metálico. Podem ser usados em vácuo por curto
período de tempo. O seu uso contínuo em alta temperatura provoca um excessivo
crescimento de grãos, que pode resultar na quebra do elemento platina.
• O tipo B (Pt30%Rh-Pt6%Rh) (Platina-Ródio) é recomendado para uso contínuo
em atmosferas oxidante e inerte em temperaturas até 1820°C. Pode ser usado em vácuo,
por curto período de tempo em alta temperatura, mas, assim como os tipos R e S, não
deve ser aplicado em atmosferas redutoras ou que contenham vapores metálicos ou não
metálicos, a menos que seja utilizado um tubo de protecção não metálico. Se for usado
um tubo de protecção metálico, esse termopar não deve ser inserido directamente nele.
Quando em alta temperatura, o tipo B apresenta menor crescimento de grãos que os tipos
R e S.
Dos termopares acima, os que são formados por platina, são conhecidos como
termopares nobres (R, S e B) e os demais são chamados de termopares básicos ou
termopares de metal comum. Outros tipos de termopares foram criados para aplicações
específicas, sendo chamados termopares especiais e não receberam denominação por
letras.
112
5 Tipos mais usuais de termómetros e sua aplicação
Um termopar é calibrado medindo a fem na junção de teste a várias temperaturas,
mantendo a junção de referência a 0 ºC. Os resultados de tais medições podem,
usualmente, ser representados por uma equação cúbica,
e (q ) = c0 + c1 q + c2 q 2 + c3 q 3
(5.12)
onde e é a f.e.m. térmica, e c0 , c1 , c2 , e c3 constantes (diferentes para cada termopar).
Sensibilidade
A sensibilidade de um termopar é dada por
ST =
de
dT
(5.13)
O índice T em ST indica que a sensibilidade, que é função da temperatura, é
referida à temperatura T . A Tabela 5.1 indica a sensibilidade de alguns materiais quando
usados com a platina, para uma temperatura de junção de 0 ºC. Note-se que existe uma
grande variação nas sensibilidades, consoante os materiais. Repare-se que as
sensibilidades são baixas, da ordem dos μV/ ºC. Observe-se ainda que para os
semicondutores (quatro últimos materiais da tabela) as sensibilidades são bastante
superiores às dos metais. Para que a sensibilidade de um termopar seja elevada, convirá
associar materiais com sensibilidades altas em relação à platina (em módulo), e de sinais
contrários. No entanto, para a construção de termopares há outros critérios a ter em
consideração. Assim, o par Bismuto/Cromel, que tem uma sensibilidade, a 0 ºC, de
72+25,8 = 97,8 μV/ºC, não se utiliza devido ao facto do Bismuto ser muito quebradiço e
ter um ponto de fusão baixo (271 ºC).
Dentro da gama de temperaturas desejadas, a selecção dos materiais a utilizar na
construção de um termopar deve ter em conta os seguintes critérios: sensibilidade
elevada, linearidade alta, estabilidade alta e custo baixo.
Para se aumentar a sensibilidade dos termopares, estes podem ser associados em
série, desde que se garanta a existência de N junções à temperatura de medida e outras
N + 1 à temperatura de referência.
Os termopares são utilizados em vários sectores da indústria (química,
petroquímica, farmacêutica, da energia eléctrica, de produtos alimentares e bebidas,
mineira, metalúrgica, siderúrgica, cerâmica, vidro, entre outros). São utilizados também
113
Temperatura e sua medição
na Engenharia Mecânica, em diversos equipamentos laboratoriais e em muitos outros
equipamentos.
Material
Bismuto
Constantan
Níquel
Alumel
Nisil
Platina
Mercúrio
Carbono
Alumínio
Estanho
Prata
Tabela 5.1
Sensibilidade
µV/ºC
-72
-35
-15
-13,6
-10,7
0
+ 0,6
+3
+ 3,5
+4
+ 6,5
Material
Cobre
Ouro
Tungsténio
Nicrosil
Ferro
Cromel
Germânio
Silício
Telúrio
Selénio
Sensibilidade
µV/ºC
+ 6,5
+ 6,5
+ 7,5
+ 15,4
+ 18,5
+ 25,8
+ 300
+ 440
+ 500
+ 900
Sensibilidade de alguns termopares à temperatura de referência
0 ºC, quando usados com a platina.
5.3 Termómetro de resistência
Termo-resistências ou termómetros de resistência, são nomes genéricos para
sensores que variam a resistência eléctrica com a temperatura. Os materiais utilizados
como elemento
sensor
destes
termómetros são, normalmente, condutores e
semicondutores. Os metais condutores apareceram primeiro, e historicamente são os que,
em sentido estrito, são designados por termómetros de resistência ou termo-resistências.
Os semicondutores são mais recentes e chamam-se de termístores. A diferença
básica é a forma da variação da resistência eléctrica com a temperatura. Nos metais a
resistência aumenta quase linearmente com a temperatura enquanto nos semicondutores
ela varia de maneira não linear de forma positiva ou negativa (ver Figura 5.13). A
variação da resistência eléctrica em função da temperatura (dR dT ) é designada por
coeficiente de temperatura. O seu valor também é uma função da temperatura.
114
5 Tipos mais usuais de termómetros e sua aplicação
R/ W
600
Semicondutor
Ni
500
W
400
Cu
300
Pt
200
R (0 ºC) = 100 W
100
0
–100
100
300
500
700
T / ºC
Figura 5.13 Gráfico ilustrativo da variação da resistência com a temperatura
para alguns metais e para um semicondutor.
5.3.1
Termo-resistências metálicas
5.3.1.1 Constituição
Uma termo-resistência é constituída por um núcleo de cerâmica, de vidro ou de
outro material isolante em volta do qual se encontra depositada ou enrolada a resistência,
que, de acordo com a aplicação, pode ser constituída por um fio ou por um filme
metálico (para dimensões mais reduzidas e valores de resistência mais elevados).
Externamente, existe um revestimento com vista a proteger a resistência de cargas
mecânicas (pressão, fluidos) e da corrosão química (ver Figuras 5.14, 5.15 e 5.16).
Figura 5.14 Interior de uma termo-resistencia.
Figura 5.15 Aspecto exterior de uma termo-resistência.
115
Temperatura e sua medição
Figura 5.16 Algumas termo-resistências.
5.3.1.2 Campos de aplicação
Os termómetros de resistência são aplicados na gama de temperatura de -220 ºC a
+600 ºC . As suas vantagens são inúmeras, das quais destacamos as seguintes: elevada
banda dinâmica de medida, resistência mecânica à vibração, elevada imunidade às
interferências eléctricas, estabilidade duradoura, elevada robustez, e elevada exactidão.
Estes termómetros são muito utilizados na indústria, nomeadamente, química,
petroquímica, farmacêutica, energia eléctrica, mecânica, de produtos alimentares e
bebidas, entre outras. São ainda utilizadas em laboratórios como padrões de temperatura.
5.3.1.3 Princípio de funcionamento
Em 1821 Sir Humphrey Davy descobriu que a resistividade dos metais apresentava
uma forte dependência da temperatura. Sir William Siemens propôs, por volta de 1861, o
uso de termómetros de resistência de platina com os quais a medição da temperatura seria
feita à custa da variação da resistência eléctrica de um fio de platina (Güths, 1998).
Actualmente, a medição de temperaturas por meio de termómetros de platina
assume grande importância em numerosos processos de controlo industrial; são também
usados termómetros de platina de construção especial como instrumentos metrológicos
de interpolação das escalas internacionais de temperatura, a nível primário. O termómetro
de resistência feito de platina opera na gama de temperatura de -253ºC a +1200 ºC .
O termómetro de resistência metálico possui como propriedade termométrica a
resistência eléctrica que pode ser dada por uma função cúbica da temperatura, obtida por
calibração, e dada por (norma CEI 751)
116
5 Tipos mais usuais de termómetros e sua aplicação
Rq = R0 ÈÎ1 + Aq + B q 2 + C q 2 (q - 100)˘˚
(5.14)
onde R0 é a resistência à temperatura de referência, A, B e C são constantes (ver
secção 6.1) e q é a temperatura empírica. Para valores positivos da temperatura é
suficiente uma aproximação quadrática, pelo que se toma C = 0 , obtendo-se
Rq = R0 ÈÎ1 + Aq + B q 2 ˘˚
(5.15)
A sensibilidade ( S ) de uma termo-resistência é a variação relativa da resistência
por unidade de variação de temperatura:
S=
( DR R )
(5.16)
DT
A sensibilidade é função da temperatura e a expressão anterior é definida
pontualmente para cada temperatura por
S=
1 dR
R dT
(5.17)
Na Tabela 5.2 estão indicadas algumas características para 4 termo-resistencias à
temperatura de 0 ºC.
Níquel
Cobre
Platina
Tungsténio
Gama de medida em (ºC)
-100 ; 500
-100 ; 450
-260 ; 800
-70 ; 2700
Resistividade (W m )
5,91 ¥ 10-8
1,529 ¥ 10-8
9,81 ¥ 10-8
4,99 ¥ 10-8
Linearidade
baixa
alta
alta
média
0,0067
0,0042
0,003925
0,0045
( )
Sensibilidade a 0ºC K -1
Tabela 5.2
Algumas características para 4 termo-resistências, à temperatura
de 0 ºC.
117
Temperatura e sua medição
5.3.1.4 Métodos de medição
Para se poder ler, ou para transmitir à distância do valor da temperatura obtido na
utilização de uma termo-resistência, é necessário transformar o valor de R ou o de ΔR
numa corrente eléctrica, ou numa tensão eléctrica. Para este efeito utiliza-se um
condicionador de sinal.
Descrevem-se a seguir alguns dos condicionadores de sinal mais utilizados com as
termo-resistências, baseados no uso de uma fonte de corrente e na ponte de Wheatstone.
•
Fonte de corrente
Este método exige uma fonte de corrente constante, e pode ter duas configurações
fundamentais: medição a dois fios, e a quatro fios22.
Medição a dois fios
Conhecendo o valor da intensidade da corrente que atravessa a termo-resistência, o
valor da sua resistência é obtido a partir da medida da queda de tensão, tal como indica a
Figura 5.17.
Rfio
IV ª 0
I
Fonte de
corrente
Termo-resistência
V
Rfio
Figura 5.17 Método de medição a dois fios.
No método de medição a dois fios o sinal é influenciado pela resistência eléctrica
dos fios de ligação, e por variações desta, especialmente se estes forem longos e
estiverem sujeitos a variações de temperatura. A influência das resistências dos fios pode
ser compensada por uma resistência de compensação, sendo este o procedimento seguido
em instrumentação de regulação onde se exige relativa precisão de controlo.
22
Por vezes são utilizadas resistências com três fios. Em alguns casos, como na medição por ponte
de Wheatstone, isto trás vantagens evidentes sobre a montagem com dois fios, noutras situações
aparece como compromisso entre a montagem com dois fios e quatro fios.
118
5 Tipos mais usuais de termómetros e sua aplicação
Medição a quatro fios
Na medição a quatro fios, ilustrada na Figura 5.18, a intensidade de corrente que
atravessa a termo-resistência é, também, constante e a queda de tensão é medida junto
dos seus extremos. Como a corrente que circula pelo voltímetro é praticamente nula,
pode-se considerar a queda de tensão nos fios de ligação nula, eliminando assim a
influência da resistência e da variação de temperatura dos fios de ligação. A desvantagem
deste método é a necessidade de o cabo conter quatro fios, aumentando o custo.
Rfio
I V ª 0 Rfio
I
Fonte de
corrente
V
Rfio
Termo-resistência
Rfio
Figura 5.18 Método de medição a quatro fios.
O auto-aquecimento é o problema mais grave das termo-resistências. A circulação
de uma corrente eléctrica pela resistência causa, por efeito Joule, um aumento da sua
temperatura, originando um erro de medição. O erro torna-se crítico quando se fazem
medições em gases, a baixas velocidades, podendo chegar a 2 ºC.
A forma de minimizar esse fenómeno é alimentar o sistema com corrente pulsada,
conforme se mostra na Figura 5.19. Como consequência essa forma de resolver o
Corrente
problema necessita de um circuito electrónico mais sofisticado (Güths, 1988).
a)
0,2 ms
Tempo
Tensão
6 ms
b)
Tempo
Figura 5.19 Minimização do efeito de auto-aquecimento usando uma corrente
pulsada: a) corrente injectada; b) sinal em tensão detectado.
119
Temperatura e sua medição
•
Ponte de Wheatstone
A Ponte de Wheatstone é uma técnica muito utilizada pois necessita apenas de uma
fonte de tensão, que é mais simples que uma fonte de corrente. Consideremos o caso da
ligação em três pontos, conforme se ilustra na Figura 5.20. O efeito da variação da
resistência do cabo pode ser minimizado, com o custo do cabo adicional B.
A tensão de saída, V , da ponte depende da relação entres os valores das
resistências e da tensão de alimentação, e , e é dada por
Ê
ˆ
1
1
V =e Á
Ë 1 + R1 R2 1 + R3 R ¯˜
(5.18)
Da expressão anterior podemos escrever
R=
R3 - ( R3V e ) (1 + R1 R2 )
(5.19)
R1 R2 + (V e ) (1 + R1 R2 )
R1
e
R3
V
Fonte de
tensão
B
A
R
R2
C
Termo-resistência
Figura 5.20 Ponte de Wheatstone com resistência de três fios.
5.3.2
Termístores
5.3.2.1 Constituição
Como já foi dito os termístores são resistências sensíveis à temperatura, construídas
em material semicondutor. Como material semicondutor utilizam-se os óxidos de níquel,
de cobalto e de manganês, e sulfatos de ferro, de alumínio e de cobre, e ainda, para
aumentar a estabilidade, misturas de outros óxidos.
120
5 Tipos mais usuais de termómetros e sua aplicação
Os primeiros termístores foram feitos de óxido de manganês, níquel e cobalto,
moídos e misturados em proporções apropriadas e prensados.
Figura 5.21 Exemplos de termístores.
5.3.2.2 Características
Existem basicamente dois tipos de termístores, os NTC (do inglês Negative
Temperature Coefficient), termístores cujo coeficiente de variação de resistência com a
temperatura é negativo: a resistência diminui com o aumento da temperatura de forma
exponencial. Os PTC (do inglês Positive Temperature Coefficient) são termístores cujo
coeficiente de variação de resistência com a temperatura é positivo: a resistência aumenta
com o aumento da temperatura.
A gama de medida de um termístor é mais reduzida do que a de uma termoresistência ( -100 ºC a 300 ºC). Para um termístor a variação da resistência com a
temperatura é elevada, sendo a sua relação não linear.
A resistência em função da temperatura para um termístor NTC é dada por:
R = R0 e
Ê1 1ˆ
Ë T T0 ˜¯
bÁ -
(5.20)
onde : R - resistência do termístor à temperatura absoluta T ( W ),
R0 - resistência do termístor à temperatura de referência T0 ( W ),
T e T0 - temperaturas absolutas ( K ),
b - parâmetro característico do termístor, dependente da sua composição ( K ).
O parâmetro b toma valores compreendidos entre 3000 K e 5000 K. Para gamas
de funcionamento restritas pode considerar-se constante. A temperatura de referência,
T0 , é geralmente tomada a 298 K ( 25 ºC ).
121
Temperatura e sua medição
Uma aplicação corrente a nível industrial é a medição de temperatura (em motores,
por exemplo), pois podemos com o termístor obter uma variação da sua resistência
eléctrica em função da temperatura a que este se encontra.
Os termístores PTC são muito não-lineares e são usados apenas para protecção
contra sobreaquecimento, limitando a corrente eléctrica quando determinada temperatura
é ultrapassada.
A sensibilidade de um termístor é definida pela relação ente a variação relativa da
resistência e a correspondente variação de temperatura que lhe deu origem.
S=
1 dR
R dT
(5.21)
Efectuando este cálculo usando para R (T ) a função dada por (5.20) obtém-se
S=-
b
(5.22)
T2
A título de exemplo, para um termístor com β = 4000 K e para T = 300 K (~26 ºC)
a sensibilidade tem o valor - 0, 044 K -1 . Comparando este valor com a sensibilidade da
termo-resistência de platina constata-se que a sensibilidade de um termístor é, em valor
absoluto, cerca de 10 vezes maior do que a sensibilidade da termo-resistência. As
elevadas sensibilidades dos termístores permitem a detecção de variações de temperatura
da ordem de 0,0005 K.
A sensibilidade varia com a temperatura o que constitui um problema, para o
resolver associa-se uma associação de resistências em paralelo, o que lineariza a variação
da resistência com a temperatura.
5.4 Termómetros de pressão de gás
Fisicamente idêntico ao termómetro de dilatação de líquido. Contudo, neste
termómetro, o volume do conjunto é constante e preenchido com um gás. A variação de
temperatura implica uma variação de pressão de acordo com a lei dos gases ideais (ver
secção 4.3.2). Este termómetro, pelas suas características, não é usado no dia-a-dia.
122
5 Tipos mais usuais de termómetros e sua aplicação
5.5 Termómetro de radiação infravermelha e visível
Pirómetros são sensores de temperatura que utilizam a radiação térmica emitida por
um corpo cuja temperatura se quer medir, não necessitam de estar em contacto físico com
o corpo emissor, não interferindo, portanto com o meio e desse modo evitando
transferências de energia na medição de temperatura, obtendo-se a temperatura real.
Estes termómetros apresentam ainda as vantagens de não ser necessário esperar que
se atinja o equilíbrio térmico entre o corpo e o termómetro, suporta medições de
temperatura elevada, pode medir a temperatura de materiais corrosivos, bem como medir
a temperatura de um sistema móvel, visto que o pirómetro não está acoplado ao corpo.
Um outro sensor de temperatura que também utiliza a radiação térmica emitida por
um corpo cuja temperatura se quer medir é a termopilha.
5.5.1
Termopilha
Uma termopilha consiste em vários elementos térmicos (termopares) colocados em
série como ilustrado na Figura 5.22.
Abertura
e
Bismuto
Prata
Figura 5.22 Esquema de uma termopilha.
Numa termopilha há dois lugares característicos onde são colocadas as junções dos
elementos, sendo que um é chamado de lugar das junções quentes e o outro de lugar das
junções frias. As junções quentes da termopilha estão no centro do transdutor abaixo de
uma membrana que irá receber a radiação. As junções frias vão estar protegidas da
radiação presas a um substrato que será utilizado como massa térmica.
123
Temperatura e sua medição
5.5.2
Pirómetro
Os pirómetros podem ser divididos em duas classes distintas: os pirómetros de
banda larga e os pirómetros de banda estreita. Os pirómetros de banda larga baseiam-se
na lei de Stefan-Boltzmann, que relaciona a potencia total irradiada por um corpo, P ,
com a temperatura absoluta a que ele se encontra, T , a área da superfície de emissora,
A , e a sua emissividade, e . Como vimos no Capítulo 3, esta lei expressa-se por
P = e s AT 4 , onde s é a constante universal de Stefan-Boltmann, cujo valor é
s = 5, 6704 ¥ 10 -8 W m -2 K -4 . Pode portanto fazer-se medições de temperatura a partir
de medições de energia emitida pelo corpo.
Os pirómetros são calibrados em relação a um corpo negro, onde a energia
irradiada é máxima ( e = 1 ). Quando a medição é realizada num corpo com emissividade
diferente da do corpo negro deve-se empregar um factor de correcção. Para isso deve-se
conhecer a emissividade do corpo cuja temperatura se quer medir, o que é um factor de
incerteza visto que depende por exemplo do estado da superfície e da temperatura entre
outros. Outro factor de incerteza diz respeito à influência dos corpos vizinhos, a radiação
emitida por um corpo vizinho pode vir a ser reflectida na superfície do corpo cuja
temperatura queremos medir e atingir o sensor, influenciando o resultado.
A Figura 5.23 refere-se à patente do primeiro pirómetro de banda estreita, atribuída
a Samuel Morse em 1899 (www.zytemp.com).
Figura 5.23 Ilustração do primeiro pirómetro patenteado.
124
5 Tipos mais usuais de termómetros e sua aplicação
5.5.2.1 Pirómetros ópticos (Banda estreita)
O pirómetro de banda estreita clássico é o chamado pirómetro óptico, ilustrado
esquematicamente na Figura 5.24 A, e é usado para medir temperaturas de 700 ºC a
4000 ºC, onde parte significativa da energia é radiada na zona visível do espectro
electromagnético. Usa um método comparativo. A energia emitida pelo corpo incide
numa lente objectiva e é focada no filamento de uma lâmpada de incandescência. Se a
temperatura do corpo exceder os 1300 ºC, é usado um filtro de absorção entre a lente
objectiva e a lâmpada. A energia radiante que provem do corpo e do filamento da
lâmpada passa por um filtro vermelho com uma frequência de corte de cerca de
470 ¥ 1012 Hz . A radiação transmitida através do filtro é captada por outra lente objectiva
e focada para ser vista pelo observador através de uma lente ocular (Fialho, 2007).
A
B
Figura 5.24 A – Esquema de um pirómetro óptico. B – Observação.
Se a corrente da lâmpada estiver desligada, o observador vai ver um filamento
negro num plano de fundo de cor clara. Ao aumentar a corrente da lâmpada, chega-se a
um ponto em que há a sensação de que o filamento desaparece, já que a radiação por ele
emitida na frequência do filtro vermelho tem a mesma intensidade da radiação emitida
pelo corpo. Ao aumentar ainda mais a corrente da lâmpada o filamento começa a adquirir
uma cor mais clara sobre um plano de fundo de cor mais escura, tal como mostra a
Figura 5.24 B.
Na condição em que o filamento deixa de ser visível, a corrente requerida para
produzir o seu brilho é medida e usada para estabelecer a temperatura do corpo quente.
125
Temperatura e sua medição
Os principais problemas deste pirómetro são:
- Só funciona para temperaturas em que o corpo emite radiação considerável no
espectro visível.
- Só mede correctamente a temperatura de corpos negros, isto é, corpos cuja
superfície tenha emissividade igual a 1. Para todos os outros o aparelho necessita de
calibração. Como é sabido, a radiação emitida por um corpo é menor do que a que emite
um corpo negro à mesma temperatura.
Se for conhecida a energia radiada por um corpo e o valor da emissividade da sua
superfície, pode-se calcular a energia radiada por um corpo negro à mesma temperatura e
no mesmo comprimento de onda. Depois basta usar a lei de Planck que relaciona a
energia emitida por um corpo negro com o comprimento de onda e com a temperatura.
Caso não seja conhecida a emissividade da superfície do corpo, podem ser usados
alguns “truques” para se chegar ao valor da temperatura: Uma porção do corpo pode ser
pintada de negro ou coberta por uma cerâmica negra para que a sua emissividade seja
próxima de 1. Para temperaturas muito altas, em que não é possível pintar a superfície,
pode ser feito um furo com uma relação profundidade/diâmetro de seis ou mais. Este furo
liga o interior de uma cavidade com o exterior, portanto actua como corpo negro e se o
pirómetro óptico for focado no seu interior, a temperatura do corpo pode ser medida com
grande precisão.
Para resolver o problema da dependência da medição de temperatura de um corpo
com a sua emissividade, o pirómetro pode ser concebido como se ilustra na Figura 5.25.
Neste aparelho existem dois sensores que recebem radiação de diferentes
comprimentos de onda (de cor diferente, portanto). A radiação proveniente do corpo é
focada por uma lente objectiva, sendo depois dividida para os dois sensores por um
divisor de feixe dicróico. Este divisor de feixe (espelho quente/frio) reflecte/transmite a
radiação de comprimento de onda maior e transmite/reflecte a radiação de comprimento
de onda menor.
Sensor 2
Corpo
Lente
Sensor 1
Divisor de feixe
Figura 5.25 Esquema de um pirómetro independente da emissividade.
126
5 Tipos mais usuais de termómetros e sua aplicação
Supondo que o valor da emissividade do corpo é o mesmo para os dois
comprimentos de onda, o gráfico da radiância espectral do corpo negro (Figura 3.17),
mostra que os valores lidos pelos dois sensores vão ser os do gráfico multiplicados por
uma constante menor do que um (emissividade). A partir deste princípio, pelo valor
relativo medido pelos dois sensores é possível calcular a temperatura do corpo. Assim,
em termos qualitativos, olhando para a Figura 5.26 caso o valor medido pelo sensor 1
seja maior do que o valor medido pelo sensor 2, então a temperatura é baixa. Se a medida
dos dois sensores for igual, então a temperatura é média. Se a medida do sensor 2 for
maior do que a do sensor 1 então a temperatura é alta.
Sensor 1
Sensor 2
Figura 5.26 Frequências utilizadas pelo pirómetro de duas cores.
De certo modo, o efeito da emissividade é compensado, não totalmente já que,
como foi visto antes, a emissividade não é rigorosamente constante, mas dependente do
comprimento de onda.
A principal diferença em relação ao pirómetro clássico é que este usa, em vez do
valor absoluto da energia absorvida pelo sensor, a razão entre as energias recebidas pelos
dois sensores a comprimentos de onda diferentes.
5.5.2.2 Pirómetro de infravermelhos (Banda larga)
Para temperaturas abaixo dos 700 ºC, as radiações emitidas pelo corpo estão
concentradas na região do infravermelho e não são visíveis para o olho humano, não
sendo por isso possível usar o pirómetro óptico. Então neste caso usa-se o pirómetro de
127
Temperatura e sua medição
infravermelhos, que usa um sensor que mede a intensidade da radiação proveniente do
corpo.
A Figura 5.27 mostra o esquema de um pirómetro de infravermelhos. Uma lente
capta a radiação infravermelha emitida pela superfície incluída na sua área de focagem.
A radiação é depois reflectida pelo espelho parabólico e focada no sensor. Como sensor
pode ser usado uma termopilha, uma resistência de platina ou um sensor de efeito
fotoeléctrico. A tensão de saída do sensor é uma medida directa da radiação absorvida
por ele. Se se conhecer a quantidade de radiação absorvida pelo sensor, usando a lei de
Planck, pode-se calcular a temperatura da superfície do corpo.
Figura 5.27 Pirómetro de radiação infravermelha.
Para este pirómetro, as dimensões do corpo e a distância deste à lente são críticos.
O campo de visão do pirómetro de infravermelhos depende da distância focal e do
diâmetro da lente. O sistema óptico do aparelho capta toda a radiação proveniente dos
objectos que estão no seu campo de visão, e a medida dada por ele representa a média
das temperaturas desses mesmos objectos.
A maioria dos pirómetros tem uma lente de distância focal fixa que define o seu
campo de visão. Este campo de visão é expresso normalmente em termos de uma relação
d D em que d representa a distância da lente ao objecto e D o diâmetro do campo de
visão na posição d.
Os pirómetros de infravermelhos de uso geral usam lentes com distâncias focais
entre 0,5 m e 1,5 m. Também existem os instrumentos de foco curto que usam lentes com
distâncias focais entre 10 mm e 100 mm e os de foco longo que usam lentes com
distâncias focais de 10 m ou mais.
128
5 Tipos mais usuais de termómetros e sua aplicação
Outro problema do pirómetro de infravermelhos é que, tal como o pirómetro
óptico, a sua medida depende da emissividade da superfície do corpo sobre o qual a
temperatura é medida. Como as superfícies têm emissividade menor do que um, a
radiação emitida por elas é menor do que a prevista na lei de Planck e o instrumento vai
dar uma leitura menor do que a temperatura real da superfície. Os fabricantes deste tipo
de instrumentos corrigem o erro da emissividade instalando-lhes um compensador de
emissividade. O compensador de emissividade não é mais do que um ajuste de ganho do
amplificador que amplifica o sinal do sensor.
Este ajuste de ganho também pode ser usado para compensar perdas na transmissão
quando a radiação tem que atravessar vidros, plásticos, fumos, poeiras, vapores, etc.
Como alternativa ao compensador de emissividade, também se utiliza a divisão do
feixe em dois comprimentos de onda.
Tipicamente, estes aparelhos cobrem a gama de temperaturas de -20 ºC a 1000 ºC,
a sua emissividade pode ser ajustada de 0,1 a 1 e conseguem ler até dez temperaturas por
segundo, no caso de o sensor ser do tipo termopilha (que é o mais comum).
O detector de radiação deve ser mantido a uma temperatura muito baixa, para que a
intensidade de radiação absorvida seja maior. Em casos especiais é necessário arrefecer o
detector com azoto líquido.
A Figura 5.28 mostra exemplos de alguns pirómetros comerciais de radiação
infravermelha.
Figura 5.28 Exemplos de pirómetros de radiação infravermelha.
5.6 Outros termómetros e algumas curiosidades
A temperatura relaciona-se com infindáveis fenómenos físicos que permitem
construir os mais variados termómetros, alguns deles constituem apenas curiosidades,
outros tem mesmo aplicações práticas no sentido de tornar a vida do dia-a-dia mais
expedita a ponto de o utilizador não se aperceber dos fenómenos e princípios subjacentes
pois a medição de temperatura torna-se algo bastante difundido.
129
Temperatura e sua medição
Esta diversidade poderia constituir um estudo bastante alargado. Contudo apenas se
apresentam algumas formas de medir temperatura que não foram estudadas em detalhe e
que, pelos seus campos de aplicação, têm muita importância em diversas áreas.
Apresentam-se igualmente algumas curiosidades relacionadas com a medição de
temperatura.
5.6.1
Termómetros baseados em cristais líquidos
Os cristais líquidos proporcionam a criação de termómetros de fácil utilização
que se adaptam à medição de temperatura nas mais diversas situações do dia-a-dia
tornando-se não só práticos como lúdicos, sendo também atracções comerciais. São as
propriedades na sua fase colestérica que permitem o seu uso como termómetros. Nestes
cristais líquidos as moléculas estão dispostas em hélice (Figura 5.29) e a cor destes
depende de quão apertada ela está. A hélice fica mais apertada à medida que a
temperatura aumenta (Bechtold, 2005; Martins, 1991).
Figura 5.29 Moléculas de cristais líquidos dispostas em hélice.
Figura 5.30 Anéis de humor feitos de cristais líquidos.
As tiras da figura seguinte são fabricadas com cristal líquido que, calibrado a
diferentes temperaturas e impresso sobre papel auto-adesivo actua como um termómetro
convencional, a temperatura a medir aparece sobre tom verde sobre um fundo negro.
130
5 Tipos mais usuais de termómetros e sua aplicação
Figura 5.31 Tiras termométricas de cristais líquidos.
Em alguns utensílios de cozinha, como frigideiras e panelas incorporam um
indicador de temperatura sob a forma de um círculo que muda de cor indicando a
temperatura adequada de utilização.
As tintas termo-sensíveis têm também várias aplicações
termométricas sendo a sua principal característica a mudança de
cor quando sujeitas a variações de temperatura. Por exemplo,
são usadas em dispositivos de segurança (indicadores de
elevada temperatura), nas notas da lotaria, em artigos variados
comerciais, entre outros.
5.6.2
Termómetros baseados em díodos
A introdução de componentes electrónicos
permite concentrar o dispositivo sensor e a
electrónica de processamento num único circuito
integrado, possibilitando termómetros electrónicos
de baixo custo. São exemplos os integrados LM35 (10 mV K ) e 590 KH (1μA K ) . De
entre os dispositivos sensores salienta-se os díodos que são elementos semicondutores
cujas características eléctricas dependem da temperatura, permitindo assim o seu uso
como sensor.
131
Temperatura e sua medição
A variação da corrente do díodo semicondutor com a tensão aos seus terminais tem
uma forma aproximadamente exponencial: em boa aproximação a corrente I é dada por:
(
)
I = I s eV VT - 1 com VT = h k T q
(5.23)
onde k é a constante de Boltzmann, T a temperatura absoluta, q a carga do electrão, V a
tensão aos terminais do díodo, e h o factor de idealidade. I s é designada por corrente de
saturação (corrente máxima com polarização inversa). À temperatura ambiente (300 K)
VT ª 25 mV (w3.ualg.pt/~jmariano/introelec/iae_diodos.pdf).
Para utilização como termómetros, os díodos são polarizados directamente com
uma corrente constante, tipicamente da ordem de 10μA , sendo a queda de tensão nos
Tensão / V
seus terminais função da temperatura, aumentando quando a temperatura baixa.
Temperatura / K
Figura 5.32 Tensão eléctrica nos terminais de um díodo de Silício polarizado
directamente com uma corrente de 10 μA em função da
temperatura (www.lakeshore.com/temp/sen/sd670_po.html).
Para utilização a baixas temperaturas na presença de campos magnéticos, surgiu
recentemente (www.lakeshore.com/temp/sen/sd670_po.html) uma alternativa aos díodos
através de termómetros baseados na resistência de cerâmicas especiais, como por
exemplo a CernoxTM.
132
5 Tipos mais usuais de termómetros e sua aplicação
5.6.3
Termómetro decorativo de Galileu
Outro termómetro interessante é o termómetro chamado de
Galileu, como se mostra na Figura ao lado. Tal termómetro consiste
num tubo de vidro selado, preenchido com água e várias bolhas
flutuantes. As bolhas são esferas de vidro onde se colocou uma
certa quantidade de uma mistura líquida colorida. A cada bolha foi
adicionado uma pequena etiqueta de metal onde está gravado um
número correspondente a uma temperatura. Essas etiquetas são
massas calibradas para que a densidade média das bolhas mais
massas difira ligeiramente uma das outras, sendo a densidade de
todas elas próxima da da água onde estão inseridas.
O princípio de funcionamento é o princípio de Arquimedes,
em que o sistema, bolha e massa marcada, está sujeito à acção de
duas forças: o peso e a impulsão da água. Variando a temperatura
da água dentro do termómetro varia a sua densidade, sendo esta a propriedade
termométrica. Assim cada sistema (bolha e massa marcada que lhe está associada) vai
ocupar níveis diferentes no seio da água. O sistema que estiver a um nível inferior
relativo indica a temperatura aproximada (http://ciencia.hsw.uol.com.br/questao663.htm).
5.6.4
Inferência de temperaturas atmosféricas passadas
Ilha Signy
Num tempo de alterações climáticas, há certos fenómenos geofísicos que nos
indicam as variações de temperatura que estão a ocorrer a nível global. A título de
exemplo, a Ilha Signy, próxima à Antártida, está a ser considerada um termómetro das
mudanças ambientais. As mudanças do clima são percebidas pelo derreter da fina calote
de gelo dos lagos. Nos últimos 20 anos, a temperatura média subiu 1,8 ºC.
Uvas pinot noir
Um outro caso interessante é a determinação indirecta da
temperatura usando o ciclo de vida das uvas pinot noir, constituindo
um termómetro para determinar as mudanças climáticas entre o fim
da Idade Média e o presente (Chuine et al, 2004). Foi possível
determinar como foi o verão em, por exemplo, 1500 sem dispor de
medidas directas das temperaturas da época.
133
Temperatura e sua medição
As uvas pinot noir são plantadas na região de Borgonha, na França, desde a Idade
Média e a data exacta do início de sua colheita tem sido registada fielmente nas
municipalidades e igrejas. Em cada ano a colheita era determinada por decreto, de modo
a garantir que as uvas fossem colhidas apenas quando estavam prontas para a produção
de vinho. Usando as datas de início de colheita, os cientistas determinaram a temperatura
média dos verões entre 1370 e 2003. Para isso tiveram que entender a relação entre a
velocidade de amadurecimento das uvas e a temperatura. Usaram as temperaturas
fornecidas pelo serviço de meteorologia entre 1964 e 2001, correlacionando-as com as
datas em que a pinot noir floresce, amadurece e finalmente é colhida. Com os dados
recolhidos construíram uma equação que relaciona a temperatura média da primavera e
do verão com a data do início da colheita. Utilizando-a juntamente com a data da colheita
das uvas calculam a temperatura média de cada verão.
Anéis de árvores
Muitas árvores produzem um anel por
ano, devido ao rápido crescimento na Primavera
e no Verão e ao pouco crescimento no Outono e
no Inverno.
Um ano mais quente resulta em um anel
mais largo. Os padrões na largura, densidade da
madeira e composição isotópica do hidrogénio
e oxigénio dos anéis das árvores podem ser utilizados para estimar a temperatura
(www.seed.slb.com/pt/scictr/watch/climate_change/causes_co2.htm).
Corais
Os corais têm esqueletos de carbonato de cálcio
(CaCO3) duro. Alguns corais, à medida que crescem,
formam anéis anuais de carbonato de cálcio que podem
ser usados para estimar temperaturas. Quando a
temperatura do mar é quente, o coral crescerá mais
rápido que se a temperatura for fria, portanto, anos mais
quentes formarão anéis de crescimento mais largos e
anos mais frios criarão anéis mais finos. Isótopos de
oxigénio contidos no carbonato de cálcio também podem
ser usados para estimar a temperatura da água quando o
coral cresceu (www.seed.slb.com/pt/scictr/watch/climate_change/causes_co2.htm).
134
5 Tipos mais usuais de termómetros e sua aplicação
Núcleos de gelo
O gelo nos pólos foi acumulado durante centenas de
milhares de anos e contém informação sobre o clima e em
particular sobre a temperatura. Retirando núcleos de gelo a
elevadas
profundidades
podemos
estudar
certas
propriedades do passado. Na estação de Vostok na
Antárctica foi retirado um núcleo com 2083 metros de
comprimentos, trazido em partes de 1970 a 1974 e de 1982 a
1983. O gelo na parte inferior do núcleo tem quase 500 000
anos (www.seed.slb.com/pt/scictr/watch/climate_change/causes_co2.htm).
Observações durante períodos em que a temperatura também era conhecida
levaram a uma relação entre a concentração de deutério (isótopo do hidrogénio que
constitui a água) e a temperatura ambiente. Com base nessa relação, o estudo das
sucessivas camadas de gelo permite estimar a temperatura do passado.
O gelo também contém pó e ar antigos, que a sua análise permite inferir,
respectivamente, a existência de importantes erupções vulcânicas e as concentrações de
gases, tais como a de CO2.
Sedimentos de oceanos e lagos
Os rios retiram, continuamente, lama e areia da terra para lagos, mares e oceanos,
onde a lama pára para formar camadas de sedimentos. Os núcleos perfurados nesses
sedimentos podem revelar pequenos fósseis e produtos químicos que podem ajudar na
interpretação dos climas passados. Os grãos de pólen são muito duros e, portanto, são
geralmente bem preservados em camadas de sedimentos. Cada tipo de planta produz
grãos de pólen de diferentes formatos. Análises de grãos de pólen podem revelar quais
tipos de plantas que existiam na proximidade do local onde foi retirado o sedimento,
dando uma ideia de como seria o clima.
(www.seed.slb.com/pt/scictr/watch/climate_change/causes_co2.htm)
135
Temperatura e sua medição
5.6.5
Determinação da temperatura do interior da Terra e de
formação das rochas
Os Geofísicos Michael Gillan, Dario Alfé e Geoffrey
Pricein desenvolveram um método de cálculo computacional
para determinar a temperatura de ferro sujeito a uma pressão
muito elevada, tal como a que existe no centro da Terra. Com
essa simulação chegou-se ao valor de 6400 ºC para a
temperatura no núcleo da Terra se ele fosse composto apenas
por ferro. Contudo o núcleo contém cerca de 10% de materiais mais leves, pelo que a sua
temperatura será inferior ao determinado (Bukowinski, 1999).
Na Geologia estuda-se a temperatura de formação das rochas principalmente por
dois métodos, inclusões fluidas e da estequiometria de certos minerais existentes nas
rochas (Kornprobst, 1994).
5.6.6
Curiosidades
A primeira curiosidade está ilustrada no cartoon da figura: o ovo como termómetro
(http://oldmail.if.uff.br/ensino/Atividade%201_Temperatura.pdf).
Os grilos são um termómetro natural, pois permitem ter
uma ideia da temperatura ambiente. Ao fim de tarde, eles
cantam com uma frequência maior do que à noite, por esta ser
mais fresca, ou seja, o seu canto é muito mais lento. Esta
observação foi quantificada e publicada pela primeira vez em
1897 pelo inventor americano Amos Dolbear, num artigo
chamado “O grilo como termómetro”, que forneceu a fórmula
empírica q = 10 + ( N - 40) 7 , conhecida como lei de Dolbear (dá uma temperatura
aproximada da temperatura ambiente) (Dolbear, 1897).
136
5 Tipos mais usuais de termómetros e sua aplicação
Na fórmula, N é o número de vezes que os grilos cantam durante um minuto, q a
temperatura ambiente em graus Celsius. Por exemplo, se os grilos cantarem a uma taxa
de 110 vezes por minuto, a temperatura será de 20 ºC.
O maior termómetro do mundo com 134
pés (40,8 m) de altura situado em Baker na
Califórnia. O termómetro regista regularmente
temperaturas superiores a 100 graus Fahrenheit
no Verão. A sua altura está de acordo com o
facto de se observarem no local as temperaturas
mais elevadas nos Estados Unidos: 134 graus
Fahrenheit (57 ºC) em 1913 (www.roadtripamerica.com/roadside/Baker-Thermometer.htm).
137
6 Calibração e intercomparação de termómetros
6.1 Calibração de um TRP23 (Pt-100)24
6.1.1
Introdução
Uma das características fundamentais de qualquer instrumento de medição é a sua
rastreabilidade. Este conceito refere-se à possibilidade de seguir uma cadeia
metrológica, constituída por sucessivas calibrações, até chegarmos ao padrão primário
internacional que define directa ou indirectamente a grandeza a medir.
Como foi já referido, a calibração consiste na comparação de um instrumento com
outro de maior precisão tomado como padrão que por sua vez foi calibrado à custa de um
outro padrão de ordem superior e assim sucessivamente.
No contexto deste trabalho foi feita a calibração de um Pt-100 com o objectivo não
só de compreender a importância e a necessidade de calibração como elo de uma cadeia
metrológica como também de usar o Pt-100 calibrado num estudo de calibração e
comparação de diversos termómetros.
O processo de calibração exige um padrão rastreado e teve que ser feito num
laboratório de metrologia de temperaturas acreditado. O laboratório onde foi realizada a
calibração foi o Laboratório de Metrologia da Temperatura do Instituto Electrotécnico
Português (IEP). Para termos uma ideia dos laboratórios existentes em Portugal
competentes para realizarem calibrações de termómetros, apresentamos no Anexo A3 os
laboratórios nacionais acreditados.
23
TRP é a sigla para Termómetro de Resistência de Platina. Na língua inglesa a sigla é PRT
(Platinum Resistence Thermometer).
24
Pt-100 designa um TRP com uma resistência nominal de 100 Ω a 0 ºC.
139
Temperatura e sua medição
6.1.2
Resultado da calibração
O termómetro que foi calibrado consistiu num Pt-100 associado a um multímetro
HP 34401A, nº US36017967, Ref. 020991.
A calibração, em cinco pontos, foi realizada segundo a norma CEI 751 com
R0 = 100, 046 W e conforme o procedimento PC/061. O padrão utilizado foi um TRP
LMT/704, rastreado ao IPQ25. Foi emitido o certificado de calibração em 2007-03-14,
com o nº M-2007-0345, conforme se apresenta em Anexo A1.
Do certificado de calibração apresentamos os resultados na Tabela 6.1.
Multímetro HP 34401
Temperatura lida
no padrão em º C
Incerteza
em º C
Erro em
-30,86
± 0,11
+0,10
0,00
0,00
± 0,10
0,00
117,311
44,45
44,58
± 0,10
-0,13
134,507
89,31
89,62
± 0,11
-0,31
149,606
129,22
129,72
± 0,11
-0,50
Resistência
medida em
W
Temperatura
equivalente em º C
(CEI 751)
87,961
-30,76
100,046
Tabela 6.1
ºC
(TRP LMT/704)
Resultados da calibração do PRT Pt-100 (norma CEI 751).
Segundo a norma CEI 751, a relação entre a resistência do TRP com a temperatura
é estabelecida pela equação
Rq = R0 ÈÎ1 + Aq + B q 2 + C q 2 (q - 100)˘˚
(6.1)
onde Rq é a resistência do termómetro à temperatura q º C , R0 é a resistência do
termómetro a 0 º C e A , B e C são coeficientes determinados por calibração. Para o
intervalo de temperaturas -200 º C < q < 0 º C os coeficientes são dados por
Ï A = 3,90830 ¥ 10 -3 ºC -1
Ô
-200 º C < q < 0 º C Ì B = -5, 77500 ¥ 10 -7 ºC -2
Ô
-12
-3
ÔÓ C = -4,18301 ¥ 10 ºC
25
IPQ – Instituto Português da Qualidade
140
(6.2)
6 Calibração e intercomparação de termómetros
e no intervalo de temperaturas 0 º C < q < 850 º C os coeficientes A , B são os mesmos
que anteriormente e C é zero,
Ï A = 3,90830 ¥ 10 -3 ºC -1
Ô
0 º C < q < 850 º C Ì B = -5, 77500 ¥ 10 -7 ºC -2
ÔC =0
ÔÓ
(6.3)
A norma estabelece também duas classes de precisão correspondentes a tolerâncias
aceitáveis. A classe A com tolerância ± (0,15 + 0, 002q ) e a classe B com tolerância
± (0,3 + 0, 005q ) . Da calibração, concluímos que o TRP em causa corresponde a um
termómetro classe B.
O TRP mais usado apresenta um valor nominal de 100 W a 0 º C . Contudo existem
TRPs que apresentam a 0 º C resistências de 500 W e 1000 W , tendo como vantagem
principal a maior sensibilidade. Como comparação, apresentam-se na Tabela seguinte as
sensibilidades nominais dos TRP Pt-100, Pt-500 e Pt-1000.
Sensibilidade média dos diferentes TRP
Tabela 6.2
6.1.3
Pt-100
0,385 W K -1
Pt-500
1,925 W K -1
Pt-1000
3,850 W K -1
Sensibilidades médias dos TRP: Pt-100, Pt-500 e Pt-1000
(www.loreme.fr).
Curvas de ajuste dos pontos de calibração
Com os pontos de calibração calculámos o ajuste quadrático e cúbico, R (q ) ,
conforme se apresenta na Figura 6.1.
Como se observa, a resistência de platina tem um excelente comportamento linear
com a temperatura. O ajuste cúbico permite, contudo, uma maior precisão na
determinação da temperatura. Para valores positivos de temperatura, segundo a norma
CEI 751 é suficiente um ajuste quadrático, que se apresenta na Figura 6.2.
141
Temperatura e sua medição
Figura 6.1
Funções termométricas R (q ) R0 obtidas por ajuste quadrático e
cúbico dos cinco pontos de calibração.
Figura 6.2
Função termométrica R (q ) R0 obtida por ajuste quadrático e
cúbico dos quatro pontos de calibração correspondentes a
temperaturas positivas (incluindo o zero).
Para efeitos de utilização do TRP Pt-100 calibrado como padrão na actividade de
comparação e calibração de diversos termómetros, é conveniente fazermos o ajuste
cúbico da função inversa de R (q ) , obtendo-se assim a função q ( R ) , conforme se
apresenta na Figura 6.3.
142
6 Calibração e intercomparação de termómetros
Figura 6.3
Temperatura em função da resistência, q ( R ) , para o TRP Pt-100
calibrado.
Os valores de temperatura dados pela função de ajuste q ( R ) , correspondentes aos
valores de resistência medidos, são os que vão ser utilizados no trabalho de
intercomparação e calibração dos vários termómetros.
6.2 Comparação e calibração de diversos termómetros
6.2.1
Equipamento experimental utilizado
6.2.1.1 Dispositivo construído
Foi construído na oficina do Departamento de Física da FCUP um dispositivo
constituído por um bloco em cobre onde são integrados diversos termómetros. A
variação de temperatura era produzida por um elemento peltier colocado na base do
bloco de cobre. A Figura 6.4 mostra duas fotografias da montagem experimental com o
referido dispositivo. O bloco é montado num dissipador de alumínio com uma ventoinha,
cujo efeito é garantir uma temperatura uniforme na base do elemento peltier. A parte
superior do bloco está protegida termicamente por uma placa de material acrílico.
Durante a actividade experimental todo o sistema é envolvido em algodão em rama para
o isolar termicamente do exterior.
143
Temperatura e sua medição
Figura 6.4
Dispositivo constituído por um bloco de cobre e um elemento
peltier onde foram incorporados os diversos termómetros a
comparar.
6.2.1.2 Termómetros e instrumentos de leitura
Procedeu-se à inter-comparação das medições de temperatura de sete termómetros:
um TRP Pt-100, dois termopares, dois termístores, um termómetro de mercúrio e uma
rede de Bragg em fibra óptica. Como o TRP Pt-100 foi previamente calibrado, este
termómetro serviu como padrão, permitindo a calibração dos restantes.
As referências e algumas características nominais dos termómetros utilizados, bem
como do equipamento de leitura, estão resumidas a seguir:
• Termómetro de mercúrio
Gama de temperaturas: de -20 ºC a +110 ºC
Resolução: escala graduada em 1ºC
• Termopar 1
Tipo K (Cromel/Alumel)
Medidor de temperatura Metrix TH3050
• Termopar 2
Tipo T (Cobre/Constantan)
Sensibilidade: 40μV ºC -1
Microvoltímetro Thurlby 1905A, 200 mV, 5 1/2 dígitos
144
6 Calibração e intercomparação de termómetros
• Termopar 3
Tipo T (Cobre/Constantan)
Construído no Instituto de Física dos Materiais da Universidade do Porto (IFIMUP)
Microvoltímetro Thurlby 1905A, 200 mV, 5 1/2 dígitos
• Termístor 1
Código RS 151-221 com curva R-T ajustada com 5 k W a 25ºC .
Gama de temperaturas: de -80 ºC a +150 ºC ; b = 3914 K
Instrumento de leitura: Univolt DT-64, 2 kΩ e 20 kΩ
• Termístor 2
Código RS 256-045 (Ref. GM103) com resistência nominal de 10 k W a 25ºC
Gama de temperaturas: de +10 ºC a +100 ºC ; b = 3555 K
Instrumento de leitura: Datron 1059, 100 kΩ
• TRP Pt-100 4 fios (calibrado) (Modelo da RS 158-985, Labfacility)
Instrumento de leitura: HP 34401A, medição em 4R
• Rede de Bragg
Fibra óptica SMF28
Rede de valor nominal de reflexão a 1535 nm.
Analisador de Espectros Óptico (OSA) da FiberSensing.
6.2.2
Procedimento experimental
Fez-se a montagem dos termómetros no bloco de cobre, tendo-se usado massa
térmica para estabelecer um bom contacto térmico entre cada termómetro e o bloco de
cobre. Ligou-se seguidamente os termómetros aos respectivos aparelhos de medição, que
foram ligados e deixados estabilizar electrónica e termicamente durante uma hora.
A variação da temperatura do bloco foi controlada através do elemento peltier de
forma muito lenta para garantir estabilidade na temperatura e o equilíbrio térmico entre
todos os termómetros. O dissipador e a ventoinha incluídas no dispositivo facilitam a
manutenção de uma temperatura estável na base do peltier por dissipação de energia (ou
fornecimento de energia) do ambiente. Como já foi referido, durante as medições todo o
sistema foi isolado termicamente com algodão em rama.
Esta actividade é bastante demorada, pois requer estabilidade na temperatura e
equilíbrio térmico aquando das leituras. Como critério para o equilíbrio térmico, as
leituras eram tomadas quando todos os instrumentos mantinham os mesmos valores
145
Temperatura e sua medição
durante um certo intervalo de tempo, considerado adequado. O equilíbrio térmico, após
alguma prática, era obtido actuando na potência fornecida ao Peltier, induzindo
oscilações de temperatura, de amplitude sucessivamente menores, possibilitando uma
estabilização mais rápida.
6.2.3
Resultados da inter-comparação
Foram registados os valores lidos das grandezas termométricas para os diversos
termómetros, para equilíbrios térmicos diferentes, com vista à sua caracterização.
Relativamente à rede de Bragg, foi necessário repetir a experiência, apenas com a
rede de Bragg e o TRP Pt-100, na sua totalidade porque a fibra óptica se partiu (devido à
protecção exterior utilizada se ter dobrado).
6.2.4
Análise dos resultados
Tomando a temperatura do TRP Pt-100 como referência, determinou-se, para cada
termómetro, a função termométrica e os erros na temperatura por eles dada.
A temperatura de referência é determinada a partir do ajuste cúbico dos pontos de
calibração, que foi apresentado no gráfico da Figura 6.3, e é dado pela expressão
q = -248, 45686 + 2, 41822 RPt + 4,88091 ¥ 10-4 RPt2 + 1, 63458 ¥ 10-6 RPt3
(6.4)
6.2.4.1 Caracterização e calibração dos termopares
O termopar 1 (tipo K) estava associado ao medidor de temperatura Metrix TH3050,
obtendo-se directamente uma leitura em ºC. Com o propósito de comparação, a função
q ( termopar ) versus q (Pt-100) foi obtida por ajuste linear e cúbico, conforme se mostra
no gráfico da Figura 6.5.
146
6 Calibração e intercomparação de termómetros
Figura 6.5
Funções termométricas obtidas por ajuste linear e cúbico dos
pontos experimentais para o termopar 1.
Apesar do bom comportamento linear deste termopar, o ajuste cúbico apresenta um
melhor valor para o coeficiente de correlação e deverá ser usado para obtermos menores
incertezas nas medições.
Para avaliar a importância da calibração do termómetro e da escolha da curva de
ajuste mais adequada determinou-se os erros em relação à temperatura do Pt-100
considerando os valores lidos, sem qualquer ajuste, com um ajuste linear e com um ajuste
cúbico. Os ajustes fazem parte do processo de calibração.
Para calcular os erros, foi necessário obter os ajustes correspondentes às funções
inversas das apresentadas no gráfico da Figura 6.5, que são
T90 = 0,95933 + 0,99475q tp1
(6.5)
2
3
T90 = 0,55149 + 1, 01106q tp1 + 3,8191 ¥ 10 -4 q tp1
- 6,11873 ¥ 10 -6 q tp1
(6.6)
sendo q tp1 a temperatura lida directamente no aparelho de leitura ligado ao termopar 1 e
T90 a temperatura correspondente na escala ITS-90.
Os erros determinados apresentam-se no gráfico da Figura 6.6. É de salientar que
considerando o ajuste cúbico na calibração deste termopar os valores dos erros na gama
de temperaturas considerada estão dentro do intervalo de -0, 2 ºC a +0, 2 ºC , com a
excepção de um ponto. Comparando o ajuste linear com o ajuste cúbico, é claro que
apenas este último é adequado no processo de calibração, porque permite a utilização do
147
Temperatura e sua medição
termopar com incertezas muito menores que as incertezas associadas ao termopar não
calibrado.
Figura 6.6
Erros na utilização do termopar 1 calibrado (ajustes linear e
cúbico) e não calibrado (pontos experimentais).
No caso do termopar 2, não obtemos directamente leituras em unidades de
temperatura, mas em tensão termoeléctrica. Este termopar é teoricamente do tipo T e
estava associado ao multímetro Thurlby 1905A, fazendo-se leituras em μV . A função
e ( termopar ) versus q (Pt-100) foi obtida por ajuste linear e cúbico, conforme se mostra
no gráfico da Figura 6.7.
Figura 6.7
Funções termométricas obtidas por ajuste linear e cúbico dos
pontos experimentais para o termopar 2
148
6 Calibração e intercomparação de termómetros
A sensibilidade de um termopar do tipo T (cobre/constantan) é indicado na
literatura como sendo cerca de 40μV ºC -1 a 25 ºC . Contudo dos valores experimentais
obtidos verifica-se que para este termopar esse valor é cerca de 36, 7 μV ºC -1 .
Para calcular os erros, foi necessário obter os ajustes correspondentes às funções
inversas das apresentadas no gráfico da Figura 6.7, que são
T90 = 0, 24973 + 0, 02771e tp2
(6.7)
2
3
T90 = -0,9297 + 0, 02962 e tp2 - 1,80379 ¥ 10-7 e tp2
- 1, 06899 ¥ 10-10 e tp2
(6.8)
sendo e tp2 a tensão termoeléctrica em μV e T90 a temperatura correspondente na escala
ITS-90.
Considerando a calibração, vemos que apenas o ajuste cúbico permite reduzir
significativamente as incertezas nas medições de temperatura com este termopar,
conforme mostra o gráfico da Figura 6.8.
Figura 6.8
Erros na utilização do termopar 2 calibrado (ajustes linear e
cúbico).
O termopar 2 foi adquirido numa empresa de equipamento didáctico e é usado nos
laboratórios do departamento de Física.
O gráfico da Figura 6.11 mostra a comparação da curva de calibração normalizada
de um termopar tipo T, obtida do NIST (National Institute of Standards and Technology),
149
Temperatura e sua medição
com o termopar 2 e um outro do mesmo tipo construído com fios de qualidade no
IFIMUP (termopar 3). Como se pode ver do gráfico da Figura 6.10, os erros do
termopar 2 para temperaturas próximas de 100 ºC excede 12 ºC, enquanto que para o
termopar 3 os erros são cerca de 2 ºC. Estas discrepâncias, em especial a do termopar 2,
mostram claramente a necessidade de calibração para se obter resultados confiáveis e
precisos.
Figura 6.9
Comparação dos termopares 2 e 3 com a curva teórica para o
termopar tipo T (srdata.nist.gov/its90/download/type_t.tab).
Figura 6.10 Erros dos termopares 2 e 3 relativamente à curva teórica e erros
após calibração do termopar 2.
150
6 Calibração e intercomparação de termómetros
6.2.5
Caracterização e calibração dos termístores
Conforme já foi referido anteriormente, um termístor NTC apresenta uma
resistência eléctrica, R , que varia com a temperatura em kelvin, T , de acordo com a
expressão
È Ê 1 1 ˆ˘
R = R0 exp Í b Á - ˜ ˙
Î Ë T T0 ¯ ˚
(6.9)
onde R0 é o valor da resistência à temperatura T0 e b é um parâmetro de ajuste.
Da expressão anterior podemos obter a função inversa, T ( R ) , que é dada por
T=
b
(6.10)
ln ( R R0 ) + ( b T0 )
Normalmente o valor de R0 é dado à temperatura de 25 ºC . Os valores nominais
de R0 e b para o termístor 1 são R0 = 5 kW (a 25 ºC ) e b = 3914 K .
No gráfico da Figura 6.11 apresenta-se os valores experimentais e o ajuste dos
mesmos à função dada pela equação (6.9), considerando T0 = 298,15 K . Do ajuste
obtém-se os valores R0 = 5,11kW e b = 3810, 6 K .
Figura 6.11 Ajuste dos valores experimentais à curva dada pela equação (6.9)
considerando T0 = 298,15 K , para o termístor 1.
151
Temperatura e sua medição
Tomando para R0 e b os valores nominais e os obtidos pelo ajuste experimental,
calculámos as temperaturas a partir da equação (6.10) e comparámo-las com as
temperaturas de referência dadas pelo TRP Pt-100. Os desvios resultantes são
apresentados no gráfico da Figura 6.12.
Verifica-se mais uma vez que a calibração reduz as incertezas consideravelmente,
sobretudo para as baixas temperaturas. Para temperaturas próximas de 100 ºC verifica-se
erros elevados, mesmo levando em conta a calibração. Isto deve-se ao facto da
sensibilidade do termístor tender para zero quando a temperatura tende para infinito.
Assim, para temperaturas elevadas as incertezas nos aparelhos de medida de resistência
são dominantes.
O termístor 2 é do mesmo tipo e os parâmetros R0 e b têm valores nominais de
R0 = 10 kW (a 25 ºC ) e b = 3555 K .
Figura 6.12 Erros na utilização do termístor 1 calibrado (ajuste dos pontos
experimentais à equação (6.9)) e não calibrado (valores nominais
dos parâmetros R0 e b ).
No gráfico da Figura 6.13 apresenta-se os valores experimentais e o ajuste dos
mesmos à função dada pela equação (6.9), considerando T0 = 298,15 K . Do ajuste
obtém-se os valores R0 = 10, 73kW e b = 3401,3K .
Tomando para R0 e b os valores nominais e os obtidos pelo ajuste experimental,
calculámos, tal como anteriormente, as temperaturas a partir da equação (6.10) e
comparámo-las com as temperaturas de referência dadas pelo TRP Pt-100. Os desvios
resultantes são apresentados no gráfico da Figura 6.14.
152
6 Calibração e intercomparação de termómetros
Figura 6.13 Ajuste dos valores experimentais à curva dada pela equação (6.9)
considerando T0 = 298,15 K , para o termístor 2.
Figura 6.14 Erros na utilização do termístor 2 calibrado (ajuste dos pontos
experimentais à equação (6.9)) e não calibrado (valores nominais
dos parâmetros R0 e b ).
Verifica-se também que a calibração reduz as incertezas consideravelmente,
sobretudo para as baixas temperaturas. Para temperaturas próximas de 100 ºC observa-se
incertezas elevadas, mesmo levando em conta a calibração. A razão é a mesma da
referida anteriormente.
153
Temperatura e sua medição
6.2.6
Caracterização e calibração do termómetro de mercúrio
O termómetro de mercúrio apresenta uma excelente linearidade, conforme se
mostra no gráfico da Figura 6.15
Figura 6.15 Temperatura lida no termómetro de mercúrio versus temperatura
de referência (dada pelo TRP Pt-100).
Os erros são mostrados no gráfico da Figura 6.16. As incertezas mais baixas são
obtidas com um ajuste quadrático, sendo mais uma vez de salientar que a calibração é
essencial quando pretendemos fazer medições de temperatura fiáveis.
Figura 6.16 Erros na utilização do termómetro de mercúrio calibrado (ajustes
linear e quadrático) e não calibrado (pontos experimentais).
154
6 Calibração e intercomparação de termómetros
6.2.7
Caracterização e calibração de uma rede de Bragg em
fibra óptica
6.2.7.1 Sensores de fibra óptica
Grande parte do sucesso das fibras ópticas de sílica reside nas suas propriedades de
reduzido volume e massa, flexibilidade, baixa reactividade química do material, longa
distância de transmissão, elevada largura de banda de transmissão, isolamento eléctrico e
imunidade electromagnética.
Umas das aplicações das fibras ópticas são como sensores de diversas grandezas
físicas (acústica, magnética, temperatura, rotação, deformação entre outras). Para além de
apresentarem uma sensibilidade semelhante à dos sensores convencionais, apresentam
vantagens específicas: têm geometria versátil, a sua natureza dieléctrica permite o seu
uso em alta tensão, a altas temperaturas, em ambientes electricamente ruidosos e
corrosivos, e em outras condições agressivas para sensores convencionais. Apresenta
ainda inerente compatibilidade com sistemas de telemetria através de fibra óptica e tem
custos potencialmente baixos (Giallorenzi et al. 1982). Além disso, devido à baixa
atenuação dos sinais ópticos transmitidos pela fibra os sensores de fibra óptica podem ser
utilizados a grandes distâncias.
Relativamente ao uso da fibra óptica como sensor de temperatura, trataremos aqui a
rede de Bragg e na secção 6.3 abordaremos o termómetro baseado no efeito de Brillouin.
6.2.7.2 Rede de Bragg e princípio de funcionamento
O surgimento das redes de Bragg nas fibras ópticas permitiu que elas fossem
usadas como sensores de grandezas físicas estáticas e dinâmicas tais como a temperatura,
a pressão e a deformação (Kersey et al, 1997). Estes sensores permitem efectuar medidas
com grande precisão e estabilidade, podendo ser usados em grande número na mesma
fibra, através de técnicas de multiplexagem. O principal desafio na utilização das redes
de Bragg como elementos sensores é determinar os menores deslocamentos possíveis no
comprimento de onda de Bragg.
Como a informação do sensor está codificada em comprimento de onda, o sensor
torna-se insensível das flutuações de potencia da fonte óptica e das perdas nas
interligações dos vários componentes do sistema e devidas a eventuais macro e micro
curvaturas a que a fibra fique sujeita (Keiser, 2000).
155
Temperatura e sua medição
A natureza deste tipo de codificação facilita a multiplexagem por comprimento de
onda, já que cada sensor fica univocamente identificado por uma diferente porção do
espectro disponível da fonte óptica.
A reflexão no comprimento de onda de banda estreita possibilita a multiplexagem
de várias redes de Bragg ao longo da mesma fibra óptica. A resposta do sensor é linear
numa extensa banda dinâmica.
Uma rede de Bragg em fibra óptica (FBG) é uma modulação periódica do índice de
refracção do núcleo da fibra, ao longo da direcção longitudinal, como ilustrado na Figura
6.17. (Silva et al, 2003).
Ao propagar-se luz com espectro de banda larga numa fibra óptica que contém uma
rede de Bragg, ocorre a reflexão na rede através do efeito de espalhamento coerente e
sucessivo nas interfaces que separam as regiões com índices de refracção diferentes. O
comprimento de onda central do espectro de reflexão é designado por comprimento de
onda de Bragg da rede, lB , e é dado por (Hill et al. 1997)
lB = 2neff L
(6.11)
onde neff é o índice de refracção efectivo na fibra óptica e L é o período espacial da
modulação do índice de refracção.
Intensidade
Luz incidente
l
Fibra óptica
Intensidade
Luz reflectida
l
Intensidade
Luz transmitida
l
Rede de Bragg - modulação do
índice de refracção com período
espacial L
Figura 6.17 Princípio de operação de uma rede de Bragg em fibra óptica.
Qualquer perturbação que altere o índice de refracção ou o período da FBG altera o
comprimento de onda de Bragg, e consequentemente, pode medir-se um determinado
parâmetro através da variação do pico espectral da luz reflectida pela rede de Bragg. O
156
6 Calibração e intercomparação de termómetros
comprimento de onda de reflexão da FBG é dependente das características da rede. Ao
submete-la à variação de um dos parâmetros a serem medidos, obtém-se um desvio no
comprimento de onda de Bragg, proporcional à grandeza que se pretende medir.
Uma variação de temperatura na rede, DT , origina uma variação no comprimento
de onda de Bragg, DlB ( DT ) , expresso por (Kersey et al. 1997)
DlB = lB (a + x ) DT
onde a é o coeficiente de expansão térmica do material da fibra, e x é o coeficiente
termo-óptico da fibra.
A propriedade termométrica de uma rede de Bragg, como sensor de temperatura, é,
portanto, o comprimento de onde de Bragg. Para uma fibra de sílica
(SiO2 ) ,
a
sensibilidade da rede é cerca de 13 pm ºC -1 , para uma radiação incidente de
comprimento de onda nominal de 1,55 μm (3ª janela óptica de comunicações).
Do ponto de vista da instrumentação, uma vantagem do uso da FBG como sensor é
o facto de que a informação sobre o agente que a perturba está codificada em
comprimento de onda (Hill et al, 1997). Isso permite determinar o valor do agente
perturbador da FBG sem um sistema de referência para a potência óptica, que
necessitaria calibração periódica. Outra vantagem é a possibilidade de multiplexar em
comprimento de onda um grande número de sensores, permitindo medições multipontuais. A multiplexagem permite monitorizar estruturas com grandes dimensões como,
por exemplo, cabos de transmissão de energia eléctrica, oleodutos, cascos de navios,
entre outras.
6.2.7.3 Medição de temperatura com uma rede de Bragg
Apresentam-se a seguir os resultados da medição de temperatura usando uma rede
de Bragg em fibra óptica, de valor nominal de 1535 nm. A rede foi fabricada por
exposição UV (l = 248 nm ) da fibra SMF28 através de uma máscara de fase com
período de 1062 nm estando a fibra sob tensão mecânica.
157
Temperatura e sua medição
As leituras do comprimento de onda de Bragg foram feitas num Analisador de
Espectros Óptico (OSA) fabricado pela FiberSensing.
A rede foi montada no dispositivo da Figura 6.4 e foi um dos termómetros
envolvidos na actividade de intercomparação e calibração de termómetros. Durante a
actividade a fibra óptica partiu-se (devido à protecção exterior utilizada se ter dobrado
quando se atingiram temperaturas elevadas), tendo sido repetida a experiência apenas
com a rede de Bragg e o TRP Pt-100.
Nos gráficos das Figuras 6.18 e 6.19 apresentam-se a variação do comprimento de
onda de Bragg em função da temperatura.
Figura 6.18 Comprimento de onda de Bragg em função da temperatura da
rede medida com o TRP Pt-100 (antes da rotura).
A rede correspondente aos resultados da Figura 6.19 tem as características
nominais acima referidas. O ajuste linear dos pontos experimentais apresenta boa
correlação obtendo-se para a sensibilidade um valor de 12,99 pm ºC -1 , em excelente
concordância com o valor esperado teoricamente para uma fibra de sílica.
158
6 Calibração e intercomparação de termómetros
Figura 6.19 Comprimento de onda de Bragg em função da temperatura da
rede medida com o TRP Pt-100 (repetida).
Os desvios em temperatura dos pontos experimentais em relação à curva linear
obtida por calibração são mostrados no gráfico da Figura 6.20. Apesar do valor
sensibilidade associado às curva de ajuste, este termómetro apresenta erros que podem
atingir 3 ºC.
Figura 6.20 Erros na utilização da rede de Bragg em função da temperatura
medida com o TRP Pt-100 (para o ajuste linear).
159
Temperatura e sua medição
6.3 Caracterização e calibração de um Termómetro de
Brillouin
6.3.1
Princípio de funcionamento
O espalhamento estimulado de Brillouin (EEB) é um processo não-linear que pode
ocorrer nas fibras ópticas (Agrawal, 2001). Este fenómeno manifesta-se através da
geração de uma onda de Stokes em contra-propagação que transporta a maior parte da
energia incidente, logo que o limiar de Brillouin é atingido. O fenómeno do EEB foi
observado em 1964, sendo a frequência da onda de Stokes menor que a da onda
incidente. O valor do desvio na frequência é determinado pelo meio não-linear e é da
ordem de 10 GHz para uma fibra monomodal normalizada. A potência limiar para o EEB
depende da largura espectral associada à onda óptica incidente (bombagem) e do
comprimento da fibra (Marques et al, 2006). Pode ser da ordem de 1 mW para uma onda
de bombagem contínua ou para onda pulsadas cujos impulsos sejam relativamente largos
(> 1μs) . Para impulsos muito curtos (< 10 ns) o EEB não ocorre (Agrawal, 2001).
O processo do EEB pode ser descrito classicamente como uma interacção nãolinear entre o campo óptico de bombagem e os campos ópticos de Stokes através de uma
onda acústica. O campo óptico de bombagem origina uma onda acústica que modula o
índice de refracção do meio. Esta rede, induzida pelo campo óptico de bombagem,
espalha a radiação por difracção de Bragg. A radiação espalhada tem uma frequência
deslocada para baixo devido ao efeito do deslocamento Doppler associado à velocidade
da onda acústica vA . Como num processo de espalhamento a energia e o momento linear
devem ser conservados, as frequências e os vectores de onda das três ondas são
relacionados por
WB = w p - ws
G
G G
k A = k p - ks
(6.12)
(6.13)
G
G
onde w p e w s são as frequências, e kp e ks são os vectores de onda do campo de
bombagem e das ondas de Stokes, respectivamente. A frequência W B e o vector de onda
G
kA da onda acústica satisfazem a relação de dispersão usual (Agrawal, 2001)
160
6 Calibração e intercomparação de termómetros
W B = n A kA ª 2n A kp sin (q 2)
(6.14)
onde q é o ângulo entre as direcções de propagação dos campos de bombagem e de
Stokes, tendo sido considerado kp ª kA na equação (6.13). A equação (6.14) mostra que
a deslocamento em frequência da onda de Stokes depende do ângulo de espalhamento.
Em particular, W B toma o valor máximo para a contra-propagação (q = p ) e anula-se
para a co-propagação (q = 0) . Numa fibra óptica monomodal, os campos ópticos
propagam-se apenas na direcção coincidente com o eixo da fibra e, consequentemente, o
EEB apenas ocorre na direcção de contra-propagação e o desvio de Brillouin é dado por
n B = W B 2p = 2 nn A lp
(6.15)
onde a equação (6.14) foi usada com kp = 2 p n lp e n o índice de refracção modal para
o comprimento de onda lp . Se considerarmos n A = 5,96 km s -1 e n = 1, 45 como valores
típicos para uma fibra de sílica, obtemos n B ª 11,1GHz para lp = 1,55μm .
O EEB pode ser usado para construir sensores de fibra óptica distribuídos capazes
de medir temperatura e tensões mecânicas em longas distâncias. A ideia básica
subjacente ao uso do EEB para aplicações em sensores de fibra óptica é simples e pode
ser compreendida através da equação (6.15). Como o deslocamento Brillouin em
frequência depende do índice de refracção efectivo do campo modal, ele muda sempre
que o índice de refracção da sílica se altera como resposta às variações locais do
ambiente. Quer a temperatura quer a tensão mecânica alteram o índice de refracção da
sílica. Monitorizando as variações no deslocamento Brillouin em frequência ao longo da
fibra, é possível obter a distribuição da temperatura ou das tensões mecânicas ao longo
de grandes distâncias.
6.3.2
Caracterização experimental
6.3.2.1 Equipamento e montagem
Usou-se uma fibra monomodal normalizada, de 50 km de comprimento, para medir
experimentalmente o desvio Brillouin em frequência para várias temperaturas da fibra.
A bobina de fibra foi colocada num forno com controlo de temperatura, tendo sido
utilizado o TRP calibrado para calibrar o controlador de temperatura.
161
Temperatura e sua medição
A Figura 6.21 mostra a montagem experimental, tendo sido utilizado o seguinte
equipamento:
• Laser Santec TLS (Tunable Laser Source).
• EDFA (Erbium Doped Fiber Amplifier) Photonetics Fiberamp-BT 1400.
• FUT (Fiber under test) Fibra monomodal SMF IG09.
• Fotodetector HP 11982A.
• ESA (Electrical Spectrum Analyser) Tektronix 494P, 10 kHz – 21 GHz.
• Forno Heraeus com controlador de temperatura.
Laser
Circulador
óptico
EDFA
Fibra
Fibra
Fibra
FUT
Forno
Fibra
Fotodetector
Cabo
coaxial
ESA
Figura 6.21 Esquema experimental para caracterização do termómetro de
Brillouin.
6.3.2.2 Calibração do controlador de temperatura do forno
O gráfico da figura seguinte mostra a relação da temperatura seleccionada no forno
e o valor da temperatura do mesmo dada pelo TRP, depois de estabilizada a temperatura.
Figura 6.22 Calibração do controlador de temperatura do forno utilizado
para variar a temperatura da fibra óptica.
162
6 Calibração e intercomparação de termómetros
Do gráfico e do ajuste linear efectuado concluímos que a linearidade do
controlador de temperatura do forno é excelente. Os erros na temperatura do forno em
relação à temperatura seleccionada são apresentados no gráfico da Figura 6.23. De
salientar um comportamento linear do erro e os seus valores muito baixos, sendo o valor
máximo obtido para o erro de cerca de 0, 2 ºC .
Figura 6.23 Erros do controlador de temperatura do forno relativamente à
temperatura estabilizada obtida pelo TRP calibrado.
6.3.2.3 Resultados experimentais
O gráfico seguinte mostra os resultados obtidos para o desvio de Brillouin em
função da temperatura.
Figura 6.24 Desvio em frequência da radiação rectro-reflectida em função da
temperatura da fibra óptica.
163
Temperatura e sua medição
Como foi referido, a fibra tinha 50 km de comprimento e encontrava-se enrolada
numa bobine, formando uma espessura de vidro com cerca de 3 cm, o que exige bastante
tempo até se atingir o equilíbrio térmico.
O desvio em frequência da onda rectro-reflectida é 10,7 GHz e está de acordo com
o previsto teoricamente para uma fibra de sílica. Do gráfico da Figura 6.24, obtemos para
a sensibilidade deste termómetro o valor de 0, 77 MHz ºC -1 para a radiação utilizada
(l = 1550 nm) .
6.4 Caracterização de uma termopilha usando uma
lâmpada de filamento de tungsténio
Uma termopilha como sensor pode ser caracterizada usando uma lâmpada com
filamento de tungsténio. A Figura 6.25 apresenta um esquema da montagem
experimental utilizada.
Para diferentes valores de tensão e corrente na lâmpada ( e e I ) registou-se a
tensão de saída da termopilha, a qual tem uma resposta em tensão de 22 mV mW .
L
e
Termopilha
A
d
V
V
Figura 6.25 Esquema da montagem experimental para o estudo da lei de
Stefan-Boltzmann: V – voltímetro; A – amperímetro; e - fonte de
tensão variável (0 – 12V); L – lâmpada com filamento de
tungsténio.
A temperatura absoluta T do filamento de tungsténio de uma lâmpada pode ser
calculada pelas medidas da resistência R do filamento utilizado como termómetro. Para
a resistência de um filamento de tungsténio temos a seguinte relação
(
R (q ) = R0 1 + a q + b q 2
)
(6.16)
164
6 Calibração e intercomparação de termómetros
onde q é a temperatura em graus Celsius, R0 a resistência a 0 ºC , a = 4,82 ¥ 10-3 ºC -1 e
b = 6, 76 ¥ 10-7 ºC -2 (Cavalcante et al, 2005).
A resistência R0 pode ser calculada a partir da equação (6.16)
R0 =
R (q a )
(6.17)
1 + a q a + bq a2
onde q a é o valor da temperatura ambiente em graus Celsius.
O valor de R (q a ) é obtido pela lei de Ohm, R = e I , onde e é a diferença de
potencial nos terminais da lâmpada e I é a corrente no filamento. Devemos usar uma
corrente suficientemente pequena para que se possa desprezar o aquecimento devido ao
efeito de Joule, garantindo-se assim que o filamento se encontra à temperatura ambiente,
qa .
Resolvendo a equação (6.16) em ordem à temperatura q , a temperatura absoluta
do filamento vem dada por
T = 273,15 +
˘
Ê R
ˆ
1 È 2
Í a + 4 b Á - 1˜ - a ˙
2b Í
Ë R0 ¯
˙˚
Î
(6.18)
onde o valor de R é obtido pela lei de Ohm, R = e I , medindo a diferença de potencial
e a corrente no filamento.
No gráfico da Figura 6.26 apresenta-se a potência óptica medida no sensor em
função da quarta potência da temperatura da lâmpada. Verifica-se que a potência P
registada no sensor é proporcional a T 4 , com uma boa correlação dos pontos
experimentais. A ordenada na origem do ajuste tem, contudo, o valor de - 0, 039 mW , o
que pode ter como explicação o facto de o vidro da lâmpada não ser transparente a toda a
radiação emitida por esta. Para T = 0 teríamos um valor da potência próximo de zero,
mas o valor obtido pelo ajuste é negativo e significativo.
Podemos também representar graficamente o log10 ( P ) em função do log10 (T ) e
obter o gráfico da Figura 6.27. A ordenada na origem corresponde a log10 ( As ) , onde A
e s são a área do sensor e a constante de Stefan-Boltzmann, respectivamente. O declive
corresponde à potência da temperatura (que teoricamente é 4). O valor obtido para a
165
Temperatura e sua medição
potência da temperatura é 4,66, possivelmente explicado pela absorção do vidro
(sobretudo no infravermelho longo).
Figura 6.26 Potência na termopilha em função da quarta potência da
temperatura do filamento da lâmpada.
Figura 6.27 Logaritmo da potência na termopilha em função do logaritmo da
temperatura do filamento da lâmpada.
166
7 A Temperatura absoluta
Do ponto de vista conceptual é necessário definir uma temperatura independente
das propriedades termométricas de sistemas termodinâmicos particulares. Tal definição
permitirá obtermos o conceito de temperatura termodinâmica absoluta e terá de ser
obtida à custa das leis universais da Termodinâmica.
7.1 Definição de temperatura absoluta
A Lei Zero da Termodinâmica estabelece a base para a medição da temperatura,
mas uma escala empírica tem de ser definida em termos da propriedade termométrica de
uma substância específica e de um termómetro, tal como a escala de temperatura obtida
usando um termómetro de gás a volume constante.
Uma escala de temperatura que seja independente da natureza do sistema, é
chamada escala de temperatura termodinâmica absoluta.
A eficiência de um ciclo de Carnot26 é independente do sistema (máquina) que
opera o ciclo e depende apenas das temperaturas das fontes entre as quais opera. Esta
característica permite usar a máquina de Carnot para estabelecer a escala absoluta de
temperatura. Fazemos seguidamente o desenvolvimento de (Anacleto, 2004).
Uma máquina de Carnot absorve a energia Q1 por calor da fonte quente T1 e
rejeita a energia Q2
por calor para a fonte fria T2 , com uma eficiência que é
independente da natureza do sistema (Zemansky et al, 1997; Güémez et al, 1998). A
eficiência, dada por h = 1 - Q2 Q1 , depende apenas das temperaturas das fontes,
h = f (T1 , T2 ) , sendo f uma função desconhecida de T1 e T2 . Esta propriedade está na
base da definição de temperatura absoluta.
26
Um ciclo de Carnot é um processo cíclico reversível, realizado por um sistema arbitrário,
durante o qual o sistema só troca energia por calor com duas fontes. A fonte que se encontra a
uma temperatura maior é designada por fonte quente e a outra fonte é designada por fonte fria.
Num diagrama, o ciclo de Carnot é constituído por duas curvas adiabáticas e duas curvas
isotérmicas. O teorema de Carnot diz que a eficiência duma máquina de Carnot é máxima, em
relação a uma máquina qualquer que opere entre as mesmas fontes (Zemansky et al, 1997).
167
Temperatura e sua medição
Podemos, portanto, escrever
Q1
Q2
=
1
= f (T1 , T2 )
1 - f (T1 , T2 )
(7.1)
onde f (T1 , T2 ) é também uma função desconhecida das duas temperaturas.
Consideremos três máquinas de Carnot, RA, RB e RC, que operam entre três fontes
cujas temperaturas satisfazem a relação T1 > T3 > T2 , conforme ilustrado na Figura 7.1.
T1
Q1
Q1
WB
RB
Q3
T3
WA
RA
Q3
WC
RC
Q2
Q2
T2
Figura 7.1
Diagrama esquemático das máquinas de Carnot utilizadas para
estabelecer a escala termodinâmica absoluta de temperatura
(Anacleto, 2004).
Façamos então o seguinte raciocínio tomando a figura como suporte. Para a
máquina de Carnot RA, podemos escrever a relação
Q1
Q2
= f (T1 , T2 )
(7.2)
168
7 A Temperatura absoluta
A máquina RB é ajustada de forma a absorver uma energia por calor, da fonte T1 ,
igual à absorvida pela máquina RA, Q1 ; a energia por calor Q3 rejeitada é absorvida
pela máquina RC. Assim, tem-se para a máquina RB, Q1 Q3 = f (T1 , T3 ) .
Pelo corolário de Carnot27, como a máquina RA rejeita para a fonte fria a energia
por calor Q2 , para que as máquinas RB e RC, operando em conjunto, sejam equivalentes
à máquina RA, RC deve também rejeitar para a fonte fria a energia por calor Q2 . Temos,
então, para a máquina RC, Q3 Q2 = f (T3 , T2 ) .
Como
Q1
Q2
f (T1 , T2 ) =
=
Q1 Q3
Q2 Q3
, temos que
f (T1 , T3 )
(7.3)
f (T2 , T3 )
A temperatura T3 pode ser escolhida arbitrariamente pois não aparece no primeiro
membro da equação (7.3), e temos, sendo y (T ) uma função arbitrária,
Q1
Q2
=
y (T1 )
y (T2 )
(7.4)
Escolhendo y (T ) = T , a razão no primeiro membro da equação anterior é definida
como a razão de duas temperaturas termodinâmicas, T1 T2 , ou seja
Q1
Q2
=
T1
T2
(7.5)
Portanto, duas temperaturas na escala termodinâmica estão uma para a outra
como os respectivos valores absolutos das energias por calor absorvida e rejeitada, por
uma máquina de Carnot que opere entre fontes àquelas temperaturas.
27
O corolário de Carnot, obtido facilmente do teorema de Carnot, estabelece que todas as
máquinas de Carnot que operem entre as mesmas fontes têm a mesma eficiência.
169
Temperatura e sua medição
A escala termodinâmica de temperatura tem de ser independente das características
específicas de qualquer sistema particular. Assim, a máquina de Carnot permite a
universalidade que não é conseguida pela escala baseada num gás ideal. As temperaturas
termodinâmicas são chamadas temperaturas absolutas, pois são independentes do
sistema. A equação (7.4) é uma relação fundamental baseada na Segunda Lei da
Termodinâmica e no ciclo de Carnot. É necessário apenas que a função arbitrária y seja
função da temperatura termodinâmica.
À primeira vista, pode parecer que a razão de duas temperaturas Kelvin seria
impossível de medir, pois uma máquina de Carnot é uma máquina ideal, bastante difícil
de construir. A situação, contudo, não é tão má como parece. A razão de duas
temperaturas Kelvin é a razão de dois calores transferidos durante dois processos
isotérmicos limitados por duas curvas adiabáticas. As duas fronteiras adiabáticas podem
ser localizadas experimentalmente, e os calores transferidos durante os dois processos
isotérmicos “aproximadamente reversíveis” podem ser medidos com precisão elevada.
De facto, este método é um dos métodos usados na medição de temperaturas abaixo de
1 K.
É necessário ainda completar a definição da escala absoluta de temperatura.
Considerando o ponto triplo da água, TPT , como a temperatura de referência e
atribuindo-lhe o valor de 273,16 K (tal como já havíamos feito), temos
TPT = 273,16 K
(7.6)
Para uma máquina de Carnot que opera entre fontes a temperaturas T e TPT , temos
Q
T
=
QPT TPT
(7.7)
o que permite finalmente escrever
T = 273,16 K
Q
QPT
(7.8)
Comparando esta equação com a equação para a temperatura definida por um gás a
volume constante,
170
7 A Temperatura absoluta
Ê P ˆ
T = 273,16 K lim Á
PPT Æ 0 Ë P ˜
PT ¯
(V constante)
(7.9)
vemos que, na escala absoluta de temperatura, Q desempenha o papel de “propriedade
termométrica” para um ciclo de Carnot, tal como a pressão é a propriedade termométrica
para o termómetro de gás a volume constante. O calor não tem, contudo, a objecção
associada à coordenada termodinâmica pressão de um termómetro de gás, pois o
comportamento da máquina de Carnot é independente da natureza do sistema.
7.2 O zero absoluto e eficiência de Carnot
Da equação (7.8), vemos que quanto menor for o valor de Q , menor é o valor de T
correspondente. O menor valor possível de Q é zero, e o valor de T que lhe
corresponde é o zero absoluto. Portanto, se um sistema sofresse um processo isotérmico
reversível sem transferir energia por calor, a temperatura à qual este processo ocorreria
é chamado zero absoluto. Dito de outra forma, no zero absoluto uma isotérmica e uma
adiabática são idênticas28.
Notemos que a definição de zero absoluto é válida para todos os sistemas e é,
portanto, independente das propriedades específicas de qualquer sistema escolhido
arbitrariamente. Mais ainda, a definição é feita em termos de conceitos puramente
macroscópicos. Nenhuma referência é feita a átomos ou moléculas. Se o zero absoluto
pode ou não ser atingindo é uma questão deixada para a experimentação. Contudo, uma
máquina térmica que operasse com uma fonte fria à temperatura do zero absoluto violaria
a Segunda Lei, pois produziria trabalho negativo, W < 0 , trocando energia por calor com
uma única fonte (a fonte quente)29.
Como uma máquina de Carnot que absorve energia por calor Q1 da fonte quente à
temperatura T1 e rejeita energia por calor Q2 para a fonte fria à temperatura T2 tem uma
eficiência dada por
28
Uma curva adiabática e uma curva isotérmica não se podem intersectar em mais que um ponto.
29
Esta hipótese violaria o Postulado de Kelvin-Planck da Segunda Lei da Termodinâmica.
171
Temperatura e sua medição
h = 1-
Q2
(7.10)
Q1
e como, pela definição de temperatura absoluta se tem
Q2
Q1
=
T2
T1
(7.11)
concluímos que a eficiência de uma máquina de Carnot pode ser expressa em termos das
temperaturas absolutas das duas fontes,
h = 1-
T2
T1
(eficiência de uma máquina de Carnot).
(7.12)
Para um ciclo de Carnot ter uma eficiência de 100 % é necessário que T2 seja zero.
Apenas quando a fonte fria está à temperatura do zero absoluto é que toda a energia
absorvida por calor é convertida em trabalho. Como a natureza não nos proporciona uma
fonte à temperatura do zero absoluto, uma máquina térmica com 100 % de eficiência, o
que violaria a Segunda Lei, é uma impossibilidade prática e teórica.
7.3 A temperatura absoluta e a dada por um gás
A temperatura T dada por um termómetro de gás a volume constante foi definida
em termos da razão entre a pressão P, à temperatura T, e a pressão do sistema no ponto
triplo da água PPT , no limite das baixas pressões.
Demonstra-se que a temperatura dada por um termómetro de gás a volume
constante é equivalente à temperatura absoluta definida à custa de uma máquina de
Carnot (Zemansky et al, 1997).
Considerando que a temperatura do ponto triplo da água é a mesma para ambas as
definições de temperatura, TPT = 273,16 K , temos
T (dada pelo termómetro de gás a V constante) = T (absoluta )
172
(7.13)
7 A Temperatura absoluta
A temperatura absoluta é, portanto, numericamente igual à temperatura dada por
um gás ideal e, numa gama adequada, pode ser medida com um termómetro de gás a
volume constante.
7.4 Temperatura termodinâmica e termómetros primários
A temperatura T que ocorre nas leis fundamentais da Física é a temperatura
termodinâmica. A escala termodinâmica de temperatura pode ser definida de várias
formas, todas necessariamente equivalentes. Algumas definições são bastante abstractas e
não úteis para medições de temperatura. Como exemplo é a definição dada através da
eficiência de uma máquina de Carnot. Uma definição mais compreensível é aquela
baseada na equação de estado de um gás ideal
PV = N k T
(7.14)
onde P e V são a pressão e o volume do gás, respectivamente, N é o número de
partículas de gás (que é muito grande), e k é a constante de Boltzmann.
Esta temperatura é a que aparece noutras leis fundamentais tais como na lei de
radiação de Planck para o corpo negro, na fórmula de Nyquist para o ruído térmico ou na
expressão para o alargamento Doppler da linha espectral de emissão ou absorção de um
gás cujas partículas têm velocidades de acordo com a distribuição de Maxwell.
Estas leis servem como base para os termómetros primários que são capazes de
medir a temperatura termodinâmica. Um termómetro primário não precisa de ser referido
a outras medidas de temperatura (isto é, não precisa de calibração) mas obtêm a
temperatura de medições de outras grandezas tais como a pressão, a potência da radiação
ou a tensão de ruído. Portanto, podem ser usados para estabelecer a escala termodinâmica
de temperatura.
Por considerações termodinâmicas e pelas relações da Tabela 7.1 concluímos que
existe um zero absoluto para a temperatura para o qual, por exemplo, a pressão de um gás
ideal a volume constante, a emissão de radiação térmica, e a tensão de ruído térmico se
anulam.
A unidade de temperatura termodinâmica pode ser definida com a ajuda de uma
temperatura de um ponto fixo, à qual se atribui convencionalmente um valor, como foi
proposto por Kelvin em 1854. Um século mais tarde, a 10ª Conferência Geral de Pesos e
Medidas seguiu esta sugestão.
173
Temperatura e sua medição
Termómetro
primário
Lei fundamental subjacente
Gás
PV = N k T
Significado dos símbolos
P – pressão
V – volume
N – número de partículas
k – constante de Boltzmann
Constante
dieléctrica de
um gás
e – permitividade do gás
e 0 – permitividade do vazio
e = e0 + a0 N V
P = k T (e - e 0 ) a 0
a 0 – polarizabilidade estática
dipolar de um átomo
Acústico
ca2 = (cP cV ) k T m
m – massa da partícula
cP cV – razão das capacidades
térmicas molares
Ruído
térmico
DU – ruído térmico da tensão
eléctrica U na resistência
(válido para baixas frequências eléctrica R que ocorre num
banda estreita Dn
e no limite das altas
( DU ) 2
= 4 k T R Dn
temperaturas)
Radiação
espectral
Rn =
Radiação
total
s T 4 2p 4 ( k T )
=
R=
p
15 c 2 h3
Alargamento
Doppler
Dn D = È 2 k T
Î
Tabela 7.1
{
2 hn 3
}
c 2 exp ÈÎ hn (k T )˘˚ - 1
(
2
12
negro
h – constante de Planck
c – velocidade da luz no vazio
R – radiância total do corpo
negro
s – constante de
Stefan-Boltzmann
4
)
(m c )˘˚
Rn – radiância espectral do corpo
n0
Dn D - Largura Doppler em
frequência da linha com
frequência central n 0 , emitida ou
absorvida por um gás ideal à
temperatura T
Termómetros primários e leis fundamentais que lhes subjazem.
Foi escolhido então como ponto fixo o ponto triplo da água (PTA), o único ponto
no diagrama de fase onde vapor, água líquida e gelo coexistem, conforme se ilustra no
diagrama da Figura 7.2. A temperatura do ponto triplo TPT é, por convenção, 273,16 K,
de tal forma que a unidade de temperatura, o Kelvin, vem dada por
174
7 A Temperatura absoluta
1K = TPT 273,16
(7.15)
O valor numérico de 273,16 foi escolhido para que o kelvin estivesse tão próximo
quanto possível do grau Celsius usado anteriormente, que era definido como a centésima
parte da diferença de temperaturas entre o ponto de ebulição e o ponto de fusão da água à
pressão atmosférica normal (101,325 kPa).
Figura 7.2
Diagrama de fase para a água. O ponto triplo corresponde à
temperatura de 273,15 K e à pressão de 612 Pa.
A temperatura de fusão da água à pressão atmosférica normal é ligeiramente menor
que a temperatura do ponto triplo (a pressão do ponto triplo é de apenas 0,612 kPa). A
relação entre as temperatura em grau Celsius e em kelvin é, como vimos, dada por
T ( ºC) = T (K ) - 273,15
(7.16)
A escala de temperatura Celsius é portanto uma escala de temperatura Kelvin com
o zero deslocado para 273,15 K. Portanto, uma diferença de temperaturas tem o mesmo
valor numérico nas duas escalas
DT ( ºC) = DT (K )
(7.17)
175
Temperatura e sua medição
Notemos que o nome da unidade kelvin (K) não é acompanhada da palavra grau ou
do símbolo º, embora originalmente fosse designada por grau kelvin em 1954. Contudo,
essa designação foi modificada para kelvin pela Conferência Geral de Pesos e Medidas
(CGPM) em 1967.
A magnitude da unidade da temperatura termodinâmica não pode ser determinada
por considerações termodinâmicas. Isto acontece porque a temperatura T acorre sempre
na combinação kT em todas as leis físicas fundamentais, conforme se pode ver nos
exemplos dados na Tabela 7.1. Esta combinação é referida habitualmente por energia
térmica, pois é proporcional à energia cinética média, E , de uma partícula de um gás em
equilíbrio à temperatura T , E = 3kT 2 .
Portanto, em rigor um termómetro primário não mede a temperatura T , mas a
energia térmica kT . Assim, podemos redimensionar T para aT , se esta transformação
for acompanhada e compensada pelo redimensionamento da constante de Boltzmann k
para k a , mantendo-se assim o valor de kT .
Essencialmente, há duas formas de extrair a temperatura T de uma medição da
energia térmica kT . A escolha de definir a temperatura do ponto triplo da água, TPT ,
como sendo exactamente 273,16 K corresponde à escolha de um valor particular do
“factor de escala” a e, portanto, implicitamente determina também o valor numérico da
constante de Boltzmann k , a qual tem de ser determinada experimentalmente e de
preferência à temperatura do ponto triplo da água. Esta forma é a escolhida actualmente
na definição SI de kelvin, e a constante de Boltzmann no actual SI é dada por30
k = 1,380 650 4 ¥ 10-23 J K -1
(7.18)
com uma incerteza absoluta de 0, 000 002 4 ¥ 10-23 J K -1 e uma incerteza relativa de
1, 7 ¥ 10-6 .
Esta definição tem a vantagem do facto de que diferentes realizações experimentais
precisas da temperatura do ponto triplo da água mostraram concordância elevada entre si,
sendo as variações relativas menores que 3 ¥ 10 -7 , que é cerca de uma ordem de
grandeza menor que a incerteza do valor medido da constante de Boltzmann. Como
desvantagem, há um aumento da incerteza na medição de temperatura particularmente a
30
Ver http://physics.nist.gov/cuu/Constants/
176
7 A Temperatura absoluta
muito baixas e muito altas temperaturas, pois as medições de temperaturas têm de ser
rastreadas de alguma forma a uma medição feita à temperatura TPT .
Outra possibilidade de extrair T da energia térmica kT está presentemente em
discussão. Como alternativa à actual definição SI de kelvin através da temperatura do
ponto triplo da água, à constante de Boltzmann pode ser atribuída um valor por definição,
deixando de ter uma incerteza associada. Esta redefinição de kelvin teria a vantagem de
não favorecer um valor particular de temperatura ou um determinado método de
medição. Além disso, ligar a unidade de temperatura a uma constante fundamental
adequada será mais satisfatório conceptualmente do que ligá-la a uma propriedade de
uma material imperfeitamente conhecida, que não é certamente fundamental.
Partindo do seu valor experimental, podemos fixar o valor da constante de
Boltzmann em, por exemplo, k = 1,380 650 4 ¥ 10-23 J K -1 , que ligaria o kelvin à unidade
de energia, o joule, da mesma forma que a unidade de comprimento, o metro, é
actualmente ligada com a unidade de tempo, o segundo, atribuindo o valor exacto de
c = 299 792 458 m s -1 à velocidade da luz no vazio.
177
8 Conclusão
Este trabalho tem várias contribuições, de diversas índoles, que em conjunto se
traduzem num enriquecimento aos níveis pessoal e profissional.
No que diz respeito à inserção curricular, o estudo foi muito relevante, já que os
assuntos tratados fazem parte dos currículos do ensino básico e secundário. É de salientar
a contribuição de natureza teórica para um aprofundamento de conceitos, em geral, e do
conceito de temperatura, em particular.
O trabalho desenvolvido mostrou que a temperatura não é um conceito fácil, quer
na sua compreensão ao nível fundamental, quer na sua medição. A temperatura aparece
ligada a uma enorme diversidade de fenómenos físicos e é uma variável especial em
Termodinâmica, uma área onde as subtilezas abundam.
Da contribuição de cariz prático é de sublinhar a realização de 10 experiências e
actividades laboratoriais que proporcionaram um contacto com instrumentação científica
diversificada e com novas tecnologias, podendo algumas actividades ser utilizadas ou
adaptadas nas aulas.
Especial ênfase deve ser dada à actividade de intercomparação e de calibração de
diversos termómetros, alguns deles baseados na tecnologia das fibras ópticas, não só pela
diversidade de instrumentação usada, como também porque se utilizou como referência
um termómetro de resistência de platina calibrado. A calibração do termómetro envolveu
um laboratório de metrologia de temperatura acreditado e o ajuste dos pontos de
calibração foi realizada por nós, seguindo uma norma específica. A importância da
Metrologia, nomeadamente da compreensão dos conceitos de calibração, de
rastreabilidade, de cadeia metrológica e de normalização, tornou-se evidente com o
trabalho realizado, de tal forma que somos levados a preconizar que tais conceitos devam
ser introduzidos nos programas do ensino pré-universitário.
O trabalho como um todo constitui um documento útil para ser usado por
professores e alunos, não só como recurso didáctico-científico, mas também como
elemento indutor e polarizador de novas sugestões de trabalhos práticos a realizar nas
aulas ou em estudos futuros.
179
Temperatura e sua medição
Contudo, apesar de aliciante e motivador, o tema apresentou algumas dificuldades,
encaradas como fazendo parte da natureza das coisas. Uma das dificuldades foi a
abrangência do tema, que se foi revelando ao longo do estudo cada vez maior,
dificultando a organização do trabalho, pelo que se fez um corte, de forma significativa,
na parte teórica. Neste sentido, temos consciência que o produto final produzido constitui
apenas a ponta do iceberg.
Este trabalho permitiu uma consciencialização da problemática de calibração de
instrumentos e de utilização de padrões, e constitui uma contribuição para uma melhor
compreensão do conceito de temperatura e sua medição, nomeadamente aos docentes do
actual 10º ano de escolaridade.
180
Referências
Artigos e livros
• Abreu, M. C.; Matias, L.; Peralta, L. F., Física Experimental – Uma introdução, Editorial
Presença, 1994.
• Agrawal, G. P.; Nonlinear Fiber Optics, Academic Press, San Diego, 2001.
• Alonso, M.; Finn, E. J.; Fundamental University Physics, vol II, Addison-Wesley, Reading,
Massachusetts, 1977.
• Alonso, M.; Finn, E. J.; Fundamental University Physics, vol III, Addison-Wesley, Reading,
Massachusetts, 1978.
• Anacleto, J. M. S., Termodinâmica e Mecânica Estatística, Série Didáctica Ciências Puras,
29, Universidade de Trás-os-Montes e Alto Douro, Vila Real, 2004.
• Anacleto, J.; Anacleto, A., On the first law of Thermodynamics. Heat and work differentials,
Quim. Nova., 30 (2), 488-490 (2007).
• Bechtold, I. H.; Cristais líquidos: Um sistema complexo de simples aplicação, Rev. Bras.
Ens. Fis., 27 (3), 333-342, 2005.
• Besson, U.; The distinction between heat and work: an approach based on a classical
mechanical model, Eur. J. Phys. 24, 245, 2003.
• Bukowinski, M. S. T.; Taking the core temperature, Nature, Vol. 401, 432-433, 1999.
• Cadeira, H.; Bello, A.; Ontem e Hoje, Física 10/11, Porto Editora, Porto, 2007.
• Callen, H. B.; Thermodynamics and an introduction to thermostatistics, John Wiley, New
York, 1985.
• Carvalho, J. P.; Marques, M. B.; Aumento do Limiar do Espalhamento Estimulado de
Brillouin em Fibra por Modulação em Temperatura, Física 2006, Aveiro.
• Carvalhosa, M. C. ; Pinto, B. M.; Guimarães, M. F.; TécnicasLaboratoriais de Física –
Bloco I, Porto Editora, 1994.
• Castanho, M. A. P.; Trava-Airoldi, V. J.; Moro, J. R., Desenvolvimento de uma célula do
ponto fixo do zinco para calibração de sensores de temperatura, Rev. Bras. Apli. Vácuo,
23 (1), 41-46, 2004.
• Cavalcante, M. A.; Corpo negro e a determinação experimental da constante de Planck,
Rev. Bras. Ens. Fis., 27 (3), 2005.
• Çengel, Y. A.; Boles, M. A., Termodinâmica, 3ª Ed., McGraw-Hill, 2001.
181
Temperatura e sua medição
• Chuine, I.; Yiou, P.; Viovy, N.; Seguin, B.; Daux, V.; Le Roy Ladurie, E.; Grape ripening as
a past climate indicator, Nature, Vol. 432, 289-290, 2004.
• Craig, N.C.; Gislason E.A.; J. Chem. Educ. 79, 193, 2002.
• Cruz, M. M.; Alves, J. M.; Uma formulação “mais actual” da primeira lei da
Termodinâmica no 10º ano?, Gazeta de Física, 27 (3), 2004.
• Cunha, M. R. K.; Moura, A. R. L., As concepções de professores sobre medida e relação
dessas com a visão de realidade e o conceito de número, Comunicação oral, VII EPEM,
9-12, Julho 2004.
• Deus, J. D.; Pimenta, M.; Noronha, A.; Peña, T.; Brogueira, P.; Introdução à Física, 2ª ed.,
McGraw-Hill, Lisboa, 2000.
• Direcção Geral dos Ensinos Básico e Secundário, Programa de Ciências Físico-Químicas –
Programa e Organização Curricular – 3º ciclo, Lisboa, Ministério da Educação, 1991.
• Dolbear, A. E.; The Cricket as a Thermometer, The American Naturalist, 31 (371), 970-971,
1897.
• Dourado, L.; Trabalho Prático, Trabalho Laboratorial, Trabalho de Campo e Trabalho
Experimental no Ensino das Ciências – contributo para uma clarificação de termos, Ensino
Experimental das Ciências, Ministério da Educação – DES, 2002.
• Eisberg, R.; Resnick, R.; Física Quântica, Átomos, Moléculas, Sólidos, Núcleos e Partículas,
Campos, Rio de Janeiro, 1979.
• EricKson, L.; Sci. Educ. 64 (3), 323-336, 1980.
• Feynman, R. P.; Leighton, R. B.; Sands, M.; The Feynman Lectures on Physics, vol. II,
Addison-Wesley, Reading, Massachusetts, 1975.
• Fialho, A. B., Instrumentação Industrial, Conceitos, aplicações e análises, Editora Érica, São
Paulo, 2007.
• Giallorenzi, T. G.; Bucaro, J. A.; Anthony, Y D.; Sigel, Jr. G. H.; Cole, J. H.; Rashleigh, S.
C.; Priest, R. G., Optical fiber sensor technology, Transactions on Microwave Theory and
Techniques, vol. MTT-30, n. 4, 1982.
• Gislason, E.A., Craig, N.C.; Cementing the foundations of thermodynamics : Comparasion of
system-based and surroundings-based definitions of work and heat, J. Chem.
Thermodynamics. 37, 954 (2005).
• Güémez, J.; Fiolhais, C.; Fiolhais, M., Fundamentos de Termodinâmica do equilíbrio,
Fundação Calouste Gulbenkian, Lisboa, 1998.
• Güths, S.; Paulo, V.; Instrumentação em Ciências Térmicas, LMPT, Depart. Eng. Mecânica,
Univ. Federal de Santa Catarina, Brasil, 1998.
• Hill, K. O.; Meltz, G.; Fiber Bragg grating technology fundamentals and overview, J.
Lightwave Tech., 15 (8), 1263-1276, 1997.
• Kasap, S. O., Principles of Electronics Materials and Devices, McGraw-Hill, New York,
2002.
182
Referências
• Keiser, G.; Optical Fiber Communications, Mc-Graw Hill, Boston, 2000.
• Kersey, D.; Davis, M. A.; Patrick, H. J.; Le Blanc, M.; Koo, K. P.; Askins, C. G.; Putnam, M.
A.; Friebele, E. J.; Fiber Grating Sensors, J. Lightwave Tech., 15, 1442-1463, 1997.
• Kittel, C., Introduction to solid State Physics, John Wiley & Sons, New York, 1986.
• Kornprobst, J.; Les roches métamorphiques el leur signification géodynamique, Masson,
Paris, 1994.
• Marques, J. M.; Frazão, O.; Santos, J. L.; Marques, M. B.; J. M. Baptista, Espalhamento
Estimulado de Brillouin sem e com Realimentação, Física 2006, Aveiro.
• Martins, A. F.; Os Cristais líquidos, Lisboa, Fundação Calouste Gulbenkian, 1991.
• Melby, E.; Bergholt, L.; Guttormsen, M.; Hjorth-Jensen, M.; Ingebretsen, F.; Messelt, S.;
Rekstad, J.; Schiller, A.; Siem, S.; Ødegård, S. W.; Observation of Thermodynamical
Properties in the 162Dy, 166Er, and 172Yb Nuclei, Physical Review Letters, 83 (16), 3150-3153,
1999.
• Ministério da Educação, Ciências Física e Naturais – Orientações Curriculares para o 3º ciclo
do Ensino Básico, 2001.
• Ministério da Educação, Física e Química A, Programa 10º ano, 2001.
• Moraes, A. M.; Moraes, I. J., Avaliação conceitual de força e movimento, Rev. Bras. Ens.
Fis.; 22 (2), 232-246, 2000.
• Nicholas, J. V.; White, D. R., Traceable Temperatures, John Wiley & Sons, 1995.
• Omar, M. A., Elementary Solid State Physics, Addison Wesley, Reading, Massachusetts,
1993.
• Paulo Cabral (IEP), Breve História da Medição de Temperaturas
• Phywe, Physics Laboratory experiments, Germany, 1998.
• Pinheiro, M. F. F., Termodinâmica e Física Estatística, Laboratório de Física, Universidade
do Porto, 1996.
• Pires, D. P. L.; Afonso, J. C.; Chaves, F. A. B.; A termometria nos séculos XIX e XX,
Rev. Bras. Ens. Fis., vol. 28 (1), 101-114, 2006.
• Pires, D. P. L.; Afonso, J. C.; Chaves, F. A. B.; Do termoscópio ao termômetro digital:
quatro séculos de termometria, Quím. Nova, 29 (6), 2006.
• Silva, J. A.; Luiz, A. M.; A Relevância da Metrologia no Ensino Médio, XVI Simpósio
Nacional de Ensino de Física, CEFET / Rio de Janeiro, Brasil, 2005.
• Silva, J. C. C.; Martelli, C.; Diesel, B. W.; Fabris, J. L.; Kalinowski, H. J.; Goothoff, N.;
Canning, J.; Termómetro de Alta Temperatura (0-400 ºC) baseado em redes de Bragg em
Fibra Ótica para Aplicação no Setor de Petróleo, III Seminário Nacional de Controle e
Automação Industrial, elétrica e de telecomunicações, Salvador, Brasil, 2003.
• Sonntag, R.E.; Borgnakke, C.; Van Wylen, G. J.; Fundamentals of Thermodynamics, John
Wiley, New York, 2003.
183
Temperatura e sua medição
• Tipler, Paul, Física, vol. 2, Gravitação, Ondas e Termodinâmica, 3ª ed, Guanabara Koogan,
1994.
• VIM – Vocabulário Internacional de Metrologia, Termos Fundamentais e Gerais, 3ª Ed.,
Instituto Português da Qualidade, 2005.
• Zemansky, M. W.; Dittman, R. H.; Heat and Thermodynamics, 7th Ed., McGraw-Hill, New
York, 1997.
Sites de Internet (gerais)
Consultados entre Janeiro e Junho de 2007
• www.astroseti.org/noticia_257_SatelitesTermometros_Miden_Calentamiento_Global.htm
• www.jornaldaciencia.org.br/Detalhe.jsp?id=23848
• www.panex.com.br/novidades/thermo-spot.asp
• www.roadtripamerica.com/roadside/Baker-Thermometer.htm
• eletronicos.hsw.com.br/lcd1.htm
• w3.ualg.pt/~jmariano/introelec/iae_diodos.pdf
• oldmail.if.uff.br/ensino/Atividade%201_Temperatura.pdf
• www.seed.slb.com/pt/scictr/watch/climate_change/causes_co2.htm
• www.lakeshore.com/temp/sen/sd670_po.html
• http://ciencia.hsw.uol.com.br/questao663.htm
• www.its-90.com/
• http://physics.nist.gov/cuu/Constants/
• www.loreme.fr
• http://home.comcast.net/~igpl/Temperature.html
Sites de Internet (instituições e laboratórios)
Consultados entre Janeiro e Junho de 2007
• www.iep.pt/
• www.ipq.pt/
• www.catim.pt/
• www.nist.gov/
• www.npl.co.uk/
• www.bipm.fr/
• www.iec.ch/
184
Índice de figuras
Figura 2.1
Sistema termodinâmico constituído pelos subsistemas A, B e C. A fronteira
separa o sistema do meio exterior, e a vizinhança é a parte do exterior que
interage com o sistema (Anacleto, 2004).
Figura 2.2
12
Representação, num diagrama das variáveis X e Y, de estados de equilíbrio e
de processos termodinâmicos. Os processos quase-estáticos podem ser
representados por linhas contínuas definidas; os processos não quase-estáticos
representamos por linhas a tracejado (Anacleto, 2004).
Figura 2.3
Um gás que sofre um processo não-adiabático. Há trocas de energia por calor
e por trabalho (Anacleto, 2004).
Figura 2.4
17
20
Representação esquemática da operação de: a) uma máquina térmica; e b) uma
máquina frigorífica (Anacleto, 2004).
23
Figura 2.5
Ciclo de Carnot representado num diagrama P-V (Anacleto, 2004).
25
Figura 3.1
Capacidade térmica mássica a volume constante, cV , em função da
temperatura. cV tende para zero quando T tende para zero.
Figura 3.2
Capacidade térmica mássica da água em função da temperatura à pressão
atmosférica normal (Zemansky et al, 1997).
Figura 3.3
40
Isotérmicas correspondentes de dois sistemas termodinâmicos diferentes A e
B (Anacleto, 2004).
Figura 3.10
38
Fotografias que ilustram a actividade experimental do estudo do equilíbrio
térmico.
Figura 3.9
37
Aumento da temperatura da água em função do tempo. O declive é
proporcional à taxa de propagação da energia por calor na barra.
Figura 3.8
37
Variação da temperatura ao longo da barra depois de atingido o regime
estacionário de propagação de energia por calor.
Figura 3.7
36
Fotografia da montagem experimental para a determinação da condutividade
térmica de uma barra condutora.
Figura 3.6
34
Condutividade térmica em função da temperatura para algumas substâncias
(adaptado de Zemansky et al, 1997).
Figura 3.5
33
Fluxo de energia por calor através de uma camada de espessura Dx e área A,
submetida a uma diferença de temperaturas DT = T2 - T1 .
Figura 3.4
30
43
Fotografias de um caderno de um aluno (à esquerda) e da montagem
experimental (à direita) relativas à actividade da determinação dos pontos de
fusão e de ebulição da água.
45
185
Temperatura e sua medição
Figura 3.11
Gráfico da evolução da temperatura no aquecimento da água desde o ponto de
fusão até ao ponto de ebulição.
Figura 3.12
46
Distribuição das velocidades de Maxwell-Boltzmann para as temperaturas de
300 K, 900 K e 1500 K.
Figura 3.13
48
Evolução temporal da temperatura do ar no interior de duas latas de cores
diferentes, quando incide nelas radiação nas mesmas condições.
Figura 3.14
Fotografia da montagem experimental para a comparação do poder de
absorção de radiação por diferentes superfícies.
Figura 3.15
51
Gráfico comparativo do aquecimento da água com uma lâmpada com e sem
folha de alumínio.
51
Figura 3.17. Radiância espectral do corpo negro para quatro temperaturas diferentes.
Figura 3.18
50
Fotografias da montagem experimental para estudo do aquecimento da água
com uma lâmpada.
Figura 3.16
49
53
Cavidade que com um orifício. A radiação que entra é totalmente absorvida
devido às sucessivas reflexões no interior da cavidade, que se aproxima a um
corpo negro.
Figura 3.19
54
Uma cavidade cúbica, com aresta de comprimento a, preenchida por radiação
electromagnética.
Figura 3.20
56
Planos nodais de uma onde estacionária que se propaga numa dada direcção
na cavidade cúbica.
Figura 3.21
57
Comparação entre a previsão da Física clássica e os resultados experimentais
para a densidade de energia numa cavidade.
Figura 3.22
62
Comparação entre os resultados de um cálculo simples e a distribuição de
Boltzmann.
64
Figura 4.1
Termómetro de Galileu Galilei.
73
Figura 4.2
Estabelecimento de uma escala de temperatura (Anacleto, 2004).
79
Figura 4.3
Gráfico de P em função de θ, obtido experimentalmente com o termómetro de
gás a volume constante, utilizando quatro gases diferentes a baixas pressões
(Anacleto, 2004).
81
Figura 4.4
Célula de ponto-triplo da água (Anacleto, 2004).
82
Figura 4.5
Representação esquemática de um termómetro de gás a volume constante,
sendo a propriedade termométrica a pressão (Anacleto, 2004).
Figura 4.6
83
Temperatura do PEN da água dada por diferentes termómetros de gás, no
limite quando PPT Æ 0 (Anacleto, 2004).
85
Figura 5.1
Termómetros de dilatação em recipiente de vidro.
94
Figura 5.2
Termómetro de máxima e de mínima.
96
Figura 5.3
A – Termómetro de dilatação de líquido em recipiente metálico; B – Tubos de
Bourdon utilizados como elementos de medição.
186
97
Índice de figuras
Figura 5.4
Termómetro registador.
97
Figura 5.5
Flexão da lâmina bimetálica quando aquecida.
98
Figura 5.6
A - Termóstato; B - Termómetro bimetálico.
98
Figura 5.7
Termopar constituído por duas junções dos metais A e B, a junção de medição
e a junção de referência.
Figura 5.8
99
Termopar onde a junção dos fios A e B constitui a junção de teste e a junção
de referência consiste em duas junções com fios de cobre (Anacleto, 2004).
Figura 5.9
O efeito Seebeck: um gradiente de temperatura origina uma diferença de
potencial (em circuito aberto).
Figura 5.10
102
Para um termopar constituído por duas junções de um mesmo metal A não é
possível medir a diferença de potencial.
Figura 5.11
101
104
Um termopar tem que ser constituído por duas junções de dois metais
diferentes A e B.
104
Figura 5.12
Ilustração das leis de funcionamento dos termopares.
110
Figura 5.13
Gráfico ilustrativo da variação da resistência com a temperatura para alguns
metais e para um semicondutor.
115
Figura 5.14
Interior de uma termo-resistencia.
115
Figura 5.15
Aspecto exterior de uma termo-resistência.
115
Figura 5.16
Algumas termo-resistências.
116
Figura 5.17
Método de medição a dois fios.
118
Figura 5.18
Método de medição a quatro fios.
119
Figura 5.19
Minimização do efeito de auto-aquecimento usando uma corrente pulsada: a)
corrente injectada; b) sinal em tensão detectado.
119
Figura 5.20
Ponte de Wheatstone com resistência de três fios.
120
Figura 5.21
Exemplos de termístores.
121
Figura 5.22
Esquema de uma termopilha.
123
Figura 5.23
Ilustração do primeiro pirómetro patenteado.
124
Figura 5.24
A – Esquema de um pirómetro óptico. B – Observação.
125
Figura 5.25
Esquema de um pirómetro independente da emissividade.
126
Figura 5.26
Frequências utilizadas pelo pirómetro de duas cores.
127
Figura 5.27
Pirómetro de radiação infravermelha.
128
Figura 5.28
Exemplos de pirómetros de radiação infravermelha.
129
Figura 5.29
Moléculas de cristais líquidos dispostas em hélice.
130
Figura 5.30
Anéis de humor feitos de cristais líquidos.
130
Figura 5.31
Tiras termométricas de cristais líquidos.
131
Figura 5.32
Tensão eléctrica nos terminais de um díodo de Silício polarizado directamente
com
uma
corrente
de
10 μA
em
(www.lakeshore.com/temp/sen/sd670_po.html).
187
função
da
temperatura
132
Temperatura e sua medição
Figura 6.1
Funções termométricas R (q ) R0 obtidas por ajuste quadrático e cúbico dos
cinco pontos de calibração.
Figura 6.2
142
Função termométrica R (q ) R0 obtida por ajuste quadrático e cúbico dos
quatro pontos de calibração correspondentes a temperaturas positivas
(incluindo o zero).
142
Figura 6.3
Temperatura em função da resistência, q ( R ) , para o TRP Pt-100 calibrado.
143
Figura 6.4
Dispositivo constituído por um bloco de cobre e um elemento peltier onde
foram incorporados os diversos termómetros a comparar.
Figura 6.5
Funções termométricas obtidas por ajuste linear e cúbico dos pontos
experimentais para o termopar 1.
Figura 6.6
147
Erros na utilização do termopar 1 calibrado (ajustes linear e cúbico) e não
calibrado (pontos experimentais).
Figura 6.7
144
148
Funções termométricas obtidas por ajuste linear e cúbico dos pontos
experimentais para o termopar 2
148
Figura 6.8
Erros na utilização do termopar 2 calibrado (ajustes linear e cúbico).
149
Figura 6.9
Comparação dos termopares 2 e 3 com a curva teórica para o termopar tipo T
(srdata.nist.gov/its90/download/type_t.tab).
Figura 6.10
Erros dos termopares 2 e 3 relativamente à curva teórica e erros após
calibração do termopar 2.
Figura 6.11
150
Ajuste dos valores experimentais à curva dada pela equação (6.9)
considerando T0 = 298,15 K , para o termístor 1.
Figura 6.12
153
Temperatura lida no termómetro de mercúrio versus temperatura de referência
(dada pelo TRP Pt-100).
Figura 6.16
153
Erros na utilização do termístor 2 calibrado (ajuste dos pontos experimentais à
equação (6.9)) e não calibrado (valores nominais dos parâmetros R0 e b ).
Figura 6.15
152
Ajuste dos valores experimentais à curva dada pela equação (6.9)
considerando T0 = 298,15 K , para o termístor 2.
Figura 6.14
151
Erros na utilização do termístor 1 calibrado (ajuste dos pontos experimentais à
equação (6.9)) e não calibrado (valores nominais dos parâmetros R0 e b ).
Figura 6.13
150
154
Erros na utilização do termómetro de mercúrio calibrado (ajustes linear e
quadrático) e não calibrado (pontos experimentais).
154
Figura 6.17
Princípio de operação de uma rede de Bragg em fibra óptica.
156
Figura 6.18
Comprimento de onda de Bragg em função da temperatura da rede medida
com o TRP Pt-100 (antes da rotura).
Figura 6.19
158
Comprimento de onda de Bragg em função da temperatura da rede medida
com o TRP Pt-100 (repetida).
159
188
Índice de figuras
Figura 6.20
Erros na utilização da rede de Bragg em função da temperatura medida com o
TRP Pt-100 (para o ajuste linear).
159
Figura 6.21
Esquema experimental para caracterização do termómetro de Brillouin.
162
Figura 6.22
Calibração do controlador de temperatura do forno utilizado para variar a
temperatura da fibra óptica.
Figura 6.23
162
Erros do controlador de temperatura do forno relativamente à temperatura
estabilizada obtida pelo TRP calibrado.
Figura 6.24
Desvio em frequência da radiação rectro-reflectida em função da temperatura
da fibra óptica.
Figura 6.25
163
163
Esquema da montagem experimental para o estudo da lei de StefanBoltzmann: V – voltímetro; A – amperímetro; e - fonte de tensão variável (0
– 12V); L – lâmpada com filamento de tungsténio.
Figura 6.26
Potência na termopilha em função da quarta potência da temperatura do
filamento da lâmpada.
Figura 6.27
166
Logaritmo da potência na termopilha em função do logaritmo da temperatura
do filamento da lâmpada.
Figura 7.1
166
Diagrama esquemático das máquinas de Carnot utilizadas para estabelecer a
escala termodinâmica absoluta de temperatura (Anacleto, 2004).
Figura 7.2
164
168
Diagrama de fase para a água. O ponto triplo corresponde à temperatura de
273,15 K e à pressão de 612 Pa.
175
189
A1
Certificado de calibração do Pt-100
191
Temperatura e sua medição
Laboratório da Metrologia da Temperatura
Instituto Electrotécnico Português
http://www.iep.pt
192
A2
Laboratório de Temperatura – IPQ
193
Temperatura e sua medição
Instituto Português da Qualidade
Laboratório de Temperatura
http://www.ipq.pt/backFiles/LTE.pdf
194
A3
Laboratórios de Temperatura acreditados
Instituto Português de Acreditação – IPAC
http://www.ipac.pt/pesquisa/acredita.asp
195
A4
Procedimento experimental
Apresenta-se neste anexo os materiais utilizados e os procedimentos nas
actividades experimentais de determinação da capacidade térmica mássica do aço e da
condutividade térmica do cobre.
1. Determinação da capacidade térmica do aço pelo método das misturas
Material
• Calorímetro (vaso calorimétrico + agitador + termómetro)
• Gobelé
• Disco eléctrico
• Peça de aço presa com um fio
• Água
• Vaso de Dewer (Garrafa termo)
• 2 Termómetros
• Balança
Procedimento
Deve seguir-se a sequência apresentada, visto o equilíbrio térmico demorar algum
tempo a atingir-se
1. Determinação da massa e da temperatura inicial da peça de aço
• Colocar água no gobelé, e aquecê-la no disco eléctrico
• Determinar a massa da peça de aço, e registar o seu valor maço
• Transferir a água quente para a garrafa termo
• Introduzir a peça de aço suspensa por um fio no interior da garrafa termo e
fechá-la
• Introduzir o termómetro na tampa de modo a que o sensor fique no seio da água
• Esperar que se atinja o equilíbrio térmico e registar o valor dessa temperatura
θaço
197
Temperatura e sua medição
2. Determinação da capacidade térmica do calorímetro
• Pesar o calorímetro e registar o valor da massa
• Colocar água no calorímetro, pesar novamente e, por diferença, determinar a
massa da água introduzida m1
• Agitar a água e logo que seja atingido o equilíbrio térmico registar a
temperatura, θ1
• Colocar água no gobelé, aquecer a água, agitando-a até se atingir uma dada
temperatura, θ2
• Transferir a água quente para o calorímetro e tapar
• Agitar para uniformizar a mistura e seguir a evolução da temperatura, registar o
valor máximo atingido θmistura
• Medir a massa total (do calorímetro + água fria + água quente) e determinar a
massa da água quente lançada no calorímetro, m2
• Calcular a quantidade de energia transferida para o calorímetro mais água fria,
usando o princípio da conservação da energia.
• Determinar o valor da capacidade térmica do calorímetro e determinar a
quantidade equivalente de água.
3. Determinação da capacidade térmica do aço
• Determinar a massa do calorímetro limpo e seco
• Colocar água no calorímetro, de modo a que o corpo a introduzir fique
submerso; voltar a pesar e determinar, por diferença, a massa de água
introduzida, mágua
• Tapar, agitar a água, logo que seja atingido o equilíbrio térmico registar a
temperatura, θágua
• Retirar a peça da garrafa termo e introduzi-la no calorímetro, o mais
rapidamente possível.
• Agitar a água e seguir a evolução da temperatura
• Atingido o equilíbrio térmico, registar a temperatura, θf
Tabelas de registo
Determinação da capacidade térmica do calorímetro
m1
θ1
θ2
198
θmistura
m2
A4 Procedimento experimental
Determinação da capacidade térmica mássica do aço
mágua
maço
θágua
θaço
θf
Questões a discutir com os alunos, podendo conduzir a alterações no
procedimento ou a procedimentos diferentes com diferentes grupos para
comparações de resultados
• Na determinação da capacidade térmica do calorímetro a deve usar-se uma
quantidade de água tal que a energia cedida pela água quente não provoque uma
acentuada variação de temperatura do sistema. Porquê?
• Seria preferível partir de água quente no calorímetro e adicionar água fria?
• Na determinação da capacidade térmica do aço será indiferente introduzir a peça
quente na água fria do calorímetro ou a peça fria na água quente do calorímetro?
2. Determinação da condutividade térmica do cobre
Material
O material utilizado constitui um kit da Phywe
• Dois suportes universais
• Grarras e nós
• Barra de cobre com 10 cavidades para encaixes dos termómetros e isolada
lateralmente, excepto no extremo que encaixa no vaso calorimétrico
• Vaso calorimétrico, com encaixe na parte inferior para a barra
• Vaso calorimétrico
• Massa térmica
• Resistência eléctrica
• 2 termómetros
• Medidor digital de temperatura
• Balança, craveira, cronómetro
199
Temperatura e sua medição
Procedimento
• Fazer a montagem de acordo com a a fotografia da Figura 3.5
No contacto da barra de cobre com o vaso calorimétrico superior usar massa
térmica, a outra extremidade fica imersa na mistura de água e gelo fundente
• Determinar a massa do vaso calorimétrico inferior
1. Determinação do gradiente de temperatura ao longo da barra
• Medir o diâmetro da barra e a distância entre as cavidades
• Colocar água no vaso calorimétrico superior
• Colocar água e gelo fundente no vaso calorimétrico inferior
• Ligar a resistência eléctrica para aquecer a água até à ebulição e mantê-la
• Deixar que ao longo da barra se atinja um fluxo estacionário de energia, que é
observado pela constância da temperatura nas cavidades da barra.
• Medir a temperatura em cada cavidade ao longo da barra, em regime
estacionário
• Construir o gráfico da temperatura em função da posição da cavidade na barra
2. Determinação do fluxo de energia ao longo da barra
• Com a água do vaso calorimétrico inferior a uma temperatura o mais próximo
possível de 0 ºC iniciar a medição da elevação da temperatura da água ao longo
do tempo
• Determinar a massa do conjunto vaso calorimétrico inferior + água e calcular a
massa da água
• Construir o gráfico da temperatura da água em função do tempo
3. Determinar a condutividade térmica pela expressão (3.10)
Questões a discutir com os alunos
• Discutir as principais fontes de erro da experiência
• Por que é que na determinação do fluxo de energia a água no vaso inferior deve
estar o mais próximo possível de 0 ºC?
200
Baixar