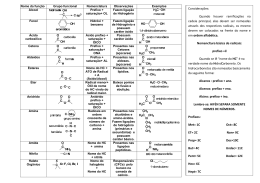
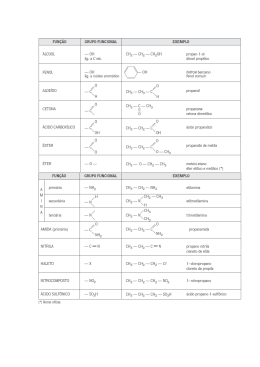
SEI Ensina - MILITAR Química Funções e Nomenclaturas e Química Orgânica Função Hidrocarbonetos e Derivados Halogenados Característica Hidrocarbonetos Somente átomos de Carbono e Hidrogênio Alcanos Somente ligações simples Nomenclatura o Prefixo+an +o Alquenos Uma ligação Dupla Prefixo+en +o Alcinos Uma ligação Tripla Prefixo+in +o Alcadienos Duas ligações duplas Prefixo+dien +o Ciclanos Uma ligação simples no “ciclo” Ciclo+ Prefixo+an +o Aromáticos Pelo menos um núcleo benzênico Derivados Halogenados ------------------ -F,-Cl, -Br , -I Haletos de alquila R - X(-F,-Cl, -Br , -I) Haletos de arila Ar -X Nome do halogênio+nome do hidrocarboneto Exemplos: 2,3-dimetilpentano 4-etil-3-metilpent-2-eno 5,6-dimetilept-2-ino 3-etil-2-metilpent-1,3-dieno isopropilciclobutano m-dimetilbenzeno www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 1 Funções Oxigenadas Característica Função R Álcoois OH Nomenclatura Prefixo+an,en,in+ol (ligado a carbono saturado) Fenóis OH (ligado a carbono aromático) R Éteres O hidroxi+nome do hidrocarboneto aromático R' Menor radical(oxi)+maior radical(ano,eno,ino) Aldeídos O R Prefixo+an,en,in+al C H O Cetonas Prefixo+an,en,in+ona C O Ácidos Carboxílicos R Prefixo+an,en,in+óico C OH Ésteres O R Prefixo+an,en,in+o+ato de prefixo+ila C O Sais Orgânicos R' Prefixo+an,en,in+o+ato de (metal) O R C O Haletos de Acila Metal - x+ x Nome do halogênio(ETO) de Prefixo+ano+eno+ino+(ILA) O R C X Anidridos Orgânicos R O O C C Anidrido Nome(s) do(s) Ácido(s) Carboxílico(s) de Origem(ÓICO) R' O www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 2 Exemplos: OH OH O H OH O 2,3-butanal etoxietano 3-etil-4-metilpentan-2-ol o-di-hidroxibenzeno O OH O O O 4-metilpentan-2-ona ácido 3-etil-4-metilpentanóico propanoato de fenila O O O Cl - O + O Na propanoato de sódio Função O anidrido etanóico ou acético cloreto de benzoíla Funções Nitrogenadas Características R NH2 primária R Aminas NH R' R secundária Nomenclatura N R" terciária R' nome(s) do(s) radical(is) +amina O Amidas Nitrilas R R C C NH2 Nome do hidrocarboneto + amida N Nome do hidrocarboneto + nitrila O Nitrocompostos R Nitro+Nome do hidrocarboneto N O www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 3 Exemplos: NH2 O NH2 metilpropanamida fenilamina CH3 N H3C C Etanonitrila ou Acetonitrila NO2 p-nitrotolueno Função Funções Sulfuradas Características Tióis R Nome do Hidrocarboneto + TIOL SH R Tioéteres Nomenclatura S Nome do Hidrocarboneto+Tiona R' S Tiocetonas C R Radical Menor (ano)+ tio+Radical Maior (ona) R' O R Ácidos Sulfônicos S Ácido Nome do Hidrocarboneto Correspondente + Sulfônico OH O S SH SO3H S Pentan-1-tiol Etano-tiopropano butanotiona ácido benzenosulfônico www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 4 Funções Mistas Ordem de Preferência das Principais Funções: Halogênio <Nitro <Amina(Amino) <Hidroxila(hidroxi)<Éter <Cetona (ceto ou oxo) <Aldeído(oxo) <Ácido Carboxílico NO2 O OH OH ácido 5-nitro-2-hidroxieptanóico Derivados Halogenados e Compostos Organometálicos Função Características R Haletos Orgânicos Compostos de Grignard(Organomagnesianos) R Nomenclatura Nome do halogênio + nome do hidrocarboneto X MgX Nome do halogênio(ETO) de Radical(IL) Magnésio Br Cl MgBr 3-cloro-2-metilpentano 4-bromoex-2-eno brometo de fenilmagnésio (H3C)2Hg (H3CCH2)4Pb tetraetilchumbo dimetilmercúrio www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 5 Exercícios 01 – (ITA) – A estrutura molecular da morfina está representada abaixo: CH3 N H H O O O H Assinale a opção que apresenta dois grupos funcionais presentes nesta substância. a) Álcool e éster b) Amina e éter c) Álcool e cetona d) Ácido carboxílico e amina e) Amida e éster 02 – Quando há picada de formigas em alguma pessoa , é colocada álcool etílico, porque: a) As formigas não suportam o álcool b) Não há ácido fómico nas formigas ,pois o que causa a dor é uma mistura de aminoácidos desconhecidos c) O álcool dissolve o enxofre existente no ácido que a formiga libera d) O álcool etílico contém sódio metálico que o torna anestésico e) O ácido fórmico, existente nas formigas,reage com o álcool etílico originando o éster formiato de etila ,que evapora mais rápido e não é tão agressivo quanto o ácido existente nas formigas. 03 – N a combustão completa do octeno ,a relação entre o número de mols de dióxido de carbono formado e o de oxigênio consumido é: a) 1/1 b) 2/3 c) 16/23 d) 16/25 e) 3/2 04 – Cloretos de Alquilas reage com magnésio segundo a reação abaixo: RCl + Mg RMgCl O produto formado reage com CO2 e HCl ,dando um ácido carboxílico conforme a equação global abaixo: RMgCl + CO 2 + HCl RCO 2H + MgCl2 Partindo do cloreto de etila , executando as reações acima descritas, será obtido o ácido: a) propanóico b) etanóico c) metanóico d) monocloetanóico e) dicloroetanóico www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 6 05 – Durante a Guerra do Vietnã , o chamado agente laranja ,que atuava côo desfolhante nas árvores da floresta , foi destaque , pois essa substância é altamente cancerígena. O O CH2 C OH Cl Cl Agente Laranja As funções presentes na molécula deste composto são: a) éster , ácido carboxílico e hidrocarboneto b) éter , haleto orgânico e ácido carboxílico c) tiocomposto , ácido carboxílico e amida d) amina , ácido carboxílico e álcool e) ácido carboxílico , éter e nitrocomposto 06 –Um inseticida natural é a piretrina,que é extraída de uma espécie de crisântemo denominado piretro.A obtenção da piretrina se concentra no Rio Grande do Sul e sua estrutura pode ser representada por: CH3 O H3C O CH C CH3 C CH3 CH3 H2C CH CH CH CH2 O a) Escreva o nome das funções orgânicas presentes na piretrina. b) Calcule o teor de carbono presente nessa substância. 07 – Três líquidos puros apresentam as propriedades da tabela: Líquido Ponto de Ebulição(OC) A 36,2 B 34,6 C 117,7 a) Estabeleça uma associação de cada líquido, A , B e C , com as substâncias n-butanol, n-pentano e etoxietano. b) Coloque as substâncias A ,B e C em ordem crescente de suas solubilidades em água. 08 – A oxidação do cumeno (isopropilbenzeno) é método industrial de produção de fenol e acetona. H H3C C HO CH3 + O2 + H3C C CH3 O Calcule a quantidade de cumeno (em mol) que deve ser oxidado para se obter 100 mL de acetona. Massa molar da acetona = 58g/mol Densidade da acetona = 0,80g/mL www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 7 Gabarito: Questão Gabarito 06 – a) Cetona e Ester b) 01 B 02 E 03 B 04 A 05 B Fórmula Molecular =C21H28O3 Massa Molar = 21(12)+28(1)+3(16) = 252+28+48 = 328g/mol %C = 252 x 100 = 76,83% 328 07 – a) A = n-pentano b) A<B<C B = etoxotano C = n-butanol 08 - Fórmula Molecular =C3H6O Massa Molar = 3(12)+6(1)+1(16) = 58g/mol 1 mol de cumeno----------58g de acetona x mol de acetona----------(0,8g/mL)(100mL) x = 1,38 mol 80g www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 8 www.seiensina.com.br Ensino de qualidade 24 horas no ar – www.sistemasei.com.br Página 9
Baixar