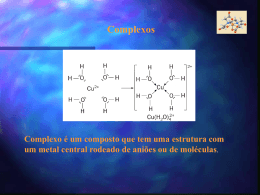
Substâncias iónicas Fenómenos eléctricos Para verificares a existência de cargas eléctricas, basta observares alguns fenómenos: Actividade 1: A caneta friccionada 1. Corta pedacinhos de papel e coloca em cima da mesa. 2. Fricciona uma caneta nas calças. 3. Agora tenta apanhar os pedacinhos de papel com a caneta. Actividade 2: O pente que atrai a água O que é preciso Garrafa de plástico Agulha Pente de plástico Água Corante O que se faz… 1. Faz um buraco a meio da garrafa com a ajuda da agulha. (o buraco deve ter um diâmetro pequeno) 2. Enche a garrafa de água com corante. (a adição do corante é feita para tornar mais fácil a visualização do efeito) 3. Passa o pente no cabelo várias vezes. 4. Aproxima devagar o pente do fio de água. (vai aproximando aos poucos e verifica o que acontece ao jacto de água) O que aconteceu ao jacto de água? Porquê? Conclusão O pente de plástico adquire electricidade estática ao pentear o cabelo, ou seja, o pente adquire carga eléctrica negativa. O jacto de água é constituído por moléculas e é muito fino. Este pode ser atraído pela carga eléctrica presente no pente, sofrendo uma alteração de direcção. À medida que vamos repetindo as aproximações do pente ao fio de água, a carga vai gradualmente desaparecendo, sendo o efeito cada vez menor. Conclusão Para explicar estes fenómenos diz-se que os materiais quando friccionados adquirem cargas eléctricas – ficam electrizados. Só há dois tipos de interacção – atracção ou repulsão, logo há dois tipos de cargas eléctricas: Cargas eléctricas positivas Cargas eléctricas negativas Cargas eléctricas do mesmo sinal repelem-se Cargas eléctricas do sinal contrário atraem-se Constituição do átomo Protões Núcleo carga positiva Carga positiva Neutrões Sem carga Electrões Carga negativa Os átomos são corpúsculos electricamente neutros. As moléculas por serem formadas por átomos também são neutras. número protões = número electrões O que são iões? Os iões são corpúsculos portadores de carga eléctrica que pode ser positiva ou negativa. Os iões com carga eléctrica negativa chamam-se iões negativos ou aniões. Os iões com carga eléctrica positiva chamam-se iões positivos ou catiões. Nos iões número protões número electrões O que são iões? Os iões resultam de átomos ou grupos de átomos que ganham ou perdem electrões. Os iões que resultam de átomos chamam-se iões monoatómicos. Os iões que resultam de grupos de átomos chamam-se iões poliatómicos. Os átomos e os grupos de átomos que ganham electrões originam iões negativos Quando um átomo ganha 1 electrão origina um ião de carga 1- Quando um átomo ganha 2 electrões origina um ião de carga 2- Os átomos e os grupos de átomos que perdem electrões originam iões positivos Quando um átomo perde 1 electrão origina um ião de carga 1+ Quando um átomo perde 2 electrões origina um ião de carga 2+ Como se representam simbolicamente os iões Regras: Se os iões são positivos, coloca-se o número de cargas positivas em excesso no canto superior direito do símbolo do elemento. O número de cargas positivas indica o número de electrões que o átomo perdeu. Se os iões são negativos, coloca-se o número de cargas negativas em excesso no canto superior direito do símbolo do elemento. O número de cargas negativas indica o número de electrões que o átomo ganhou. Ião Sódio Representação simbólica Na+ Símbolo químico do sódio Carga do ião (a carga é 1+, mas o valor um nunca se escreve) Na+ representa um ião monoatómico positivo (carga 1+) O ião sódio resulta de um átomo de sódio que perdeu um electrão. Ião ferro (III) Representação simbólica Fe3+ Símbolo químico do ferro Carga do ião Fe3+ representa um ião monoatómico positivo (carga 3+) O ião ferro (III) resulta de um átomo de ferro que perdeu três electrões. Ião cloreto Representação simbólica ClSímbolo químico do cloro Carga do ião (a carga é 1-, mas o valor um nunca se escreve) Cl- representa um ião monoatómico negativo (carga 1-) O ião cloreto resulta de um átomo de cloro que ganhou um electrão. Ião óxido Representação simbólica O2Símbolo químico do oxigénio Carga do ião O2- representa um ião monoatómico negativo (carga 2-) O ião óxido resulta de um átomo de oxigénio que ganhou dois electrões. Ião amónio Representação simbólica NH4+ Representação do agregado de átomos Carga do ião NH4+ representa um ião poliatómicos positivo (carga 1+) O ião amónio resulta de um agregado formado por 1 átomo de azoto e 4 átomos de hidrogénio, após perder um electrão. Ião carbonato Representação simbólica CO32Representação do agregado de átomos Carga do ião CO32- representa um ião poliatómico negativo (carga 2-) O ião carbonato resulta de um agregado formado por 1 átomo de carbono e 3 átomos de oxigénio, após captar dois electrões. Tabela de iões Iões positivos - Catiões Iões negativos - Aniões Nome Representação simbólica Nome Representação simbólica Ião alumínio Al3+ Ião brometo Br- Ião cálcio Ca2+ Ião cloreto Cl- Ião chumbo Pb2+ Ião iodeto I- Ião cobre (II) Cu2+ Ião óxido O2- Ião cobre (III) Cu3+ Ião bicarbonato HCO3- Ião ferro (II) Fe2+ Ião carbonato CO32- Ião ferro (III) Fe3+ Ião dicromato Cr2O72- Ião magnésio Mg2+ Ião fosfato PO43- Ião níquel Ni2+ Ião hidróxido HO- Ião potássio K+ Ião nitrato NO3- Ião prata Ag+ Ião nitrito NO2- Ião sódio Na+ Ião permanganato MnO4- Ião zinco Zn+ Ião sulfato SO42- Ião amónio NH4+ Ião sulfito SO32- Fórmulas químicas de substâncias iónicas Regras: Na fórmula química escreve-se: Primeiro a representação simbólica do ião positivo (catião) Segundo a representação simbólica do ião negativo (anião) O número de cargas positivas tem de ser igual ao número de cargas negativas para que o conjunto seja electricamente neutro. A leitura do nome da substância começa pelo nome do ião negativo seguindo-se-lhe o nome do ião positivo separados por “de”. Cloreto de sódio Iões sódio Na+ Iões cloreto Cl- Na+ Cl- Para neutralizar a carga 1+ de um ião positivo é necessária a carga 1- de um ião negativo (+1) + (-1) = 0 NaCl A proporção de combinação dos iões no cloreto de sódio é de 1 ião positivo para cada ião negativo: 1 : 1 Cloreto de níquel (II) Iões níquel Ni2+ Iões cloreto Cl- Ni2+ (Cl-)2 Para neutralizar a carga 2+ de um ião positivo e necessária a carga 2- que corresponde a dois iões negativos 1 x (+2) + 2 x (-1) = 0 NiCl2 A proporção de combinação dos iões no cloreto de níquel é de 1 ião positivo para 2 iões negativos: 1 : 2 Sulfato de Alumínio (Al3+)2 (SO42-)3 Para que as cargas se neutralizem temos que combinar a carga 6+, correspondente a dois iões positivos, com a carga 6-, correspondente a três iões negativos. Al2(SO4)3 2 x (+3) + 3 x (-2) = 0 Iões Alumínio Al3+ Iões sulfato SO42- A proporção de combinação dos iões no sulfato de alumínio é de 3 iões positivos para 2 iões negativos: 2 : 3 Condutibilidade eléctrica Podemos provar a existência de iões através de experiências de condutibilidade eléctrica. Actividade 3: Condutibilidade eléctrica do cloreto de sódio O cloreto de sódio: no estado sólido, é um mau condutor eléctrico porque não conduz a corrente eléctrica, logo a lâmpada não acende. em solução aquosa, conduz a corrente eléctrica, logo a lâmpada acende porque os iões do cristal separam-se uns dos outros, sendo atraídos para os respectivos eléctrodos, isto é, os catiões são atraídos para eléctrodo negativo e os aniões para eléctrodo positivo.
Baixar