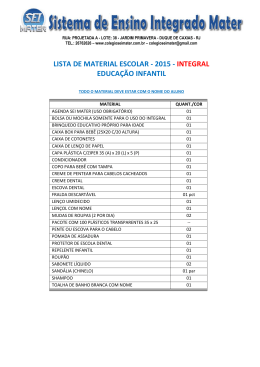
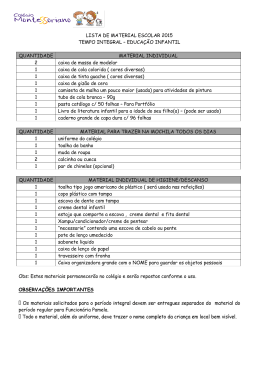
28 PROVA DE QUÍMICA II QUESTÃO 47 Analise a estrutura do composto a seguir. Considerando-se esse composto e outros conhecimentos, é INCORRETO afirmar que: a) b) c) d) apresenta fórmula molecular igual a C8H6O3Cl2. verifica-se a existência dos grupos funcionais éter e ácido carboxílico. soluções aquosas desse composto terão pH menor do que 7. apresenta um carbono assimétrico e um anel aromático. QUESTÃO 48 Em um creme dental, encontra-se um teor de cálcio de 8,0 mg desse elemento por grama de creme dental. O cálcio adicionado está contido no composto fluoreto de cálcio. A quantidade de fluoreto de cálcio, em gramas, utilizado na preparação de 200 gramas desse creme dental, é igual a: a) b) c) d) 3,12 2,36 1,56 1,18 29 QUESTÃO 49 O funcionamento dos air-bags nos automóveis é resultado de esforços combinados de químicos e engenheiros e já salvou milhares de vidas no mundo. O sistema é ativado por sensores que detectam uma colisão e iniciam a explosão elétrica de uma pequena carga. Isso, por sua vez, desencadeia a transformação química de uma substância, geralmente a azida (NaN3) em gás nitrogênio e sódio metálico. Como tanto a azida quanto o sódio metálico são tóxicos, o KNO3 entra na composição em ligeiro excesso para consumir todo o sódio produzido, liberando mais gás nitrogênio, que preenche uma bolsa plástica. Esse processo pode ser representado pelas seguintes equações: 10 NaN3(s) → 10 Na(s) + 15 N2(g) 10 Na(s) + 2 KNO3(s) → K2O(s) + 5 Na2O(s) + N2(g) Considerando-se essas informações, o volume total de gás nitrogênio, em litros, produzido nas CNTP, quando 650 g de azida reagem completamente no processo, é igual a: a) b) c) d) 22,40 224,0 336,0 358,4 QUESTÃO 50 O pastor anglicano J. Priestley (1733-1780) foi um dos descobridores do oxigênio, produzindo O2 a partir do aquecimento de HgO sobre Hg (mercúrio) líquido. Considere o equilíbrio associado a essa transformação: Hg (l) + 21 O 2(g) → ← HgO (S) I II Hg(l) HgO(s) O equilíbrio acontecerá nos frascos: a) b) c) d) I, II, III e IV. I, II e IV apenas. I e IV apenas. II, III e IV apenas. III HgO(s) IV Hg(l) 30 QUESTÃO 51 A síntese da amônia permitiu o desenvolvimento dos fertilizantes nitrogenados sintéticos, que hoje garantem a produtividade de quase metade de toda a agricultura mundial. Atualmente o mais importante método de obtenção da amônia é o processo de Haber-Bosch, altamente exotérmico, no qual os gases nitrogênio e hidrogênio são combinados diretamente a uma pressão de 20 MPa e temperatura de 500°C, utilizando o ferro como catalisador. Assinal e o equilíbrio que representa CORRETAMENTE esse processo. a) N 2 ( g) + 3H 2( g) → ← 2NH 3 ( g) b) N 2 ( g) + 3H 2( g) → ← 2NH 3 ( g) ∆H = −92kJ c) 2Ni ( g) + 3H 2( g) → ← 2NiH 3 ( g) ∆H = +92kJ d) 2Ni ( g) + → ← 2NiH 3 ( g) 3H 2( g) ∆H = +92kJ ∆H = −92kJ QUESTÃO 52 −2 A reação 4 Ag ( s) + O 2( g) + 2S aq + 4H (+aq) → 2 Ag 2 S ( s) + 2H 2 O (l) representa o processo de escurecimento da prata em contato com oxigênio e com compostos sulfurados. É INCORRETO afirmar que: a) b) c) d) o agente oxidante dessa reação é o oxigênio. a prata metálica sofre oxidação durante o processo de escurecimento. o sulfeto de prata é muito solúvel em meio aquoso. 4 elétrons participam da reação. QUESTÃO 53 O gráfico representa a pressão de vapor, em atm, em função da temperatura, em ºC, de três amostras: I , II e III. Se uma dessas amostras for de água pura e as outras duas de água salgada, é CORRETO afirmar que: a) b) c) d) a amostra I é a amostra de água salgada mais concentrada. a amostra III apresenta a menor temperatura de ebulição a 1 atm. a amostra III é mais concentrada que a amostra II. a ordem crescente de volatilidade para essas amostras é I < II < III . 31
Baixar