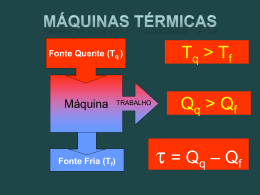
TERMODINÂMICA Termodinâmica é a ciência que trata • do calor e do trabalho • das características dos sistemas e • das propriedades dos fluidos termodinâmicos Alguns ilustres pesquisadores que construíram a termodinâmica James Joule 1818 - 1889 Sadi Carnot 1796 - 1832 Emile Claupeyron 1799 - 1864 Wiliam Thomson Lord Kelvin 1824 - 1907 Rudolf Clausius 1822 - 1888 Contribuição de James Joule. 1839 Experimentos: trabalho mecânico, eletricidade e calor. James P. Joule (1818-1889) Nasceu em Salford - Inglaterra 1840 Efeito Joule : Pot = RI2 1843 Equivalente mecânico do calor ( 1 cal = 4,18 J) 1852 Efeito Joule-Thomson : decréscimo Lei da Conservação de Energia da temperatura de um gás em função da expansão sem realização de trabalho externo. As contribuições de Joule e outros levaram ao 1a Lei surgimento de uma nova da disciplina: Termodinâmica a Termodinâmica Para entender melhor a 1a Lei de Termodinâmica é preciso compreender as características dos sistemas termodinâmicos e os caminhos “percorridos” pelo calor... Sistema Termodinâmico Certa massa delimitada por uma fronteira. Vizinhança do sistema. O que fica fora da fronteira Sistema isolado Sistema fechado Sistema que não troca energia nem massa com a sua vizinhança. Sistema que não troca massa com a vizinhança, mas permite passagem de calor e trabalho por sua fronteira. Transformação Variáveis de estado Variáveis de estado P1 V1 T1 U1 Estado 1 P2 V2 T2 U2 Transformação Estado 2 Processos Processos Durante a transformação Isotérmico temperatura constante Isobárico pressão constante Isovolumétrico volume constante Adiabático É nula a troca de calor com a vizinhança. Transformações 1a Lei da Termodinâmica Sistema Fechado τ τ > 0 → energia que sai do sistema τ < 0 → energia que entra no sistema Q > 0 → calor que entra no sistema Q < 0 → calor que sai do sistema ΔU = U2 – U1 Variação Energia Interna 1a Lei Q = τ + ΔU Variação da Energia Interna ∆U = Q - τ Gás Expansão nula τ=0 ΔT = 0 → ΔU = 0 ΔT > 0 → ΔU > 0 ΔT < 0 → ΔU < 0 ΔU depende apenas de ΔT. Como U é uma variável de estado, ΔU não depende do processo. A energia interna de um gás é função apenas da temperatura absoluta T. O calor Q que passa pelas fronteiras do sistema depende do processo. τ Q= τ + ∆U τ = p . ∆V depende de como a pressão e volume mudam no processo. ∆V = V2 -V1 Processo isobárico τ Transformação a pressão constante 1ª Lei da Termodinâmica U = Q - τ Processo isovolumétrico Transformação a volume constante ∆V = 0 τ =0 1ª Lei da Termodinâmica U = Q Processo Isotérmico Transformação a temperatura constante τ ∆U = 0 → ∆T=0 1ª Lei da Termodinâmica Q= τ Processo adiabático O processo ocorre tão rapidamente que o sistema não troca calor com o exterior. τ Q=0 1ª Lei da Termodinâmica U = - τ Máquinas Térmicas “Trabalham” em ciclos. A máquina de Denis Papin 1647 - 1712 Trabalho Para onde a máquina rejeita calor QCold Fonte quente Fonte fria De onde a máquina retira calor QHot. Ciclo Eficiência térmica: 1ªLei Em cada ciclo τ τ = Q1 – Q2 Ciclo Refrigerador Quando expandimos um gás, sua pressão diminui, assim como sua temperatura. Por um cano fino que passa pelo interior da geladeira, um gás É solto e se expande a baixa pressão. Nessa expansão, a temperatura do gás diminui. Com isso, o gás retira calor do ambiente que está a sua volta, ou seja, do interior da geladeira. Um compressor que está na geladeira comprime o gás (freon, em geral) que se encontra numa câmara. Atrás da geladeira existe outro cano, fino e comprido, por onde o gás sai do interior da geladeira. Ele libera o calor para a atmosfera, para novamente repetir o processo. 1) ADMISSÃO A válvula de admissão se abre, a mistura de ar+combustível entra no cilindro enquanto o pistão (ou êmbolo) desce. 3) EXPLOSÃO A vela de ignição dispara uma centelha elétrica provocando a combustão rápida (explosão) da mistura ar+combustível. Essa explosão gera calor e a conseqüente expansão dos gases dentro do cilindro, empurrando para baixo o pistão. Note que, dos quatro tempos, esse é o tempo em que há realização de trabalho feito pelo gás. 2) COMPRESSÃO A válvula de admissão se fecha, o pistão sobe, comprimindo no alto do cilindro a mistura ar+combustível. Como essa é uma compressão muito rápida, não há tempo de haver troca de calor entre a mistura combustível e o ambiente, isto é, trata-se de uma compressão adiabática e por causa disso, a temperatura da mistura aumenta. 4) DESCARGA (OU EXAUSTÃO) A válvula de descarga se abre enquanto o pistão sobe empurrando o gás queimado (fumaça) para fora do cilindro. A máquina ideal de Carnot O rendimento da Máquina de Carnot Ciclo reversível No ciclo: ∆U=0 → BC e DA = adiabáticas τ =Q η = τ/Q1 = [Q1-Q2]/Q1 1 - Q2 = 1 - Q2/Q1 Q2/Q1 = T2/T1 η = (1 - Q2/Q1) = (1 - T2/T1) η = 1 - T2/T1 Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T1 e T2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios" Transformações máquinas térmicas - Diagrama PV
Download