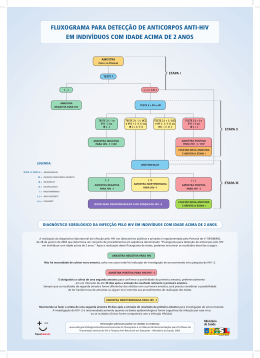
Informati Informativo Digital - Nº 11 - Novembro/2009 Diagnóstico Laboratorial da Infecção pelo HIV Dra. Lilian Mello Soares e Dr. Guilherme Birchal Collares Assessoria Médica Lab Rede O acompanhamento continuado das recomendações vigentes para a abordagem laboratorial da infecção pelo HIV é essencial para uma atuação profissional responsável e eficiente. Em 16 de outubro de 2009, entrou em vigor a Portaria SVS/MS Nº151, de 14 de outubro de 2009, em que a Secretaria de Vigilância em Saúde aprova o Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 meses, e determina o uso do Teste Rápido para o diagnóstico em situações especiais. Na grande maioria dos pacientes, o diagnóstico será feito pela detecção de anticorpos anti-HIV, que aparecem no sangue de adultos infectados, em média, 3 a 12 semanas após a infecção e permanecem indefinidamente. Segundo a Portaria Nº151, inicialmente, deve ser realizada uma triagem (Etapa I), com um teste capaz de detectar anticorpos anti-HIV-1, incluindo o grupo O, e anticorpos anti-HIV-2. Entre as metodologias permitidas estão ensaios imunoenzimáticos, testes rápidos, entre outros. Se o resultado for não reagente, a amostra é considerada “Não Reagente para o HIV”. Se for indeterminado, nova amostra deve ser coletada e submetida ao Fluxograma. Se o resultado persistir indeterminado, o laudo deve ser liberado como “Amostra Indeterminada para o HIV”. Em gestantes com resultado indeterminado na primeira amostra, deverão ser solicitados também testes moleculares para auxiliar o diagnóstico. Em caso de resultado reagente na Etapa I, a amostra deve ser submetida à Etapa II (Complementar), em que as metodologias permitidas são Imunofluorescência Indireta (IFI), Imunoblot (IB), Western Blot (WB), entre outras. O teste Western Blot será considerado positivo se houver reatividade em pelo menos duas das proteínas: p24, gp41, gp120/160. Quando há qualquer padrão de reatividade diferente deste, a amostra é indeterminada. Na ausência de reatividade, a amostra é considerada negativa. Se na Etapa II o resultado for não reagente ou indeterminado, a amostra é considerada “Indeterminada para o HIV”. Se o resultado for . reagente, a amostra será considerada “Reagente para o HIV”, e para comprovação do diagnóstico laboratorial, uma segunda amostra deverá ser coletada e submetida à Etapa I, para descartar a possibilidade de troca de amostras. O pedido do exame deve ser identificado como segunda amostra, para finalização do Fluxograma e definição do resultado, caso ele seja reagente. O diagnóstico rápido da infecção pelo HIV deverá ser feito exclusivamente com testes rápidos validados pelo Ministério da Saúde, e poderá ser realizado em situações especiais, como: redes de serviço de saúde sem infraestrutura laboratorial ou em regiões de difícil acesso, centros de testagem e aconselhamento, segmentos populacionais flutuantes ou mais vulneráveis, parceiros de pessoas com HIV/AIDS, acidentes biológicos ocupacionais (teste no paciente fonte), gestantes não testadas no pré-natal, entre outras. A amostra com resultado reagente em um primeiro Teste Rápido (TR1), deverá ser submetida a um segundo (TR2). Se o resultado de um dos testes for inválido, ele deve ser repetido com o mesmo conjunto, de lote distinto, se possível. Se o resultado inválido persistir, ou se os resultados forem discordantes entre TR1 e TR2, deverá ser coletada uma amostra por punção venosa e submetida ao Fluxograma Mínimo. Será considerada “Reagente para o HIV” a amostra com resultados reagentes no TR1 e TR2. Em pacientes com resultados não reagentes ou indeterminados, em que persiste a suspeita de infecção, nova amostra deve ser coletada 30 dias após a primeira, repetindo-se os procedimentos descritos, para investigar soroconversão, A ocorrência de resultados indeterminados ou falso-positivos é maior em gestantes ou portadores de algumas enfermidades. Nessas situações, a avaliação conjunta da história clínica, do risco de exposição ao HIV e o resultado laboratorial devem orientar as decisões. Em crianças com menos de 18 meses, a detecção de anticorpos anti-HIV-1 não caracteriza infecção, devido à transferência de anticorpos maternos, sendo necessários outros testes complementares. REFERÊNCIAS 1.Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Portaria SVS/MS Nº151, de 14 de outubro de 2009. Disponível em: http://www.aids.gov.br. 2.Erichsen ES, Viana LG, Faria RMD, Santos SME. Medicina Laboratorial para o Clínico. Belo Horizonte: Coopmed, 2009.
Baixar