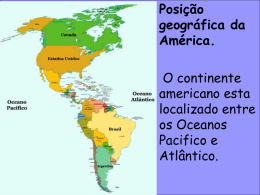
GASES Capítulo 10 Seminário de Química Professor Élcio Rogério Barrak Bruna Almeida Marra – 17018 Tereza Raquel Arantes Barbará – 17030 Introdução Bruna Almeida Marra Tereza Raquel A Barbará 2/32 Características gerais dos gases • Altamente expansíveis • Baixa densidade • Altamente compressíveis • Grande difusibilidade • Alta dilatabilidade Bruna Almeida Marra Tereza Raquel A Barbará 3/32 Principais compostos gasosos à temperatura ambiente Bruna Almeida Marra Tereza Raquel A Barbará 4/32 CH4 - Metano Bruna Almeida Marra Tereza Raquel A Barbará 5/32 CO2 – Dióxido de carbono Bruna Almeida Marra Tereza Raquel A Barbará 6/32 C3H8 - Propano Bruna Almeida Marra Tereza Raquel A Barbará 7/32 N2O – Óxido nitroso Bruna Almeida Marra Tereza Raquel A Barbará 8/32 NO2 – Dióxido de nitrogênio 2 NO2(g) + H2O(l) HNO2(aq) + HNO3(aq) Bruna Almeida Marra Tereza Raquel A Barbará 9/32 Pressão Os gases exercem pressão sobre a superfície com a qual estão em contato. F P A Patm = 1 x 105 N/m² = 1 x 105 Pa = 760 mmHg = 760 torr = 1 atm Bruna Almeida Marra Tereza Raquel A Barbará 10/32 Pressão atmosférica Bruna Almeida Marra Tereza Raquel A Barbará 11/32 Barômetro Bruna Almeida Marra Tereza Raquel A Barbará 12/32 Manômetro Bruna Almeida Marra Tereza Raquel A Barbará 13/32 Lei de Boyle Bruna Almeida Marra Tereza Raquel A Barbará 14/32 Lei de Charles Bruna Almeida Marra Tereza Raquel A Barbará 15/32 Lei de Avogadro “O volume de um gás mantido a temperatura e pressão constantes é diretamente proporcional à quantidade de matéria do gás” V n 6,02 x 1023 moléculas = 22,4 L (CNTP) Bruna Almeida Marra Tereza Raquel A Barbará 16/32 Lei dos gases ideais Bruna Almeida Marra Tereza Raquel A Barbará 17/32 Densidade de um gás PV nRT m PV RT M PM d RT PM m RT V Bruna Almeida Marra Tereza Raquel A Barbará 18/32 Air Bag 2 NaN 3( s ) 2 Na ( s ) 3N 2 Bruna Almeida Marra Tereza Raquel A Barbará 19/32 Mistura de gases e pressões parciais n1 RT P1 n1 V Pt ntRT nt V Bruna Almeida Marra Tereza Raquel A Barbará 20/32 FRAÇÃO EM QUANTIDADE DE MATÉRIA Gasodutos Bruna Almeida Marra Tereza Raquel A Barbará 21/32 Teoria cinética molecular • Partículas em movimento contínuo e aleatório; • Colisões perfeitamente elásticas; • Energia cinética média das moléculas proporcional à temperatura absoluta. Bruna Almeida Marra Tereza Raquel A Barbará 22/32 Efusão e difusão molecular • Efusão: Fuga das moléculas de um gás de um lugar de maior pressão para um de menor, através de um pequeno orifício. • Difusão: Espalhamento de uma substância no espaço ou em uma segunda substância. 3RT u M Bruna Almeida Marra Tereza Raquel A Barbará u representa a velocidade quadrática média (vqm). 23/32 Efusão e difusão molecular Fração de moléculas dentro do limite de 10 m/s da velocidade indicada Bruna Almeida Marra Tereza Raquel A Barbará 24/32 Lei de Graham r1 r2 M2 M1 Bruna Almeida Marra Tereza Raquel A Barbará 25/32 Gases reais: desvios do comportamento ideal PV n RT A altas pressões o desvio de comportamento ideal n 1 é grande e diferente para cada gás. Bruna Almeida Marra Tereza Raquel A Barbará 26/32 Gases reais: desvios do comportamento ideal Bruna Almeida Marra Tereza Raquel A Barbará 27/32 Gases reais: desvios do comportamento ideal Bruna Almeida Marra Tereza Raquel A Barbará 28/32 Equação de Van der Waals a e b são constantes particulares de cada gás. Bruna Almeida Marra Tereza Raquel A Barbará 29/32 Equação de Van der Waals Bruna Almeida Marra Tereza Raquel A Barbará 30/32 Exemplo Se 1,000 mol de um gás ideal estivesse confinado em um volume de 22,41 L a 0,0°C, exerceria uma pressão de 1 atm. Use a equação de Van der Waals e as constantes dadas para estimar a pressão exercida por 1,00 mol de Cl2(g) em 22,41 L a 0,0°C. L2 atm a 6,49 mol 2 Bruna Almeida Marra Tereza Raquel A Barbará e 31/32 L b 0,0562 mol Referências bibliográficas • Química: A Ciência Central, 9ª edição. Brown, LeMay, Bursten. • Princípios de Química, 3ª edição. Atkins, Peter; Jones Loretta. • Química Geral, Volume 1. Feltre, Ricardo. • images.google.com.br Bruna Almeida Marra Tereza Raquel A Barbará 32/32
Download