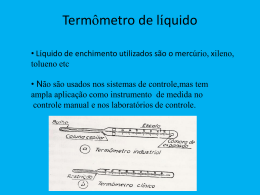
UNIOESTE - Universidade Estadual do Oeste do Paraná Campus Universitário de Foz do Iguaçu Curso Superior de Engenharia Elétrica Física II - Professora Nora Diaz Velazquez O funcionamento de um Termômetro a Gás Rafael Campagnaro de Mendonça Fevereiro – 2001 Introdução Antes de introduzir os conceitos necessários para o entendimento deste termômetro, é indispensável que tenhamos algum conhecimento de fluidos, pois o termômetro a gás tem como sua peça fundamental um manômetro de mercúrio. O funcionamento de um manômetro se baseia em princípios que deveriam ter sido estudados em fluidos antes do estudo de temperatura. Pois esta seqüência é adotada pela maioria dos livros e professores de física de todo o mundo, que ao longo de muitos anos de pesquisa, chegaram à conclusão de que esta seria a seqüência mais lógica para o entendimento da física, dado que grande parte das regras e leis da física têm ligação entre si. Foi assim que descobriram que não devemos estudar campo magnético antes de termos estudado campo elétrico, que por sua vez só deve ser estudado depois de se ter algum conhecimento de gravitação universal, pois desta maneira o estudante não seria capaz de analisar as grandes simetrias da física. Portanto não fugirei à regra neste trabalho e, por isso, explicarei o funcionamento de um manômetro, apresentando os conceitos de pressão e densidade e, depois sim, apresentarei o Termômetro a Gás. Densidade A densidade de uma substância é definida como sua massa por unidade de volume. Assim sendo, uma substância de massa m e volume V tem a densidade ρ dada por: m P= V A densidade é uma grandeza escalar; sua unidade no SI é o quilograma por metro cúbico. Ao se analisar a densidade de algumas substâncias, logo percebemos que a densidade dos gases varia consideravelmente com a pressão, mas a dos líquidos não. Isso é, gases são facilmente compressíveis, líquidos não. Pressão Definimos a pressão exercida por um fluido sobre um corpo como sendo a magnitude da força exercida pelo fluido por unidade de área: ∆F p= ∆A Teoricamente, a pressão em cada ponto do fluido é dada pelo limite desta razão quando a área A do corpo, centralizado naquele ponto, tende a zero. Entretanto se a força é exercida sobre um corpo cuja área é plana, obtemos apenas p=F/A. Sabe-se, por experiência, que qualquer que seja a orientação do corpo, a pressão exercida pelo fluido sobre ele sempre será a mesma, desde que a coluna de fluido sobre ele também seja a mesma. A unidade de pressão no SI é o Newton por metro quadrado, que recebe o nome especial de pascal (Pa). Medindo a Pressão O aparelho usado para medir a pressão exercida por qualquer fluido é chamado manômetro (quando um manômetro é usado para medir a pressão atmosférica, passa a ser chamado de barômetro). Muitas vezes, quando calibramos os pneus de um automóvel ou medimos nossa pressão sanguínea, não queremos saber a pressão absoluta, que é a pressão total (real). Em vez disso, estamos interessados apenas na chamada pressão manométrica pm, que é a diferença entre a pressão absoluta e a pressão atmosférica (pressão exercida pela atmosfera). Nos pneus inflados ou no sistema circulatório humano, a pressão (absoluta) é maior que a pressão atmosférica e, então, a pressão manométrica é uma quantidade positiva, às vezes chamada de sobrepressão. O contrario ocorre, por exemplo, em seus pulmões quando você suga através de um canudo e faz o fluido subir por ele. Neste caso a pressão absoluta em seus pulmões é menor do que a atmosférica, portanto a pressão manométrica é negativa. Um manômetro de tubo aberto mede diretamente a pressão manométrica. Ele consiste em um tubo em forma de U contendo um líquido, com uma das suas extremidades conectada ao recipiente de onde se quer medir a pressão, e a outra aberta à atmosfera. Como a pressão manométrica a uma dada profundidade de um fluido é a soma da pressão atmosférica mais a pressão exercida pela coluna de fluido(P=Patm+ρgh), então podemos aplicar o conceito de pressão absoluta: Pmanométrica=Pabsoluta - Patmosférica=ρgh Com isso conclui-se que a pressão manométrica é diretamente proporcional à altura da coluna de fluido. Agora que temos alguns conceitos básicos de estática dos fluidos, podemos avançar para o objetivo principal deste trabalho: O Termômetro a Gás. O Termômetro a Gás a Volume Constante A física afirma que a temperatura é uma grandeza fundamental, que pode ser usada nas leis da termodinâmica. Portanto, é absolutamente necessário que sua definição seja independente das propriedades de qualquer material, como ocorre com o termômetro de mercúrio, onde a temperatura depende exclusivamente do coeficiente de expansão térmica do mercúrio. O que precisamos é de um termômetro universal que independe do material usado. O termômetro a Gás atende a esta necessidade. O funcionamento de um Termômetro a Gás consiste basicamente em um bulbo ligado por um tubo capilar flexível a um manômetro (de tubo aberto) de mercúrio, como mostra a figura. Quando a substância que se deseja medir a temperatura entra em contato com o bulbo, o gás que está no interior tende a expandir, mas como o próprio nome do termômetro já diz, o gás deve ficar a volume constante. Para isso, basta levantar o abaixar o reservatório de mercúrio (tubo aberto), de modo que o volume de gás fique sempre constante (normalmente se usa uma escala e fixa-se o nível de mercúrio no zero, abaixando ou levantando o reservatório toda vez que a temperatura alterar). Com isso, ao se manter constante o volume, segundo a termodinâmica, cada grau de temperatura que o bulbo detectar, será usado para alterar a pressão do gás, ou seja, a pressão é proporcional à temperatura, e como a pressão é proporcional à altura da coluna de mercúrio (como vimos na Introdução), podemos concluir que a temperatura também é proporcional à essa altura. Portanto basta criarmos uma escala e medir essa altura, que obteremos um equivalente para a temperatura. Para calibrarmos este termômetro, poderíamos fazer como todos os outros termômetros. Escolheríamos o ponto de ebulição ou de solidificação da água e dividiríamos a escala em 100 partes. De qualquer forma, por várias razões técnicas, esses pontos são difíceis de se obter experimentalmente para um termômetro. Por isso, para essa nova escala baseada em um único ponto fixo foi adotada em 1954 pelo International Committee on Weights and Measures (Comitê Internacional de Pesos e Medidas). O ponto triplo da água foi adotado para esta escala por ser o mais conveniente, devido ao fato de água sólida, líquida e gasosa coexistirem em equilíbrio em uma dada temperatura e pressão (0,01°C a 0,61KPa). A temperatura de qualquer corpo em contato com o bulbo é definida por: T=Cp, onde p é a pressão exercida pelo gás e C é uma constante. Quando o bulbo está imerso numa célula de ponto triplo, temos: T3=Cp3 Com isso, ao eliminarmos C nas duas equações, obtemos: p T = T3 p3 Por experiência e conforme o gráfico mostrado abaixo, observamos que quanto menor for a quantidade de gás utilizada, mais facilmente conseguimos extrapolar a razão p/p3, ou seja, com o bulbo quase vazio, a temperatura de qualquer gás utilizado converge para um único valor, segundo a equação: T=T3(lim (p/p3) com m tendendo a 0) Um comportamento de gás como esse que foi descrito, é chamado em termodinâmica de temperaturas de gás ideal. De fato, quando observamos o gráfico podemos perceber que quanto menor for a pressão, independente do gás utilizado, a temperatura marcada é a mesma. Ainda analisando o gráfico podemos observar que o gás Hélio praticamente não altera o seu valor com o aumento da pressão, isso se deve ao fato de o gás Hélio ser um gás que se comporta praticamente como um gás ideal. Por isso o Termômetro a Gás a Volume Constante é o meio mais apropriado para se medir temperaturas sem obter muitos erros. Afinal, você pode usar qualquer gás e obter sempre o mesmo resultado. Expansão Térmica da Água O comportamento dos líquidos quando se trata de expansão térmica é semelhante ao dos sólidos. Existe um coeficiente de expansão volumétrica (o único parâmetro de expansão que faz algum sentido para os líquidos) que garante a proporcionalidade entre a variação de temperatura e a variação do volume. O líquidos geralmente aumentam seus volumes quando aumentam de temperatura, e têm seus respectivos coeficientes de expansão térmica quase dez vezes maiores do que os sólidos. A água, o mais comum dos líquidos, é uma exceção a essa regra, como podemos ver no gráfico a curva gerada para a água com densidade x temperatura (lembrando que densidade é o inverso do volume específico, o que daria um gráfico com concavidade voltada para cima). Observamos que à partir de 4°C a água se comporta como todos os outros líquidos, ou seja, seu volume aumenta com o aumento da temperatura. Mas de 0 a 4°C observamos que a água não expande e sim contrai, atingindo um máximo de densidade (ou mínimo de volume específico) em 1000Kg/m3 a 4°C. Isso explica porque os lagos congelam primeiro na superfície. Sabe-se que, por conveção, a agua mais fria é mais densa e, por isso, é mais pesada e desce para o fundo. Mas se toda a água fria descesse realmente para o fundo, teríamos lagos congelados por inteiro e não apenas na superfície. Isso não ocorre devido ao fato de a água, entre 0 e 4°C, ter um comportamento diferente, ou seja, ela se torna mais leve e não desce para o fundo, ficando na superfície, o que causa o congelamento superficial que pode ser visto por todos. Se a água não se comportasse dessa maneira, ao se congelar primeiro no fundo, dificilmente ela derreteria, pois a água de cima é um bom isolante térmico. Assim, muitas regiões dos oceanos, nas áreas mais frias da Terra, estariam congelados o ano inteiro, o que impediria a existência de toda a vida aquática que conhecemos. Isto posto, temos que agradecer à física por ter uma solução com um simples comportamento diferenciado que a água possui. Bibliografia SERWAY, Raymond – PHYSICS For Scientists & Engineers, third ed., Saunders College Publishing HALLIDAY RESNICK WALKER – Fundamentos de FÍSICA, vol 2, 4º ed.
Baixar