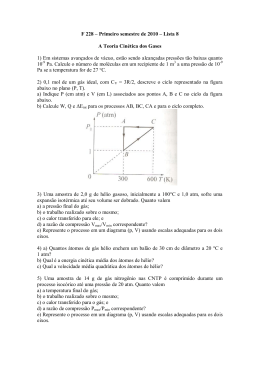
GASES IDEAIS 1- (UNIFOR) Para que a relação matemática P1V1 = P2V2, conhecida como Lei de Boyle para as transformações gasosas, seja válida é necessário que: I. A massa do gás seja constante II. A temperatura do gás seja constante III. O gás tenha comportamento ideal Dessas afirmações: A) Somente I é correta. B) Somente II é correta. C) Somente III é correta. D) Somente I e II são corretas. E) I, II e III são corretas. ____________________________________________________________________________ 2- (FURG) O ar é mistura de gases. Mais de 78% desta mistura é de nitrogênio. O oxigênio representa cerca de 21%. O argônio 0,9% e dióxido de carbono 0,03%. O restante é constituído de outros gases. O volume ocupado pelo oxigênio nessa mistura, em um ambiente de 10 L, é: A) 2,1 L B) 4,7L C) 10 L D) 17,7 L E) 22,4 L ____________________________________________________________________________ 3- (UFF) Num recipiente com 1,2 mL de capacidade, está contida certa amostra gasosa cuja massa exercia uma pressão de 685,0 mmHg, à temperatura de 22°C. Quando esse recipiente foi transportado com as mãos, sua temperatura elevou-se para 37° C e a pressão exercida pela massa gasosa passou a ser, aproximadamente: A) 0,24 atm B) 0,48 atm C) 0,95 atm D) 1,50 atm E) 2,00 atm ____________________________________________________________________________ 4- A pressão exercida por 10 g de hidrogênio, a 27 °C, contidas num recipiente com capacidade com capacidade de 8,2 L, é: A) 5,0 atm B) 10 atm C) 15 atm D) 30 atm E) 35 atm ____________________________________________________________________________ 5- (UNIFOR) Certa bola de árvore de Natal tem volume interno igual a 24,6 cm3. À temperatura de 27°C, e ao nível do mar, quantas moléculas dos gases componentes do ar há, aproximadamente, no interior dessa bola? A) 4,0 x 1026 B) 4,0 x 1023 C) 6,0 x 1026 D) 6,0 x 1023 E) 6,0 x 1020 ____________________________________________________________________________ 6- (UNIFOR) Uma ampola de 10 mL de capacidade foi preenchida com argônio, à pressão atmosférica ao nível do mar, a 27 °C e então fechada. A massa de argônio contida nessa ampola é, aproximadamente: Dados: Volume molar de gás nas condições indicadas = 25 L mol-1 Massa molar do argônio = 40 g mol-1 A) 10 mg B) 16 mg C) 40 mg D) 16 g E) 40 g ____________________________________________________________________________ -1- 7- (UNEMAT) Os dois balões abaixo representados contêm a mesma substância pura na fase gasosa e estão sob a mesma pressão. V1 = 1 L V2 = 4 L T1 = 27 ºC T2 = ? Qual a temperatura em Kelvin no balão II, se ele contém o triplo da massa de gás contida no balão I? A) 36 B) 127 C) 300 D) 309 E) 400 ___________________________________________________________________________ 8- (UNIFOR) Ao nível do mar e a 27 ºC um botijão de 25 litros, contendo GLP (butano + propano) foi utilizado para o aquecimento (combustão do gás) até sua exaustão. Aproximadamente, quantas moléculas ainda permanecem nesse botijão? A) 1 x 1022 B) 3 x 1022 C) 6 x 1022 D) 2 x 1023 E) 6 x 1023 ____________________________________________________________________________ 9- (FURG) Em 1937, o dirigível Hindenburgh, utilizando gás hidrogênio, foi totalmente destruído por um incêndio, após viagem entre a Europa e os Estados Unidos, durante o pouso em Lakehurst, estado de New Jersey. Esse dirigível continha aproximadamente 232 060 m3 de hidrogênio puro, sob uma temperatura de 10ºC e pressão de 1 atm. Que massa de hidrogênio foi totalmente queimada durante essa tragédia? Dado: R = 0,082 atm . L . mol-1 . K-1 A) 20,0 kg B) 10,0 x 103 kg C) 10,0 x 106 kg D) 20,0 x 106 kg E) 20,0 x 103 kg ____________________________________________________________________________ 10-(PUCRS) Um pneu de bicicleta é calibrado a uma pressão de 4 atm em um dia frio, à temperatura de 7ºC. Supondo que o volume e a quantidade de gás injetada são os mesmos, qual será a pressão de calibração nos dias em que a temperatura atinge 37 ºC? A) 21,1 atm B) 4,4 atm C) 0,9 atm D) 760 mm Hg E) 2,2 atm ____________________________________________________________________________ 11- (UNIAMAZONAS) Um gás perfeito mantido em um recipiente de volume V sob pressão P e possuindo temperatura T, teve sua pressão aumentada, à temperatura constante, até que esta se tornou o dobro da pressão inicial. Ao final do processo o gás estava: A) Com volume final igual a 2 V B) Com o volume final igual à metade de V C) Com o mesmo volume inicial D) Com a metade da temperatura T e do volume V E) Com volume final igual a ¼ V ____________________________________________________________________________ 12- (UNIFOR) A proporção, em mols de átomos, de neônio no ar atmosférico seco e não poluído é cerca de 12 ppm. Sendo assim, em 25 litros desse ar, nas condições ambiente de pressão e temperatura, quantos átomos existem de neônio? Dados: ppm = parte por milhão Constante de Avogadro = 6,0 x 1023 mol-1 Volume molar de gás, nas condições ambiente de p e T = 25 L/mol A) 3,6 x 10−20 B) 5,0 u 10−18 C) 5,0 x 1018 D) 7,2 x 1018 E) 7,2 x 1020 ____________________________________________________________________________ 13- (UNIFOR) São postulados da Teoria Cinética Molecular: -2- I. Um gás é constituído por partículas separadas, entre si, por distâncias bem maiores do que seu próprio tamanho. II. Cada partícula de gás se comporta como se estivesse sozinha, ou seja, na ausência de outras partículas. III. As partículas de gás ao chocarem-se, entre si, trocam energia; umas ganham, outras perdem energia. Está correto o que se afirma, SOMENTE em A) I B) II C) III D) I e II E) II e III ____________________________________________________________________________ 14- (UNIFOR) Amostras de ar atmosférico, não poluído e seco, contêm cerca de 3,5 × 10-2 %, em mols, de dióxido de carbono. Assim sendo, a pressão parcial desse composto, nessa amostra de ar atmosférico, é da ordem de Dado: A amostra foi coletada à pressão de 700 mmHg A) 25 mmHg B) 3,5 mmHg C) 2,5 mmHg D) 0,35 mmHg E) 0,25 mmHg ____________________________________________________________________________ 15- (FURG) Podemos dizer que um gás ideal, do ponto de vista microscópico, “é aquele em que não existem interações intermoleculares, e as moléculas possuem tamanho nulo”, isto é, são consideradas como pontos sem dimensão. O termo ideal, portanto, justifica-se diante do fato de essa definição ser totalmente irreal. (Peruzzo, Tito M. & Canto, E. L. Química: na abordagem do cotidiano. São Paulo : Moderna, 1993, 1. ed., p. 386.) Contudo, quando trabalhamos com gases reais sob determinadas condições, seu comportamento pode aproximar-se muito do gás ideal. A respeito desse comportamento podemos afirmar: I- Altas pressões favorecem o comportamento ideal. II- Uma baixa pressão implica moléculas mais afastadas, dificultando interações intermoleculares. III- Uma baixa temperatura implica uma maior agitação das moléculas do gás. IV- As interações intermoleculares no gás são dificultadas pelo aumento da temperatura. Estão corretas as afirmativas: A) I e II. B) I, II e III. C) II e IV. D) III e IV. E) IV. ____________________________________________________________________________ 16- (FURG) Considere a transformação isocórica para uma determinada massa de gás. Abaixo são apresentados os valores de pressões e de temperaturas para essa transformação. Pressão (mmHg) T (K) 1500 300 500 x y 12 z 5 Os valores de x, y e z que completam a tabela são, respectivamente, A) 100, 60, 25. B) 900, 37500, 90000. C) 150, 300, 100. D) 120, 250, 120. E) 150, 200, 100. ___________________________________________________________________________ 17- (ITA) Um cilindro provido de pistão contém água até a metade do seu volume. O espaço acima da água é ocupado por ar atmosférico. Para aumentar a quantidade de CO2 dissolvido na água alunos propuseram os seguintes procedimentos: I- Manter a temperatura constante e aumentar a pressão total introduzindo nitrogênio. II- Manter a temperatura constante e aumentar a pressão total introduzindo CO2. III- Manter a temperatura e a pressão constante e substituir parte do ar por CO2. IV- Manter a temperatura constante e diminuir a pressão total retirando oxigênio. V- Aumentar a temperatura e manter a pressão total constante, aumentando o volume do sistema. A) Apenas I e II. -3- B) Apenas II e III. C) Apenas I, II e III. D) Apenas I, III e IV. E) Apenas II, IV e V. ____________________________________________________________________________ 18- (ITA) Considere as afirmações abaixo relativas ao aquecimento de um mol de gás N2 contido em um cilindro provido de um pistão móvel sem atrito: I. A massa específica do gás permanece constante. II. A energia cinética média das moléculas aumenta. III. A massa do gás permanece a mesma. IV. O produto pressão versus volume permanece constante. Das afirmações feitas, estão CORRETAS: A) I, II e III. B) I e IV. C) II e III. D) II, III e IV. E) todas. ____________________________________________________________________________ 19- (UEM) Sabendo que, no ar seco, há 78% (em volume) de nitrogênio gasoso, a massa aproximada desse gás (N2) contida em um pneu que foi enchido com 100 litros de ar seco, a uma temperatura de 12oC, exercendo uma pressão total (ar) de 45 lb pol−2, será de (Considere N2 como gás ideal; 1 atm = 15 lb pol−2; constante dos gases ideais = 0,082 atm L K−1 mol−1.) A) 28 g. B) 28 Kg. C) 280 g. D) 280 Kg. E) 140 g. ____________________________________________________________________________ 20- (UERGS) Um determinado gás ocupa um volume V1 a uma dada temperatura T1 e à pressão P1. Essas condições iniciais são alteradas e esse mesmo gás fica submetido a uma pressão igual à metade da pressão inicial e sua temperatura fica elevada a quatro vezes a inicial. Com base nesses dados, pode-se afirmar que o volume final ocupado pelo gás será A) 2 V1 B) 4 V1 C) 5 V1 D) 6 V1 E) 8 V1 ____________________________________________________________________________ 21- (UERGS) Sob condição de temperatura e pressão constantes, entre as amostras de gases seguintes, a que apresentará o maior volume é: A) 100 g de O2. B) 100 g de CO2. C) 100 g de SO2. D) 50 g de H2. E) 50 g de N2. ____________________________________________________________________________ 22- (UERGS) Uma certa massa de He ocupa um volume de 5,0 L na temperatura de 25°C. Se esse gás for esfriado a −195°C, mantida constante a pressão, o volume aproximado do mesmo, em litros, será igual a A) 1,3. B) 2,7. C) 3,6. D) 5,0. E) 6,7. ____________________________________________________________________________ 23- (UFC) As pesquisas sobre materiais utilizados em equipamentos esportivos são direcionadas em função dos mais diversos fatores. No ciclismo, por exemplo, é sempre desejável minimizar o peso das bicicletas, para que se alcance o melhor desempenho do ciclista. Dentre muitas, uma das alternativas a ser utilizada seria inflar os pneus das bicicletas com o gás hélio, He , por ser bastante leve e inerte à combustão. A massa de hélio, necessária para inflar um pneu de 0,4 L de volume, com a pressão correspondente a 6,11 atm, a 25oC, seria: Constante universal dos gases: R = 0,082 L.atm.mol-1.K-1 A) 0,4 g B) 0,1 g C) 2,4 g D) 3,2 g E) 4,0 g ____________________________________________________________________________ 24- (UFC) O gráfico abaixo ilustra o comportamento referente à variação da pressão, em função do volume, de um gás ideal, à temperatura constante: -4- Analise o gráfico e assinale a alternativa correta. A) Quando o gás é comprimido nestas condições o produto da pressão pelo volume permanece constante. B) Ao comprimir o gás a um volume correspondente à metade do volume inicial, a pressão diminuirá por igual fator. C) Ao diminuir a pressão a um valor correspondente a 1/3 da pressão inicial, o volume diminuirá pelo mesmo fator. D) O volume da amostra do gás duplicará, quando a pressão final for o dobro da pressão inicial. E) Quando a pressão aumenta por um fator correspondente ao triplo da inicial, a razão P/V será sempre igual à temperatura. ____________________________________________________________________________ 25- Dois frascos de igual volume, mantidos à mesma temperatura e pressão, contêm, respectivamente, os gases X e Y. A massa do gás X é 0,34g, e a do gás Y é 0,48g. Considerando que Y é o ozônio (O3), o gás X é: A) N2 B) CO2 C) H2S D) CH4 E) H2 ____________________________________________________________________________ 26- Supondo um comportamento de gás ideal, assinale a opção que indica, aproximadamente, o peso em gramas, de 1,0 L de C3H8 nas CNTP: A) 2 . 10−3g B) 0,5 g C) 2 g D) 22,4 g E) 44 g ____________________________________________________________________________ 27- (UFPI) Compressores são máquinas que, na pressão atmosférica local, captam o ar, comprimindo-o até atingir a pressão de trabalho desejada. Ao nível do mar, a pressão atmosférica normal é 1,0 bar. Em equipamentos pneumáticos, a 25°C, a pressão mais utilizada é a de 6,0 bar. Nessas condições, e considerando o oxigênio (O2) como um gás ideal, calcule a massa aproximada de O2, em gramas, contida em um compressor de volume igual a 5,0 litros. A) 8,0 B) 16 C) 39 D) 47 E) 55 ____________________________________________________________________________ 28- (PUCSP) Em determinadas condições, o dióxido de nitrogênio (NO2) pode ser formado a partir de nitrogênio (N2) e oxigênio (O2). Considere um recipiente de 24 L com êmbolo móvel em que há uma mistura estequiométrica de nitrogênio (N2) e oxigênio (O2), ou seja, a pressão parcial de nitrogênio no recipiente é metade da pressão parcial do oxigênio. A quantidade máxima que pode ser obtida do gás dióxido de nitrogênio, mantidas as condições de temperatura e pressão, é A) 8 L. B) 12 L. C) 16 L. D) 24 L. E) 46 L. ____________________________________________________________________________ 29- Considere a mistura de 0,5 mol de CH4 e 1,5 mol de C2H6 contidos num recipiente de 30,0 litros a 300 k. O número total de moléculas no sistema é A) 2,0. B) 2,0 x 1023. C) 6,0 x 1023. D) 9,0 x 1023. E) 12 x 1023. ____________________________________________________________________________ 30- (UFV) A figura a seguir mostra um sistema de três balões de vidro contendo gás nitrogênio (N2) nas quantidades e nos volumes indicados. Esses balões são interligados por meio das torneiras T1 e T2 inicialmente fechadas. -5- Considerando que o N‚ comporta-se como um gás ideal e que a temperatura nos três balões é a mesma e permanece constante, analise as seguintes afirmativas: I. A pressão em B1 é igual à pressão em B2. II. Os produtos P1V1, P2V2 e P3V3 são iguais entre si. III. Se apenas a torneira T1, for aberta, a pressão em B2 ficará igual à pressão em B3. IV. Se apenas a torneira T2 for aberta, haverá difusão do gás de B3 para B2. V. Se as torneiras T1 e T2 forem abertas, o número de moles em B1 continuará sendo igual a 0,5. Assinale a alternativa CORRETA: A) Apenas as afirmativas III e IV são verdadeiras. B) Apenas as afirmativas II, IV e V são verdadeiras. C) Apenas as afirmativas I, II e III são verdadeiras. D) Apenas as afirmativas I, II, IV e V são verdadeiras. E) Todas as afirmativas são verdadeiras. ____________________________________________________________________________ 31- (FATEC) Dois recipientes A e B, de igual capacidade (V) e à mesma temperatura (T), contêm a mesma massa (m) dos gases H2 e Cl2. A esse respeito são feitas as afirmações: I. Em ambos os recipientes, a pressão exercida pelos gases H2 e Cl2 é a mesma. II. No recipiente A, que contém H2, a pressão é maior do que no recipiente B, que contém Cl2. III. Embora as massas sejam iguais, o número de partículas em A é maior do que em B. É correto o que se afirma apenas em: A) I. B) I e II. C) III. D) I e III. E) II e III. ____________________________________________________________________________ 32-(ABC) Um recipiente de volume constante contém 2,0 mols de um gás à pressão de 1,0 atmosfera e temperatura T. Se nesse recipiente forem introduzidos mais 2,0 mols do mesmo gás à mesma temperatura, a pressão sofrerá um acréscimo de: A) 0,5 atm B) 1,0 atm C) 1,5 atm D) 2,0 atm E) 2,5 atm ____________________________________________________________________________ 33-(PUC-SP) Um cilindro de 8,2 L de capacidade contém 320 g de gás oxigênio a 27°C. Um estudante abre a válvula do cilindro deixando escapar o gás até que a pressão seja reduzida para 7,5 atm. Supondo-se que a temperatura permaneça constante, a pressão inicial no cilindro e a massa de gás liberada serão, respectivamente, A) 30 atm e 240 g. B) 30 atm e 160g. C) 63 atm e 280 g. D) 2,7 atm e 20 g. E) 63 atm e 140 g. ____________________________________________________________________________ 34- (PUC-SP) Para a realização de um experimento, será necessário encher de gás um balão de 16,4 L que a 127°C suporta a pressão máxima de 2,0 atm. Nessas condições, a quantidade mais adequada para encher o balão é: A) 10 g de hidrogênio. B) 24 g de metano. -6- C) 45 g de etano. D) 64 g de dióxido de enxofre. E) 78 g de acetileno (etino). ____________________________________________________________________________ 35- Dois cilindros metálicos iguais contêm gases comprimidos em grau de elevada pureza, sendo que um deles contém 8m3 de gás nitrogênio, e o outro, 8m3 de gás hidrogênio. Considerando que os dois cilindros estão armazenados nas mesmas condições ambientais, podemos afirmar que A) a massa de gás armazenado é a mesma. B) a pressão do cilindro contendo nitrogênio é maior. C) o número de moléculas é o mesmo. D) a velocidade média das moléculas dos dois gases é igual. E) a temperatura interna dos cilindros é menor que a temperatura ambiente. ____________________________________________________________________________ 36- Considere dois recipientes de 50 L à pressão de 2 atm e à temperatura de 300K. O primeiro contém o gás hélio e o segundo o gás nitrogênio. Com base nessas informações podemos dizer: Dado: Constante dos gases ideais ( R ) = 0,082 atm.L.mol-1.K-1 A) a massa de hélio contida no recipiente é de 128 gramas; B) a densidade dos gases hélio e nitrogênio são iguais; C) o número de moléculas de N2 contida no recipiente é de 2,447 x 1024 moléculas; D) a massa de nitrogênio no recipiente é menor que a de hélio. E) ambos os recipientes possuem o mesmo número de átomos. ____________________________________________________________________________ 1-E 2-C 3-C 4-C 5-E 6-B 7-E 8-E 9-E 10-B 11-B 12-D 13-D 14-E 15-C 16-A 17-A 18-C 19-C 20-E 21-D 22-A 23-A 24-A 25-C 26-C 27-C 28-C 29-E 30-A 31-E 32-B 33-A 34-D 35-C 36-C -7-
Download