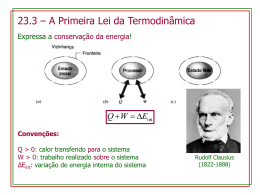
Calor Específico Molar, Transformações Adiabáticas e Expansão Livre quinta-feira, 12 de novembro de 2009 Revisando • Deduzimos que a temperatura determina a energia cinética média (via a velocidade média). • O modelo de gás ideal não considera a interação entre os átomos de um gás. quinta-feira, 12 de novembro de 2009 Da teoria cinética 2 nM vmed p= 3V Usando pV = nRT � 3RT vrms = = M 3kT Kmed = 2 3 Kmed = kT 2 � 3kT m Calor Específico Molar • Modelo • • • Gás ideal. Monoatomico (He, Ne, Ar). Eint é a soma das energias cinéticas de cada átomo. Sabemos que: Usando a 1a Lei Eint Eint 3 = (nNa ) kT 2 3 = nRT 2 Guarde esta expressão para depois! dQ ou Q = nCv ∆T nC = dT ∆Eint = Q − W = nCv ∆T − W quinta-feira, 12 de novembro de 2009 Calor Específico Molar: Cv ∆Eint = nCv ∆T − W Considere duas expansões isotérmicas: P V = nRT P V = cte 1 P ∝ V W=0 ∆Eint = nCv ∆T quinta-feira, 12 de novembro de 2009 Calor Específico Molar: Cv ∆Eint = nCv ∆T ou ∆Eint Cv = n∆T Portanto a variação da energia interna de uma gás ideal depende SOMENTE da variação da temperatura (note que esta afirmação vem da 1a lei e não do nosso modelo). 3 Retomando (agora do modelo): Eint = Usando: ∆Eint 3 = nR∆T 2 Substituindo acima temos: 2 nRT 3 Cv = R 2 Modelo quinta-feira, 12 de novembro de 2009 Calor Específico Molar: Cv É importante entender a diferença ∆Eint entre as expressões derivadas a partir do modelo e a partir da 1a lei. = nCv ∆T 3 Cv = R = 12, 5J/molK A primeira é geral e se aplica a 2 qualquer processo que produz variação de temperatura. O modelo 3 possui limitações. Quais são ? Eint = nRT 2 Gás monoatômico. Eint = nCv T Somente energia cinética. Em quais sistemas estas suposições são validas ? quinta-feira, 12 de novembro de 2009 Energia Interna ∆Eint = nCv ∆T Portanto a variação da energia interna de uma gás ideal depende SOMENTE da variação da temperatura. quinta-feira, 12 de novembro de 2009 Calor Específico Molar: Cv Molécula Monoatômica Exemplo Ideal Real Diatômico He 12,5 Ar 12,6 5/2R = 20,8 N2 20,7 O2 20,8 Ideal Real quinta-feira, 12 de novembro de 2009 3/2R = 12,5 Ideal Real Poliatômica Cv (J/mol.K) 3R = 24,9 NH4 29,0 CO2 29,7 Calor Específico Molar: Cp • E se tivermos um processo a pressão constante ? (W≠0) W = p∆V = nR∆T dQ = nCp dT ∆Eint = Q − W = nCp ∆T − nR∆T Como a energia interna de uma gás ideal depende somente da temperatura: ∆Eint quinta-feira, 12 de novembro de 2009 = nCv ∆T = nCp ∆T − nR∆T Calor Específico Molar: Cp ∆Eint = nCv ∆T = nCp ∆T − nR∆T Cv = Cp − R Graus de Liberdade • Correções ao modelo • As moléculas são capazes de armazenar energia interna em outras formas além da energia translacional! • Cv =3/2R é o valor de Cv para um sistema com três graus de liberdade! Translação em x, y e z. Quais são os outros graus de liberdade possíveis ? quinta-feira, 12 de novembro de 2009 Graus de Liberdade Molécula Monoatômica Exemplo Ideal Real Diatômico He 12,5 Ar 12,6 5/2R = 20,8 N2 20,7 O2 20,8 Ideal Real quinta-feira, 12 de novembro de 2009 3/2R = 12,5 Ideal Real Poliatômica Cv (J/mol.K) 3R = 24,9 NH4 29,0 CO2 29,7 Graus de Liberdade Translação 3 Translação 3 Rotação 2 Translação 3 Rotação 3 Todo tipo de molécula possui um certo número f de graus de liberdade, que são maneiras independentes de 1 guardar energia. RT Por grau de liberdade! 2 quinta-feira, 12 de novembro de 2009 Graus de Liberdade f De um modo geral: Cv = R 2 ou Eint f = nRT 2 número de graus de liberdade = f Molécula Monoatômica Exemplo Ideal Real Diatômico He 12,5 Ar 12,6 5/2R = 20,8 N2 20,7 O2 20,8 Ideal Real quinta-feira, 12 de novembro de 2009 3/2R = 12,5 Ideal Real Poliatômica Cv (J/mol.K) 3R = 24,9 NH4 29,0 CO2 29,7 Graus de Liberdade Poderíamos melhorar ainda mais a concordância com os valores de Cv se incluíssemos graus de liberdade internos! Entretanto o mundo microscópico é regido pela teoria quântica! Vibrações quinta-feira, 12 de novembro de 2009 Esta teoria diz que certos graus de liberdade só se tornam disponíveis quando a temperatura é elevada, e depende da massa dos elementos constituintes do sistema. Quanto menor a massa, mais elevada deve ser a temperatura para ativar tais graus de liberdade. Graus de Liberdade quinta-feira, 12 de novembro de 2009 Expansão Adiabática Queremos demonstrar que: quinta-feira, 12 de novembro de 2009 pV γ = cte Cp γ= Cv Expansão Adiabática γ pi V i quinta-feira, 12 de novembro de 2009 = γ pf V f
Baixar