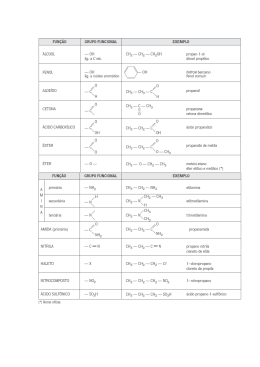
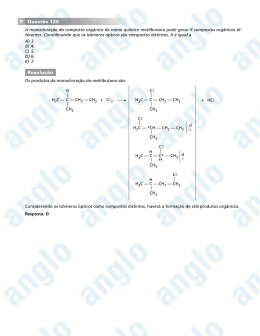
ISOMERIA 06 MATERIAL RETIRADO PARCIALMENTE OU NA INTEGRA DE LISTAS DE EXERCÍCIOS ENCONTRADAS NA INTERNET O estudo de isomeria é dividido em duas partes: Isomeria Plana: onde a visualização dos isômeros ocorre na forma plana das moléculas. Isomeria espacial: onde a visualização dos isômeros ocorre na forma espacial da molécula, por tanto sendo mais difícil para o aluno e por isso veremos alguns casos restritos. Isomeria: É quando compostos diferentes apresentam a mesma fórmula molecular: Exemplo: A fórmula molecular do 2-penteno é de C5 H10 e a fórmula molecular do ciclo-pentano C5 H10 . H3C – CH = CH – CH2 – CH3 C5 H10 CH2 / \ H 2C CH2 | | H2C – CH2 C5 H10 Isomeria plana: Ocorre de quatro formas: Isomeria de Função: Os compostos diferem pela função orgânica. Os principais isômeros de função são: Álcool e éter Álcool aromático e fenol Aldeido e cetona Ácidos carboxílicos e éster Exemplo: H3C – CH2 – OH etanol C2 H6 O e H3C – O – CH3 metóximetano C2 H6 O H3C – CH2 – C = O | H propanal C3 H6 O H3C – CH2 – C = O | OH Ácido propanóico C3 H6 O2 e H3C – C – CH3 || O propanona C3 H6 O H3C – C – O – CH3 || O etanoato de metila C3 H6 O2 OH CH2 Álcool benzílico C7 H8 O OH CH3 1-hidróxi-2-metil-benzeno C7 H8 O Isomeria de Cadeia: Os compostos pertencem a mesma função mas apresentam cadeias diferentes. Exemplo: H2C – CH – CH2 – CH3 e H3C – CH2 – CH2 – CH2 – CH3 | CH3 C5 H12 C5 H12 2-metil-butano pentano cadeia aberta, ramificada, cadeia aberta, saturada e homogênea normal, saturada e homogênea H2C = CH – CH2 – CH3 2-buteno C4 H8 cadeia aberta, normal, insaturada e homogênea ciclo-butano C4 H8 cadeia fechada, normal, saturada e homogênea Isomeria de Posição: Os compostos pertencem a mesma função, apresentam a mesma cadeia mas se diferenciam pela posição de um radical, grupo funcional ou insaturação. Exemplo: H3C – CH – CH2 – CH2 – CH3 e H3C – CH2 – CH – CH2 – CH3 | | CH3 CH3 2-metil-pentano C6 H14 3-metil-pentano C6 H14 H3C – CH2 – CH – CH2 | OH 2-butanol C4 H10 O e H3C – CH2 – CH2 – CH2 | OH 1-butanol C4 H10 O H2C = CH – CH2 – CH3 C4 H8 1- buteno e H3C – CH = CH – CH3 C4 H8 2-buteno Isomeria de Compensação ou Metameria: ocorre em compostos que apresentam a mesmo função, a mesma cadeia e se caracteriza pelo deslocamento de um heteroátomo. Obs: a isomeria de compensação só ocorre em cadeias heterogêneas, ou seja, ocorre entre os compostos das funções éter, éster e aminas secundárias e terciárias. Exemplo: H3C – CH2 – O – CH2 – CH3 e H3C – O – CH2 – CH2 – CH3 C4 H10 O etóxietano C4 H10 O metóxipropano H3C – C – O – CH3 e HC – O – CH2 – CH3 || || O C3 H6 O2 O C3 H6 O2 etanoato de metila metanoato de etila H3C – NH – CH2 – CH2 – CH3 e H3C – CH2 – NH – CH2 – CH3 C4 H11 N metil-n-propilamina C4 H11 N dietilamina Tautomeria: É um caso particular de isomeria de função onde os compostos coexistem. Existem dois tipos de tautomeria: Aldoenólica ocorre entre aldeido e enol. Cetoenólica ocorre entre cetona e enol. Exemplo: H3C – C = O H2C = CH | | H OH etanal etenol aldeido enol aldoenólica H3C – C – CH3 || O propanona cetona cetoenólica H3C – C = CH2 | OH propenol enol ISOMERIA - II Isomeria Espacial: Somente vista no espaço, ocorre de dois tipos: Isomeria Geométrica: Ocorre em compostos de cadeia insaturada por uma dupla ligação e que apresente ligantes diferentes no carbono da dupla ligação. Ou Em cadeias fechadas. ISOMERIA - III Isomeria Ótica: Ocorre quando o composto apresenta carbono assimétrico. A isomeria ótica ocorre pelo desvio do plano da luz polarizada. Dextrógero desvia o plano da luz polarizada para a direita. Isômero ativo. Levógero desvia o plano da luz polarizada para a esquerda. Isômero ativo O dextrógero e o levógero são enantiomorfos ou enantiômeros, ou seja, um é a imagem especular do outro. Racêmico É a soma de um dextrógero com um levógero, o racêmico não apresenta desvio no plano da luz polarizada e é o isômero inativo. Carbono Assimétrico apresenta quatro ligantes diferentes. | R2 – C – R4 | R3 R1 R1 C* C* R4 R2 R4 R2 R3 dextrógiro R1 R3 levógiro Número de Isômeros Ativos: N1a = 2n onde n é o número de carbonos assimétricos. Número de Isômeros Inativos ( Racêmicos ): NR = 2n - 1 onde n é o número de carbonos assimétricos. Obs: O número de racêmicos é sempre a metade do número de isômeros ativos. Exemplo: Para o composto a seguir: H CH3 OH | | | H3C – C* -- C* -- C* -- CH3 | | | OH H F I. O número de isômeros ativos? Existem 3 carbonos assimétricos, assim n = 3. Logo: Nia = 2n :. Nia = 23 :. Nia = 8 Existindo 8 isômeros ativos é porque 4 são dextrógeros e 4 são levógeros. II. O número de racêmicos ? NR = 2n-1 :. NR = 23-1 :. NR = 22 :. NR = 4 Existem 4 isômeros racêmicos, o que já era previsto se existem 8 isômeros ativos, dos quais 4 são dextrógeros e 4 são levógeros só são possíveis 4 misturas de pares dextrógero e levógero o que resulta em 4 misturas racêmicas. O que nos faz concluir que o número de isômeros inativos é sempre a metade do número de isômeros ativos. III. O número de isômeros óticos? É a soma dos isômeros ativos com os isômeros inativos. Logo: NO = 12 Isômero Meso: Ocorre quando existem dois carbonos assimétricos iguais. Exemplo: A molécula do ácido tatárico. Apresenta um dextrógiro, um levógiro, um meso e um racêrmico.
Download