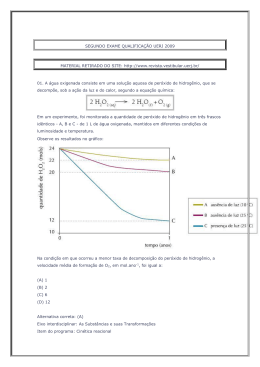
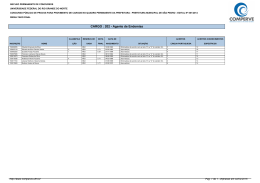
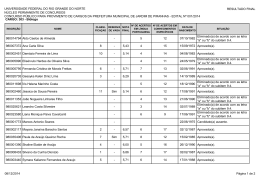
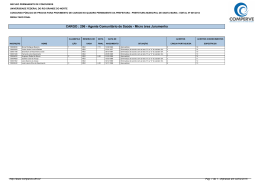
QUESTÕES COMENTADAS 2014 - 2º Exame de Qualificação - Questão 30 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Um nanotubo é uma estrutura cilíndrica microscópica formada apenas por átomos de carbono com hibridação sp 2 . O esquema abaixo representa um corte lateral de um nanotubo. Cada esfera corresponde ao núcleo de um átomo e cada traço a uma ligação entre carbonos. Não estão indicadas no esquema as ligações do tipo pi. O número de ligações duplas realizadas por átomo em um nanotubo corresponde a: (A) 1 (B) 2 (C) 3 (D) 4 Alternativa correta: (A) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Íons e moléculas Subitem do programa: Ligações químicas Objetivo: Identificar tipos de ligações feitas por átomos de carbono em uma estrutura de nanotubo. Comentário da questão: Um átomo de carbono pode fazer dois tipos de ligações interatômicas: sigma e pi, comumente representadas pelas letras gregas e , respectivamente. No esquema, cada núcleo atômico estabelece três ligações com outros núcleos. Sabe-se que não estão representadas as ligações do tipo pi. Logo, as três ligações indicados são do tipo sigma. Como o átomo de carbono é tetravalente, isto é, forma quatro ligações, a quarta ligação é do tipo pi. Essa configuração corresponde a um átomo de carbono com hibridação do tipo sp 2 . Observe: Analisando-se as ligações formadas pelo átomo de carbono, verifica-se que são formadas duas ligações simples e apenas uma ligação dupla. Percentual de acertos: 40,36% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 31 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Os indivíduos de uma determinada espécie de peixe, bem adaptada a seu ambiente, podem ser classificados, quanto ao tamanho, em três grupos: pequenos, médios e grandes. O grupo mais numeroso corresponde ao que apresenta fenótipo médio. Considere a introdução de um predador desses peixes no ambiente. Ao longo do tempo, os indivíduos do grupo médio passam a ser os menos numerosos, pois os peixes de tamanho menor conseguem defender-se do predador escondendo-se nas tocas, enquanto os de maior tamanho, mais fortes, não são atacados pela espécie predadora. As alterações descritas exemplificam o tipo de seleção denominado: (A) direcional (B) disruptiva (C) qualitativa (D) estabilizadora Alternativa correta: (B) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: Biodiversidade Subitem do programa: Teorias e conceitos de evolução Objetivo: Identificar tipo de seleção atuante em determinado ambiente. Comentário da questão: Na situação apresentada, a introdução do predador promove uma pressão ambiental, selecionando positivamente os fenótipos de tamanhos menor e maior, diminuindo assim a frequência dos peixes de tamanho intermediário. Chama-se disruptiva ao tipo de seleção que favorece os fenótipos extremos de uma população, em detrimento do fenótipo mediano. Percentual de acertos: 22,70% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 2º Exame de Qualificação - Questão 32 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Em um longo trecho retilíneo de uma estrada, um automóvel se desloca a 80 km/h e um caminhão a 60 km/h, ambos no mesmo sentido e em movimento uniforme. Em determinado instante, o automóvel encontra-se 60 km atrás do caminhão. O intervalo de tempo, em horas, necessário para que o automóvel alcance o caminhão é cerca de: (A) 1 (B) 2 (C) 3 (D) 4 Alternativa correta: (C) Eixo interdisciplinar: A matéria em equilíbrio e em movimento Item do programa: Leis de Newton Subitem do programa: Movimento uniforme e uniformemente variado Objetivo: Calcular intervalo de tempo em movimentos uniformes. Comentário da questão: O automóvel A se encontra atrás do caminhão C, e ambos se deslocam na mesma direção e sentido com velocidades VA = 80 km/h e VC = 60 km/h, respectivamente. A velocidade VAC de aproximação do automóvel em relação ao caminhão é dada por: VAC = VA – VC = 80 – 60 = 20 km/h Em um dado instante, a distância d entre o automóvel e o caminhão é igual a 60 km. O encontro entre eles ocorrerá no intervalo de tempo t, expresso por: Percentual de acertos: 50,78% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 34 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Uma forma de identificar a estabilidade de um átomo de qualquer elemento químico consiste em relacionar seu número de prótons com seu número de nêutrons em um gráfico denominado diagrama de estabilidade, mostrado a seguir. São considerados estáveis os átomos cuja interseção entre o número de prótons e o de nêutrons se encontra dentro da zona de estabilidade mostrada no gráfico. Verifica-se, com base no diagrama, que o menor número de massa de um isótopo estável de um metal é igual a: (A) 2 (B) 3 (C) 6 (D) 9 Alternativa correta: (C) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Átomos Subitem do programa: Partículas subatômicas Item do programa 2: Elementos químicos Subitem do programa 2: Isotopia Objetivo: Discriminar o menor número de massa de um isótopo metálico. Comentário da questão: De acordo com a tabela de classificação periódica dos elementos, o lítio é o metal de menor número atômico, igual a três. Como o número atômico corresponde ao número de prótons, o átomo de lítio apresenta três prótons. Um elemento químico é definido pelo número de prótons em seu núcleo. Entretanto, o núcleo atômico é formado por prótons e nêutrons, sendo a soma do número de prótons e nêutrons denominada número de massa. Apesar de o número de prótons ser constante, o número de nêutrons é variável. Dessa forma, um mesmo elemento químico pode apresentar átomos com quantidades diferentes de nêutrons, portanto com diferentes números de massa. Esses átomos são denominados isótopos desse elemento. De acordo com a curva de estabilidade apresentada, para um átomo com três prótons são possíveis configurações estáveis com três e quatro nêutrons. Logo, o menor isótopo estável de um elemento metálico apresentará três prótons e três nêutrons, ou seja, número de massa igual a seis. Percentual de acertos: 19,15% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 2º Exame de Qualificação - Questão 35 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Os dois principais grupos de seres vivos envolvidos no processo de diminuição da taxa de oxigênio disponível são: (A) algas e bactérias (B) plantas e bactérias (C) algas e microcrustáceos (D) plantas e microcrustáceos Alternativa correta: (A) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: Integração entre seres vivos e meio ambiente Subitem do programa: Poluição e desequilíbrio ecológico Objetivo: Discriminar grupos de seres vivos envolvidos em processo de diminuição de taxas de oxigênio dissolvido em uma lagoa. Comentário da questão: O aporte de matéria orgânica, trazida pelas chuvas, promove o aumento tanto da população de algas, que consomem mais oxigênio do que produzem, quanto da de bactérias que decompõem a matéria orgânica. Ambas contribuem, portanto, para a diminuição do oxigênio dissolvido na água. Percentual de acertos: 61,19% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 36 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 O volume médio de água na lagoa é igual a 6,2 x 10 6 L. Imediatamente antes de ocorrer a mortandade dos peixes, a concentração de gás oxigênio dissolvido na água correspondia a 2,5 x 10 –4 mol.L–1 . Ao final da mortandade, a quantidade consumida, em quilogramas, de gás oxigênio dissolvido foi igual a: (A) 24,8 (B) 49,6 (C) 74,4 (D) 99,2 Alternativa correta: (B) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Soluções Subitem do programa: Unidades de concentração expressas em percentagem, em g.L-1 e em quantidade de matéria Objetivo: Calcular a variação na quantidade de oxigênio dissolvido na água de uma lagoa durante uma mortandade de peixes. Comentário da questão: Antes da mortandade de peixes, a concentração de gás oxigênio (O 2 ) dissolvido na lagoa era igual a 2,5 x 10 –4 mol.L–1 . Após a mortandade, a concentração caiu para 0 mol.L–1 . Assim, constata-se que houve o consumo de 2,5 x 10 –4 mol de gás oxigênio dissolvido por litro de água presente na lagoa. Como o volume médio de água na lagoa é igual a 6,2 x 10 6 L, a quantidade de matéria, em mols, de gás oxigênio consumida corresponde a: 2,5 x 10 –4 mol X 1L 6,2 x 106 L X = 1550 mol de O 2 A massa atômica do elemento químico oxigênio é igual a 16. Logo, a massa molar do gás oxigênio é igual a: 16 x 2 = 32 g.mol–1 A massa de gás oxigênio consumida durante a mortandade equivale a: 1550 mol x 32 g.mol–1 = 46600 g = 49,6 kg Percentual de acertos: 40,75% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 37 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Analisando-se a genealogia das famílias Alfa e Beta, observa-se que na família Alfa apenas a mãe tem cabelos azuis, enquanto na família Beta todos têm cabelos dessa cor. Admita que a característica cabelo azul siga os princípios descritos por Mendel para transmissão dos genes. Com base nas genealogias apresentadas, a herança genética para cor azul do cabelo é classificada como: (A) holândrica (B) pleiotrópica (C) mitocondrial (D) autossômica Alternativa correta: (D) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: As bases da genética Subitem do programa: Hereditariedade e doenças hereditárias Objetivo: Discriminar tipo de herança hereditária envolvida na transmissão de determinada característica. Comentário da questão: As características fenotípicas dos indivíduos são determinadas por um par de genes, um herdado do pai e outro da mãe. A análise das duas genealogias apresentadas indica que a característica cabelo azul é autossômica, ou seja, está localizada em um cromossomo somático, afetando, portanto, tanto homens quanto mulheres. Enquanto, na família Alfa, apenas a mãe possui cabelo azul, na família Beta, todos possuem essa característica, reforçando essa conclusão. De acordo com os princípios descritos por Mendel, para as demais classificações apresentadas, cabem as seguintes considerações: • holândrica – o gene que determina o fenótipo está presente no cromossomo Y, assim apenas os homens poderiam apresentar cabelo azul; • mitocondrial – a herança mitocondrial é transmitida pela mãe, portanto todos os filhos da família Alfa deveriam apresentar cabelo azul; • pleiotrópica – neste tipo de herança, um único gene influencia mais de uma característica, o que não ocorre na situação analisada. Percentual de acertos: 68,58% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 38 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Uma das técnicas empregadas para separar uma mistura gasosa de CO 2 e CH4 consiste em fazê-la passar por uma solução aquosa de Ba(OH)2 . Uma amostra dessa mistura gasosa, com volume total de 30 L, sob temperatura de 27 ºC e pressão de 1 atm, ao reagir com a solução aquosa de Ba(OH)2 , produz a precipitação de 98,5 g de BaCO 3 . A fração gasosa remanescente, nas mesmas condições de temperatura e pressão, contém apenas CH4 . O volume, em litros, de CH4 remanescente é igual a: (A) 10 (B) 12 (C) 15 (D) 18 Alternativa correta: (D) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Cálculo estequiométrico simples Subitem do programa: Quantidade de matéria, de massa e de volume nas condições normais Item do programa 2: Gases ideais Subitem do programa 2: Equação geral dos gases Objetivo: Calcular o volume de CH4 em uma mistura gasosa de CO 2 e CH4 . Comentário da questão: A mistura gasosa inicialmente era composta por CO 2 e CH4 nas seguintes condições: volume de 30 L, pressão de 1 atm e temperatura de 27 ºC. A quantidade de matéria dessa mistura, expressa em número de mols, pode ser calculada a partir da equação geral dos gases: P.V = n.R.T sendo P = 1 atm V = 30 L T = 300 K (27 ºC) R = 0,08 atm.L.mol– 1.K– 1 (constante universal dos gases ideais) n = quantidade de matéria Substituindo os valores na equação, tem-se: 1 x 30 = n x 0,08 x 300 n = 1,25 mol O CO 2 presente na mistura reagiu com Ba(OH)2 formando BaCO 3 , de acordo com a seguinte equação química: CO 2 + Ba(OH)2 BaCO 3 + H2 O De acordo com a proporção estequiométrica da equação, 1 mol de CO 2 reage com 1 mol de BaCO 3 . As massas molares do CO 2 e do BaCO 3 são calculadas a partir de suas massas atômicas: CO 2 = 12 + 16 x 2 = 44 g BaCO 3 = 137 + 12 + 16 x 3 = 197 g Sabendo que foram formados 98,5 g de BaCO 3 , calcula-se a massa de CO 2 consumido: 44 g 197 g X 98,5 g X = 22 g Como a massa molar do CO 2 é igual a 44 g, calcula-se sua quantidade de matéria em 22 g: 44 g 1 mol 22 g Y Y = 0,5 mol Conhecendo a quantidade de matéria correspondente ao CO 2 , pode-se calcular a quantidade de matéria de CH4 na mistura: n = nCO 2 + nCH4 nCH4 = n – nCO 2 = 1,25 – 0,5 = 0,75 mol Nas condições de 1 atm e 27 ºC, o volume ocupado por 0,75 mol de CH4 é calculado pela equação geral dos gases: P.V = n.R.T 1 x V = 0,75 x 0,08 x 300 V = 18 L Percentual de acertos: 20,44% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 2º Exame de Qualificação - Questão 39 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Lipases são enzimas relacionadas à digestão dos lipídios, nutrientes que, em excesso, levam ao aumento da massa corporal. Certos medicamentos para combate à obesidade agem inibindo essas enzimas. Assim, como não há digestão de parte da gordura ingerida, há menor absorção desses nutrientes, contribuindo para o controle do peso. Com base nessas informações, conclui-se que tais medicamentos agem principalmente sobre as enzimas produzidas pelo seguinte órgão: (A) fígado (B) jejuno (C) pâncreas (D) estômago Alternativa correta: (C) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: Sistemas vitais dos animais e vegetais Subitem do programa: Digestão e absorção dos alimentos Objetivo: Identificar órgão produtor de enzima digestiva de lipídeos. Comentário da questão: O suco produzido pelo pâncreas, denominado pancreático, é uma secreção enzimática rica em lipase, proteína envolvida na digestão dos lipídeos. Percentual de acertos: 28,37% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 2º Exame de Qualificação - Questão 40 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 O corpo de um aspirador de pó tem massa igual a 2,0 kg. Ao utilizá-lo, durante um dado intervalo de tempo, uma pessoa faz um esforço sobre o tubo 1 que resulta em uma força de intensidade constante igual a 4,0 N aplicada ao corpo do aspirador. A direção dessa força é paralela ao tubo 2, cuja inclinação em relação ao solo é igual a 60º, e puxa o corpo do aspirador para perto da pessoa. Considere sen 60º = 0,87, cos 60º = 0,5 e também que o corpo do aspirador se move sem atrito. Durante esse intervalo de tempo, a aceleração do corpo do aspirador, em m/s 2 , equivale a: (A) 0,5 (B) 1,0 (C) 1,5 (D) 2,0 Alternativa correta: (B) Eixo interdisciplinar: A matéria em equilíbrio e em movimento Item do programa: Leis de Newton Subitem do programa: Massa, velocidade, aceleração, força Objetivo: Calcular aceleração de um corpo com base na 2ª lei de Newton. Comentário da questão: De acordo com a ilustração, a força F de 4,0 N, aplicada ao corpo do aspirador de massa m igual a 2,0 kg, pode ser esquematizada do seguinte modo: De acordo com a 2ª lei de Newton, R = ma, sendo R a resultante das forças aplicadas sobre o corpo de massa m e aceleração a. Na situação apresentada, como não há movimento na direção perpendicular ao solo, R = F cos Logo, a aceleração a do aspirador, ao longo do solo, é dada por: Percentual de acertos: 34,00% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 41 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Desde o início da colonização do ambiente terrestre, houve grande diversificação das plantas, graças ao surgimento de características vantajosas à adaptação, que permitiram a sobrevivência e a reprodução em terra firme. As estruturas correspondentes a adaptações evolutivas exclusivas das plantas, que contribuíram para seu desenvolvimento e diversificação no habitat terrestre, estão indicadas em: (A) fruto, semente e mitocôndria (B) vaso condutor, cutícula e estômato (C) membrana celular, cloroplasto e raiz (D) meristema apical, parede celular e flor Alternativa correta: (B) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: Biodiversidade Subitem do programa: Características gerais dos principais seres vivos; teorias e conceitos de evolução Objetivo: Reconhecer adaptações evolutivas dos vegetais importantes para sua diversificação e conquista do ambiente terrestre. Comentário da questão: A cutícula e os estômatos, presentes na epiderme das folhas, ajudam a evitar a perda de água pelas plantas, enquanto os vasos condutores favorecem uma melhor distribuição tanto de água quanto de nutrientes pelo corpo das plantas, permitindo que elas alcancem um tamanho maior. O surgimento dessas estruturas ao longo do processo evolutivo foi fundamental para que as plantas pudessem colonizar o ambiente terrestre, tornando-se organismos maiores e mais complexos. Percentual de acertos: 28,88% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 2º Exame de Qualificação - Questão 43 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 Em uma das etapas do ciclo de Krebs, a enzima aconitase catalisa a isomerização de citrato em isocitrato, de acordo com a seguinte equação química: A isomeria plana que ocorre entre o citrato e o isocitrato é denominada de: (A) cadeia (B) função (C) posição (D) compensação Alternativa correta: (C) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Funções químicas Subitem do programa: Isomeria Objetivo: Identificar o tipo de isomeria plana existente entre os íons citrato e isocitrato. Comentário da questão: Analisando as estruturas químicas dos íons citrato e isocitrato, observa-se que a diferença entre elas é a posição da hidroxila, que se encontra ligada ao carbono central no citrato e ao carbono da ponta no isocitrato. O tipo de isomeria plana em que os isômeros apresentam a mesma cadeia carbônica e diferem pela posição de um grupamento, no caso a hidroxila, é denominado isomeria de posição. Percentual de acertos: 39,77% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 2º Exame de Qualificação - Questão 44 Área do conhecimento: Ciências da Natureza Ano 6, n. 18, ano 2013 A figura abaixo ilustra uma ferramenta utilizada para apertar ou desapertar determinadas peças metálicas. Para apertar uma peça, aplicando-se a menor intensidade de força possível, essa ferramenta deve ser segurada de acordo com o esquema indicado em: (A) (B) (C) (D) Alternativa correta: (D) Eixo interdisciplinar: A matéria em equilíbrio e em movimento Item do programa: Equilíbrio de corpos rígidos Subitem do programa: Centro de gravidade, momento de força, alavancas, roldanas simples, balanças Objetivo: Descrever esquematicamente o momento de uma força. Comentário da questão: A ferramenta ilustrada é utilizada como uma alavanca cujo ponto de apoio é a própria peça a ser apertada. A força para apertar a peça é aplicada na extremidade livre da ferramenta. O eixo de rotação é perpendicular à ferramenta e contém o ponto de apoio. Observe: O módulo do momento de uma força em relação a um eixo, corresponde ao produto F x d, sendo F a intensidade da força e d a distância entre a direção da força e o eixo. Essa distância é denominada braço de alavanca. Assim, quanto maior o braço da alavanca, menor será a intensidade da força necessária para produzir o mesmo valor do momento. Observe o braço da alavanca em cada esquema: O esquema que corresponde ao maior braço de alavanca – e, portanto, à menor intensidade da força – é o apresentado a seguir: Percentual de acertos: 43,93% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 30 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Os dois agentes químicos citados no texto, quando absorvidos, provocam o mesmo resultado: paralisação dos músculos e asfixia, culminando na morte do indivíduo. Com base nessas informações, pode-se afirmar que tanto o gás cianídrico quanto o monóxido de carbono interferem no processo denominado: (A) síntese de DNA (B) transporte de íons (C) eliminação de excretas (D) metabolismo energético Alternativa correta: (D) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Transformações energéticas nos seres vivos Subitem do programa: Cadeia respiratória e fosforilação oxidativa na mitocôndria Eixo interdisciplinar 2: Os seres vivos e sua relação com o ambiente Item do programa 2: Sistemas vitais dos animais e vegetais Subitem do programa 2: Respiração Objetivo: Identificar o processo orgânico inibido pela ação de substâncias tóxicas. Comentário da questão: O gás cianídrico reage principalmente com a enzima citocromo C oxidase, que está presente na da cadeia respiratória mitocondrial e é responsável pela transferência de elétrons para o oxigênio. Essa reação bloqueia toda a cadeia respiratória e, por consequência, a síntese de ATP. O monóxido de carbono, por sua vez, liga-se de maneira irreversível à hemoglobina, prejudicando o aporte de oxigênio às células e contribuindo para o colapso do metabolismo energético. Percentual de acertos: 50,67% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 31 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 O conjunto de elementos químicos englobados no grupo 3 e no bloco f da tabela de classificação periódica dos elementos, com exceção dos actinídeos, é denominado “metais terras raras”. Esses metais são encontrados comumente na forma de óxidos, sendo o caráter iônico dos óxidos diretamente proporcional ao raio atômico do metal. O metal terra rara componente do óxido de maior caráter iônico possui o seguinte símbolo: (A) Ac (B) La (C) Lu (D) Sc Alternativa correta: (B) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Elementos químicos Subitem do programa: Classificação periódica e propriedades periódicas Objetivo: Discriminar o metal terra rara de maior raio atômico. Comentário da questão: O bloco f da tabela de classificação periódica corresponde aos elementos que apresentam os elétrons mais energéticos, situados justamente no subnível f. Fazem parte deste bloco os lantanídeos e os actinídeos. O grupo de metais terras raras engloba os lantanídeos e os elementos do grupo 3, à exceção do actínio (Ac). Observe: O caráter iônico de um óxido de metal terra rara aumenta em função do raio atômico do metal que o compõe. Logo, o óxido de maior caráter iônico será aquele composto pelo metal de maior raio atômico. Como o raio atômico é uma propriedade periódica, o metal terra rara de maior raio atômico pode ser identificado por sua posição na tabela de classificação periódica. Em um grupo da tabela periódica, o raio atômico aumenta de cima para baixo, em função do aumento do número de camadas eletrônicas. Logo, o metal terra rara de maior raio atômico no grupo 3 é o lantânio (La). Em um período da tabela periódica, o raio atômico aumenta da direita para a esquerda. Isso ocorre porque, quanto menor o número de prótons no núcleo, menor é a atração do núcleo sobre os elétrons, aumentando-se assim o raio atômico. Dentre os lantanídeos que fazem parte do 6º período da tabela periódica, o de maior raio atômico é o lantânio. Com base na análise de grupos e períodos, conclui-se portanto que o lantânio é o metal terra rara de maior raio atômico. Percentual de acertos: 21,52% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 32 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Em um experimento, são produzidos feixes de átomos de hidrogênio, de hélio, de prata e de chumbo. Estes átomos deslocam-se paralelamente com velocidades de mesma magnitude. Suas energias cinéticas valem, respectivamente, E H , E He , E Ag e E Pb . A relação entre essas energias é dada por: (A) E He > E H > E Pb > E Ag (B) E Ag > E Pb (C) E H > E H > E He > E He > E Ag > E Pb (D) E Pb > E Ag > E He > E H Alternativa correta: (D) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Elementos químicos Subitem do programa: Massa atômica, número atômico, isotopia Eixo interdisciplinar 2: A matéria em equilíbrio e em movimento Item do programa 2: Leis de conservação Subitem do programa 2: Energia cinética Objetivo: Descrever relação entre energias cinéticas de corpos distintos. Comentário da questão: Consultando-se a tabela periódica, pode-se estabelecer que as massas dos isótopos do chumbo (Pb), da prata (Ag), do hélio (He) e do hidrogênio (H) obedecem à seguinte relação: mPb > mAg > mHe > mH A energia cinética é diretamente proporcional à massa e ao quadrado do módulo da velocidade. Logo, para corpos com velocidade de mesma magnitude, as energias cinéticas obedecerão à seguinte relação: E Pb > E Ag > E He > E H Percentual de acertos: 49,58% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 33 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 A imagem abaixo ilustra uma bola de ferro após ser disparada por um canhão antigo. Desprezando-se a resistência do ar, o esquema que melhor representa as forças que atuam sobre a bola de ferro é: (A) (B) (C) (D) Alternativa correta: (A) Eixo interdisciplinar: A matéria em equilíbrio e em movimento Item do programa: Leis de Newton Subitem do programa: Massa, velocidade, aceleração, força Objetivo: Identificar forças atuantes sobre um corpo. Comentário da questão: Desprezando-se a resistência do ar, a única força que atua sobre a bola é o peso. A direção dessa força é perpendicular ao solo e tem sentido para baixo. Logo, o esquema que a representa é: Percentual de acertos: 20,23% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 34 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 As características abaixo são referentes aos processos de replicação, transcrição e tradução, que ocorrem em seres vivos. I – A síntese de proteínas tem início antes mesmo do término da transcrição. II – A grande maioria dos genes contém íntrons, retirados antes da tradução. III – A síntese de proteínas sempre ocorre em ribossomos livres no citoplasma. IV – O processo de replicação possui uma única origem. As características I, II, III e IV estão associadas, respectivamente, aos organismos indicados em: (A) eucariotos – eucariotos – procariotos – eucariotos (B) eucariotos – procariotos – eucariotos – procariotos (C) procariotos – eucariotos – procariotos – procariotos (D) procariotos – procariotos – eucariotos – procariotos Alternativa correta: (C) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: As bases da genética Subitem do programa: Genes; código genético Objetivo: Discriminar particularidades de procariotos e de eucariotos. Comentário da questão: As características I, III e IV dizem respeito aos procariotos. Por não possuírem membrana nuclear, os ribossomos desses organismos podem dar início à síntese de uma proteína antes mesmo do término da produção do respectivo RNA mensageiro. Eles também não possuem organelas membranosas, por isso a síntese de proteínas somente pode ocorrer nos ribossomos livres de seu citoplasma. Outra particularidade relacionada aos procariotos é o fato de haver neles apenas uma origem para replicação do seu DNA, que é circular e pequeno, quando comparado com os cromossomos de eucariotos, formados por longas moléculas de DNA linear. A característica II refere-se aos seres eucariotos, pois somente eles possuem íntrons, que são regiões não codificantes de uma sequência gênica. Os íntrons são suprimidos durante o processamento do RNA mensageiro. Percentual de acertos: 19,36% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 35 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Uma substância orgânica possui a seguinte composição percentual em massa: Observe outras características dessa substância: • a razão entre o número de átomos de sua fórmula molecular e de sua fórmula mínima é igual a 2; • o cátion liberado na sua ionização em água é o H+. A substância descrita é denominada: (A) ácido etanoico (B) ácido butanoico (C) etanoato de etila (D) metanoato de metila Alternativa correta: (A) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Cálculo estequiométrico simples Subitem do programa: Fórmula percentual, mínima e molecular Item do programa 2: Funções químicas Subitem do programa 2: Classificação e nomenclatura das substâncias orgânicas Objetivo: Nomear um composto orgânico com base em sua composição e em suas propriedades químicas. Comentário da questão: O número de átomos de cada elemento na fórmula mínima da substância é determinado dividindo-se o percentual mássico pela massa atômica: Na fórmula mínima, os átomos devem ser indicados por números inteiros. Como os resultados acima são proporcionais, respectivamente, a 1, 1 e 2, a fórmula mínima da substância corresponde a CH2 O, totalizando 4 átomos. Sabe-se que a fórmula molecular tem o dobro de átomos da fórmula mínima, ou seja, corresponde a C 2 H4 O 2 . Sabe-se também que a substância ioniza liberando cátion H+, o que significa que ela pertence à função dos ácidos carboxílicos. O ácido carboxílico que contém dois átomos de carbono é representado pela seguinte fórmula estrutural: O nome desse composto é ácido etanoico. Percentual de acertos: 42,10% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 36 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Um sistema é constituído por uma pequena esfera metálica e pela água contida em um reservatório. Na tabela, estão apresentados dados das partes do sistema, antes de a esfera ser inteiramente submersa na água. A temperatura final da esfera, em graus Celsius, após o equilíbrio térmico com a água do reservatório, é cerca de: (A) 20 (B) 30 (C) 40 (D) 50 Alternativa correta: (B) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Fenômenos térmicos Subitem do programa: Calor; calor específico, mudanças de estado, calorimetria Objetivo: Calcular a temperatura final em um processo de troca de calor. Comentário da questão: O calor absorvido pela esfera tem o mesmo valor que o calor cedido pela água do reservatório, e ambos são diretamente proporcionais às respectivas capacidades térmicas (C e sfe ra e C água ) e variações de temperatura ( Te sfe ra e Tágua ). Logo: Com base nas informações da tabela, a capacidade térmica da esfera é muito menor que a da água do reservatório. Isso permite afirmar que a variação de temperatura da água é praticamente desprezível, ou seja, Tágua = 0 T = Tágua = 30 °C Sendo T a temperatura final da sistema, comum à água e à esfera. Percentual de acertos: 33,95% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 37 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Considere uma célula bacteriana com quatro guaninas oxidadas em um trecho do gene que codifica determinada proteína, conforme mostra a sequência: Ao final de certo tempo, essa célula, ao dividir-se, dá origem a uma população de bactérias mutantes. O número máximo de aminoácidos diferentes que poderão ser substituídos na proteína sintetizada por essas bactérias, a partir da sequência de DNA apresentada, é igual a: (A) 0 (B) 1 (C) 2 (D) 3 Alternativa correta: (C) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: As bases da genética Subitem do programa: Genes; código genético Objetivo: Identificar alterações na sequência de aminoácidos de uma proteína, com base na mutação ocorrida em um fragmento de DNA. Comentário da questão: De acordo com as informações, as guaninas oxidadas serão substituídas por adeninas. Desse modo, no DNA das células mutadas, dos três códons modificados, dois serão iguais: Como o código é degenerado, duas consequências são possíveis: 1ª Os códons alterados podem codificar para o mesmo aminoácido. Neste caso, não haverá alteração na proteína. 2ª Dos três códons alterados, dois são iguais. Logo, no máximo dois aminoácidos podem ser diferentes. Percentual de acertos: 37,84% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 38 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Considere, agora, a adição de um átomo X na oxidação da guanina, conforme esquematizado na equação química: Nessa equação, o átomo correspondente a X é simbolizado por: (A) C (B) H (C) N (D) O Alternativa correta: (D) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Íons e moléculas Subitem do programa: Ligações químicas Objetivo: Identificar o átomo adicionado na reação de oxidação da guanina. Comentário da questão: Analisando-se as fórmulas estruturais das moléculas de guanina e de guanina oxidada, observa-se que foi adicionado à segunda um átomo de oxigênio: É importante notar que não há adição de átomo de hidrogênio. O átomo de hidrogênio que estava ligado ao átomo de carbono na guanina, e que não é representado na fórmula estrutural, passa a se ligar ao átomo de nitrogênio na guanina oxidada. Percentual de acertos: 75,74% Nível de dificuldade: Fácil (acima de 70%) 2014 - 1º Exame de Qualificação - Questão 39 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 No circuito, uma bateria B está conectada a três resistores de resistências R1 , R2 e R3 : Sabe-se que R2 = R3 = 2R1 . A relação entre as potências P 1 , P 2 e P 3 , respectivamente associadas a R1 , R2 e R3 , pode ser expressa como: (A) P 1 = P 2 = P 3 (B) 2P 1 = P 2 = P 3 (C) 4P 1 = P 2 = P 3 (D) P 1 = 2P 2 = 2P 3 Alternativa correta: (D) Eixo interdisciplinar: A matéria em equilíbrio e em movimento Item do programa: Fenômenos elétricos e magnéticos Subitem do programa: Carga, corrente, potência, campo e potencial elétricos; resistores, lei de Ohm, circuitos elétricos Objetivo: Descrever a relação entre as potências elétricas dissipadas por resistores. Comentário da questão: As resistências em paralelo R2 e R3 têm mesmo valor; por isso, suas respectivas correntes são iguais: I2 = I3 . Assim, a corrente I1 em R1 se divide em duas correntes de mesmo valor, de acordo com a relação: I1 = I2 +I3 = 2I2 = 2I3 As potências dissipadas por R1 , R2 e R3 são dadas por: As razões entre as potências podem ser descritas como: Como R1 vale a metade de R2 , e I1 é o dobro de I2 , tem-se: Como R3 = R2 e I3 = I2 , a mesma relação vale para Percentual de acertos: 25,17% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 40 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Um laboratorista precisa preparar 1,1 kg de solução aquosa saturada de um sal de dissolução exotérmica, utilizando como soluto um dos três sais disponíveis em seu laboratório: X, Y e Z. A temperatura final da solução deverá ser igual a 20 ºC. Observe as curvas de solubilidade dos sais, em gramas de soluto por 100 g de água: A massa de soluto necessária, em gramas, para o preparo da solução equivale a: (A) 100 (B) 110 (C) 300 (D) 330 Alternativa correta: (A) Eixo interdisciplinar: As substâncias e suas transformações Item do programa: Fenômenos térmicos Subitem do programa: Termoquímica Item do programa 2: Soluções Subitem do programa 2: Unidades de concentração expressas em percentagem, em g.L-1 e em quantidade de matéria Objetivo: Calcular a massa de soluto necessária para o preparo de uma solução aquosa. Comentário da questão: A dissolução de um sal genérico AnBm pode ser representada pela seguinte equação química: n A+m (aq) + m B-n (aq) An Bm (s) A dissolução em análise é um processo exotérmico, ou seja, há liberação de energia. O aumento da temperatura favorece as reações endotérmicas, isto é, aquelas em que há absorção de energia. Logo, um sal com dissolução exotérmica terá sua solubilidade reduzida com o aumento da temperatura. Dentre os três sais disponíveis, o que apresenta dissolução exotérmica está representado pela curva X. De acordo com essa curva, a 20 ºC, a solubilidade é igual a 10 g de sal por 100 g de água. Misturando-se 10 g de sal com 100 g de água, obtêm-se 110 g de solução. Se 10 g de sal correspondem a 110 g de solução, para o preparo de 1,1 kg de solução, tem-se: 10 g 110 g M 1100 g M = 100 g Percentual de acertos: 21,48% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 41 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 No ciclo do nitrogênio, as bactérias desnitrificantes estão relacionadas à função apontada em: (A) conversão da amônia em nitrito (B) produção de nitrato a partir da amônia (C) liberação de gás nitrogênio para o ambiente (D) incorporaração de nitrogênio molecular em aminoácidos Alternativa correta: (C) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: Integração entre seres vivos e meio ambiente Subitem do programa: Ecossistemas, cadeia alimentar, ciclos biogeoquímicos Objetivo: Identificar a função das bactérias desnitrificantes no processo de reciclagem do nitrogênio. Comentário da questão: O nitrogênio é um elemento fundamental para os seres vivos, pois entra na composição, por exemplo, de aminoácidos e de ácidos nucleicos. Porém, para que ele seja utilizado pela maioria dos seres vivos, é necessária a participação de umas poucas espécies de micro-organismos, capazes de fixar o nitrogênio atmosférico (N2 ) em formas químicas assimiláveis. De modo semelhante, para que o nitrogênio retorne ao ambiente na forma de gás nitrogênio, também há o envolvimento de micro-organismos, coletivamente chamados de desnitrificantes, especializados na transformação de nitrato ( Percentual de acertos: 35,43% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 42 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 ) em N2 . O nitrato, íon de geometria trigonal plana, serve como fonte de nitrogênio para as bactérias. Observe as seguintes fórmulas estruturais: A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número: (A) I (B) II (C) III (D) IV Alternativa correta: (B) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Íons e moléculas Subitem do programa: Ligações químicas Objetivo: Representar a fórmula estrutural do íon nitrato. Comentário da questão: A fórmula iônica do íon nitrato é . Em sua fórmula estrutural, os três átomos de oxigênio estão ligados ao átomo de nitrogênio. Pela distribuição eletrônica dessas substâncias, sabe-se que o nitrogênio apresenta cinco elétrons em sua última camada, enquanto o oxigênio apresenta seis. De acordo com regra do octeto, para adquirir estabilidade com oito elétrons em sua camada de valência, o nitrogênio irá formar uma ligação dupla com o primeiro dos átomos de oxigênio (que também irá adquirir estabilidade) e uma ligação simples com um segundo átomo de oxigênio. Por ser um ânion de carga –1, o nitrato contém mais um elétron dos que os presentes nos átomos participantes. Esse elétron se liga ao segundo átomo de oxigênio, proporcionando assim sua estabilidade. Resta ainda o terceiro átomo de oxigênio, que necessita de dois elétrons para alcançar a estabilidade. Como o nitrogênio já completou sua última camada, uma ligação covalente dativa entre o nitrogênio e o terceiro oxigênio é formada, utilizando dois elétrons livres do átomo de nitrogênio. Com base nessas informações, a fórmula estrutural do ânion nitrato é representada por: Percentual de acertos: 24,06% Nível de dificuldade: Difícil (abaixo de 30%) 2014 - 1º Exame de Qualificação - Questão 43 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 O bóson de Higgs, apesar de ser uma partícula fundamental da natureza, tem massa da ordem de 126 vezes maior que a do próton, sendo, portanto, mais pesada do que a maioria dos elementos químicos naturais. O símbolo do elemento químico cuja massa é cerca de metade da massa desse bóson é: (A) Cu (B) I (C) Mo (D) Pb Alternativa correta: (A) Eixo interdisciplinar: Os constituintes fundamentais da matéria Item do programa: Átomos Subitem do programa: Partículas subatômicas Item do programa 2: Elementos químicos Subitem do programa 2: Massa atômica, número atômico, isotopia Objetivo: Identificar elemento químico com base em valores de massa atômica. Comentário da questão: A unidade de massa atômica (u.m.a.) é bem próxima ao valor da massa do hidrogênio. Como o hidrogênio é constituído apenas por um próton e por um elétron, a u.m.a. também é bem próxima ao valor da massa do próton. Consultando-se a tabela de classificação periódica, observa-se que a massa atômica do cobre (Cu) é igual a 63,5 u.m.a., ou seja, corresponde a cerca de 63,5 vezes a massa do próton, ou a cerca de metade da massa do bóson de Higgs, cuja massa vale 126 vezes a massa do próton. Percentual de acertos: 65,76% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) 2014 - 1º Exame de Qualificação - Questão 44 Área do conhecimento: Ciências da Natureza Ano 6, n. 17, ano 2013 Células-tronco são células não especializadas que têm potencial de diferenciação, ou seja, em condições favoráveis, são capazes de gerar células especializadas e de diferentes tecidos. Para que essa diferenciação ocorra, as células-tronco têm de alterar necessariamente o seguinte padrão do seu metabolismo: (A) expressão gênica (B) número de cromossomos (C) quantidade de mitocôndrias (D) atividade dos fosfolipídios da membrana Alternativa correta: (A) Eixo interdisciplinar: Os seres vivos e sua relação com o ambiente Item do programa: As bases da genética Subitem do programa: Genes; código genético; cromossomos Objetivo: Reconhecer mecanismo de diferenciação das célula-tronco. Comentário da questão: Células-tronco são aquelas que, em condições favoráveis, podem dar origem a células especializadas e de diferentes tecidos. Para que esse processo seja possível, as células-tronco alteram seu padrão de expressão gênica, isto é, reprimem a síntese e/ou aumentam a produção de determinadas proteínas celulares. Percentual de acertos: 44,39% Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%) Voltar @2008-2014, Universidade do Estado do Rio de Janeiro. Todos os direitos reservados
Baixar