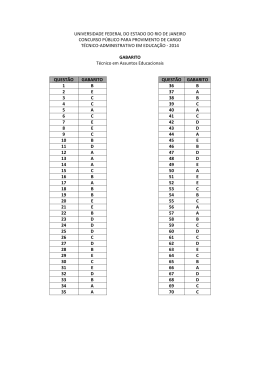
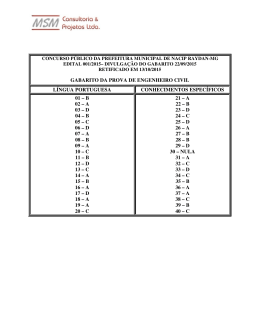
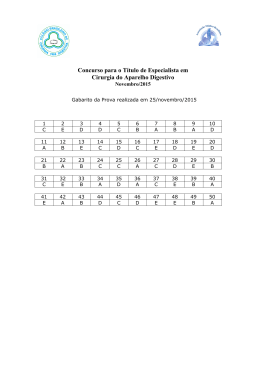
RESOLUÇÃO DA PROVA DE QUÍMICA DA UFRGS 2011 Questão 26 Como a questão pede a separação do sólido solúvel do líquido, o único processo recomendado é a destilação simples. Lembrando que filtração e decantação são processos que podem ser usados em misturas heterogêneas sólido-sólido.Gabarito B Questão 27 Para resolver a questão convém lembrar dois conceitos: - Elemento químico: conjunto de átomos como mesmo número atômico; - Massa atômica é a média ponderada das massas dos isótopos de um determinado elemento. Logo, pode-se afirmar que 24,3 é uma média ponderada.. Gabarito E Questão 28 Alternativa a – a substância 1 (SiO2) é um sólido covalente, já as substâncias 4 e 5 são compostos iônicos, portanto, são sólidos. Alternativa b – as substâncias 4 e 5 são iônicas. Alternativa c – a substância 4 é um sal. Alternativa d – a substância 2 é polar, portanto, solúvel em água. Alternativa e – A substância 1 é um sólido covalente, portanto, alto PF, já a substância 3 é polar. Gabarito A Questão 29 I - Como pertencem ao mesmo elemento (são isótopos) apresentam o mesmo número atômico, logo, estão na mesma posição. CORRETA 13 II – A espécie C apresenta um nêutron a mais, o número de prótons é o mesmo. INCORRETA III – O número de elétrons é o mesmo. INCORRETA Gabarito A Questão 30 I – Como todos os carbono fazem 1 ligação π, o arranjo geométrico é trigonal-plana. CORRETA II – A geometria do boro é trigonal plana. INCORRETA III – Os dois carbonos que fazem ligação tripla apresentam arranjo linear, já o outro carbono faz somente ligações simples, portanto, arranjo tetraédrico. CORRETA Gabarito D Questão 31 I – O que garante a forma esférica das gotas é a tensão superficial devido às ligações de hidrogênio entre as moléculas de água. CORRETA II – As ligações de hidrogênio são as atrações intermoleculares da água e são muito fortes e conferem o estado líquido dessa substância na temperatura ambiente. CORRETA III – A geometria da molécula de água é angular. INCORRETA Gabarito C Questão 32 Pode ser resolvida por substituição nas alternativas. Gabarito D Questão 33 Reação: H2O2 H2O + O2. Nox: -1 -2 0 Como o oxigênio sofreu redução (para H2O) e oxidação (para O2). O peróxido de hidrogênio atua como agente oxidante e redutor Gabarito E . Questão 34 Solução 1 – NaNO3 é um sal neutro e forma uma solução eletrolítica (com íons); Solução 2 – NH4Cl é um sal ácido, portanto forma uma solução ácida; Solução 3 – CaO, é um óxido básico, que em água origina uma base. Solução 4 – C6H14 é uma substância apolar e insolúvel em água; Solução 5 – C6H12O6 forma uma solução molecular e não eletrolítica; Gabarito E Questão 35 Como o material apresenta 50% de Al2O3 então 100% → 2040 kg 50% → xkg x = 1020 kg Logo 2 Al2O3 → 4 Al + 3 O2 2 x 102 g → 4 x 27 g 1020 kg → x kg x = 540 kg de alumínio 90 kg -------- 1 automóvel 540 kg -------- x automóveis x = 6 automóveis Gabarito B Questão 36 Hidrocarboneto alifático (cadeias abertas ou fechadas não-aromáticas) saturado (somente ligações simples, letra B eliminada) com fórmula molecular C11H22 (letras B e E eliminadas) e que apresenta grupos etila (CH3-CH2-) e isopropila (CH3CHCH3) que somente a letra C apresenta. Gabarito C Questão 37 Os enantiômeros são isômeros ópticos que apresentam mesmas propriedades físicas, como solubilidade, ponto de fusão (I correta) e ebulição idênticas. A única diferença é que um deles desvia o plano da luz polarizada para a direita, dextrógiro, e o outro desvia o plano da luz polarizada para esquerda, levógiro (II correta). Como o ângulo que eles desviam são iguais, mas em sentidos opostos uma mistura deles, chamada racêmica, não desvia o plano da luz polarizada, sem atividade óptica (III correta). Gabarito E Questão 38 Hexano – apolar Hexan-3-ona polar, Dipolo permanente Haexan-1,3,6-triol polar Ligações de hidrogênio Mais volátil (menor PE) – Hexano Mais solúvel em água – hexan-1,3,6-triol Gabarito D Questão 39 A capsaicina apresenta as funções: fenol (Ar-OH), éter (R – O – R) e amida ( R – CONH-); já a zingerona apresenta fenol, éter e cetona (R – CO – R). Portanto, os grupos comuns Às duas substâncias são fenol e éter. Gabarito E Questão 40 A reação proposta é CH3CH2OH → CH2=CH2 É uma reação de desidratação (eliminação de água) intramolecular de álcool, ocorre em presença de 0 0 ácidos e a temperatura entre 170 e 180 C. Gabarito D Questão 41 A lisina e a hidroxilisina são aminoácidos, pois apresentam os grupos amina e carboxila. Não estão representados glicídios (aldoses ou cetoses) e lípidios, que são fundamentalmente ésteres. Gabarito D Questão 42 I – Quanto mais diluída for a solução, menor será a concentração de qualquer uma das espécies + envolvidas, inclusive H . A afirmativa está incorreta. + II – Aumenta a diluição, aumenta o volume da solução, diminui a concentração de H , diminui a acidez, dessa solução, aumentando o pH. Afirmativa correta. III – O pH das soluções será diferente, pois trata-se de um ácido fraco e de um sal básico. Afirmativa incorreta. Gabarito B Questão 43 I – O próprio texto confirma isso. Afirmativa correta. II – Lembrar que ∆H = HP – HR, Se HP < HR, ∆H < 0, reação exotérmica. Afirmativa correta. III – A entalpia (H) da água em estados diferentes é sempre diferente, logo a variação será diferente. Afirmativa incorreta Gabarito C Questão 44 -1 Dada a equação CaO + H2O → Ca(OH)2 ∆H = - 236 kcal.mol -1 -1 CaO = 56 g.mol , então 56 g --------- - 236 kcla.mol 5,6 g --------- x kcal x = -23,6 kcal = -23600 calorias Aplicando a fórmula da física (Termologia) 0 Q = mc.∆T → 23600 = 1000.1. .∆T → .∆T = 23,6 C ; 0 Temperatura final = 20 + 23,6 = 43,6 C Gabarito C Questão 45 I - Conforme o enunciado, o iodo molecular é responsável, logo quando acumular ido, o sistema tornarse-á azul. CORRETA II – Depende, pois ele reage com o iodo molecular. Afirmativa incorreta. III – Quem determina a coloração azul é o iodo, logo para que a apareça é necessário que haja iodo em excesso. Afirmativa incorreta. Gabarito A Questão 46 I – O catalisador não desloca equilíbrio, nem altera constante de equilíbrio e ∆H. Afirmativa Incorreta II – O catalisador não desloca equilíbrio. Ele diminui o tempo para que seja atingido o equilíbrio. Afirmativa incorreta. III – O catalisador cria um mecanismo alternativo para a reação, diminuindo a energia potencial do complexo ativado, e, em conseqüência disso, diminuindo a energia de ativação. Afirmativa correta. Afirmativa correta. Gabarito C Questão 47 Início Reação Equilíbrio Glicose-6-Fosfato ↔ Frutose-6-Fosfato 1 zero -x +x (1 – x) x Kc = [Produto] [Reagente] 0,5 = x / (1-x) → x = 0,33 = 33% Gabarito C Questão 48 0 A 50 C a solução é saturada, logo os 65 g de sacarose dissolvem-se completamente em 25 g da água. 0 A 30 C diminui a solubilidade conforme a tabela, logo 220 g de sacarose ------ 100 g de água 65 g de sacarose ------- x g de água x = 29,5 g de água Então, como temos 25 g de água, precisamos adicionar 4,5 g de água. Gabarito B Questão 49 Segundo Faraday: “A quantidade de uma substância que sofre um processo eletroquímico é proporcional à carga elétrica que por ela passa”. Como não temos a carga elétrica, primeiro vamos calculá-la Q = it ------- Q = 1. 10800 = 10800 C 3+ Al - + 3 e → Al 3 mol elétrons ----- 1 mol Al 3 x 96500 C ---------- 1 x 27 g 10800 C ------------ x g Gabarito A x=1g Questão 50 No processo de liofilização, a temperatura da amostra é reduzida até abaixo de 0ºC, de modo que toda água presente congele (seta 2). Na seqüência, a pressão é reduzida até abaixo da pressão do ponto triplo (seta 3) e, finalmente, o alimento é lentamente aquecido até uma temperatura acima do ponto de congelamento, de modo que toda a água sublime (seta 4) lentamente. Gabarito B
Download