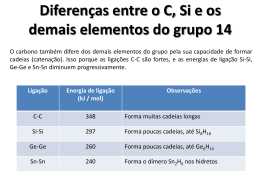
QUÍMICA DESCRITIVA DO CARBONO 1) OCORRÊNCIA E PROPRIEDADES O carbono é o pilar da química orgânica, onde se conhecem aproximadamente 10 milhões de compostos de carbono. O carbono pode ser encontrado na forma de carvão, petróleo, carbonatos (calcário), nos organismos vivos e sob a forma natural pode ser encontrado como grafite e diamante. No universo o carbono é o mais abundante do grupo, já na crosta terrestre o silício é o mais abundante (por causa dos silicatos). Abundância dos elementos do grupo 14 na crosta terrestre. Elemento ppm Abundância relativa Não-metal C 180 17º Si 272.000 2º Semi-metais Ge 1,5 54º Sn 2,1 49º Metais Pb 13 36º PROPRIEDADES Elemento C Si Ge Sn Pb Ponto ebulição (°C) Ponto fusão (°C) Sublima a 4100°C 3280 1420 2850 945 2623 232 1751 327 Capacidade de catenação diminui O carbono possui uma elevada temperatura por causa da força de ligação C-C. C-C Energia (kJ/mol) 346 Si-Si Energia (kJ/mol) 222 C-O 358 Si-O 452 C-O ~ C-C Si-O>>Si-Si O carbono possui uma grande capacidade de formar múltiplas ligações pπ-pπ como C=C, C≡C, C=O, C=S e C≡N. Os demais elementos do grupo não formam ligações pπ-pπ principalmente porque os orbitais atômicos são muito grandes para permitir uma interação efetiva. Átomos pequenos são capazes de se aproximar mais uns dos outros. Hibridizações do carbono: sp, sp2 e sp3. O carbono pode formar no máximo 4 ligações covalentes, pois estão disponíveis para formar ligações apenas os orbitais s e p. Carbono e silício só possuem elétrons s e p, mas os outros elementos seguem uma série completa de elementos de transição com 10 elétrons d. 2) ISÓTOPOS Naturalmente, o carbono apresenta três isótopos: 12C 13C 14C 98,89% 1,11% Análise de RMN de C Traços radioativos t1/2 = 5700 anos Técnica de datar objetos entre 1000 e 50000 anos. 14 C reage com o oxigênio → 14CO2 Plantas absorvem 14CO2 Animais comem plantas ou comem animais que comem plantas 14 C constante em organismos vivos Após a morte há o decaimento Datação A datação por 14C é aplicável à madeira, sedimentos orgânicos, ossos, conchas marinhas, ou seja, todo material que conteve carbono em alguma de suas formas. Como o exame se baseia na determinação de idade através da quantidade de 14C e que esta diminui com o passar do tempo, ele só pode ser usado para datar amostras que tenham até cerca de 50 mil de idade. Após esta idade, a quantidade de datação precisa. 14C começa a ser pequena demais para uma 3) FORMAS ALOTRÓPICAS GRAFITE À pressão normal o carbono adota a forma de grafite estando cada átomo unido a outros 3 em um plano composto de células hexagonais → folhas paralelas de átomos de carbono mantidos unidos por forças de Van der Waals. O grafite é um sólido macio, preto e escorregadio que possui brilho metálico, densidade de 2,2 g/cm3 e dureza de 1,2 Mohs. Hibridização: sp2, ligações σsp2-σsp2 + π. Cada átomo de carbono possui um orbital p perpendicular ao plano formando um grande sistema π → devido ao deslocamento de elétrons no sistema π, o grafite é condutor de eletricidade → propriedade que permite seu uso em processos de eletrólise. Aplicações: lubrificante, eletrodos, lápis (mistura com argila, quanto mais argila mais duro) e na indústria do aço (ligas de Fe+C). DIAMANTE Sob pressões elevadas, o carbono adota a forma de diamante, na qual cada átomo está ligada a outros quatro átomos de carbono covalentemente com geometria tetraédrica, encontrando-se os 4 elétrons em orbitais sp3 → forma uma estrutura cristalina. O diamante é um sólido duro e transparente, sendo encontrado principalmente no Zaire e na África do Sul. Devido a resistência da ligação química C-C, o diamante é juntamente com o nitreto de boro (BN) a substância mais dura conhecida (dureza de 10 Mohs, máximo na escala Mohs, escala de riscar). Composto que possui densidade de 3,5 g/cm3, inerte quimicamente, isolante elétrico e condutor térmico. É utilizado na joalheria, em instrumentos de corte (bisturis e brocas de perfuração) e revestimentos de microchips (por causa da sua alta condutividade térmica). FULERENOS Forma de carbono descoberta em meados da década de 80, sendo a 3ª forma mais estável do carbono. Os fulerenos possuem uma estrutura similar à do grafite, porém o empacotamento hexagonal se combina com pentágonos, o que curva os planos e permite o aparecimento de estruturas esféricas. São constituídos por 60 átomos de carbono apresentando uma estrutura tridimensional similar a uma bola de futebol → anéis de 5 a 6 membros. - Diâmetro de 1 nm - Hibridização sp2 - 12 pentágonos e 20 hexágonos - Os cientistas que descobriram esta forma alotrópica receberam em 1996 o Prêmio Nobel de Química. - Anéis de 6 membros (C70): se assemelha a uma bola de futebol americano → 12 pentágonos e mais hexágonos que C60. Sintetizado a partir do carbono grafite a 10000°C (aquecido com um raio laser intenso), está presente na fuligem e também nos depósitos de grafite. Devido à sua forma tridimensional, suas ligações insaturadas e sua estrutura eletrônica, os fulerenos apresentam propriedades químicas e físicas únicas que podem ser exploradas em várias áreas, incluindo bioquímica e medicina. Entre suas aplicações destacam-se: filmes em óculos por absorverem luz; armadilhas de radicais livres; transporte de drogas de efeito radioterápico e contrastes para diagnóstico por imagem. NANOTUBOS DE CARBONO Foram descobertos em 1991 por cientistas japoneses e são fulerenos em formas cilíndricas. São obtidos a partir do aquecimento de grafite e 1200°C sob atmosfera inerte. Devido as ligações covalentes C-C nos nanotubos, estes são imensamente fortes (100 vezes mais fortes que o aço). Excelente condutor elétrico devido ao alinhamento dos anéis ao longo do tubo = fibras elétricas (equivalente elétrico a fibras óticas) → conduz eletricidade em toda sua extensão NANOESPUMA DE CARBONO Em 2004 cientistas australianos descobriram uma 5ª forma de carbono chamada de “nanoespuma”. Ela tem aparência de um sólido esponjoso com baixa densidade, baixa condutividade elétrica e ferromagnética. Este material foi obtido bombardeando o carbono com um laser de 10.000 pulsos/segundo. No momento que o carbono atinge 10.000°C dá-se uma transformação estrutural, surgindo um emaranhado de tubos de carbono. 5) COMPOSTOS DE CARBONO 5.1) CARBETOS Compostos de carbono com um elemento menos eletronegativo → excluem compostos com N, P, O, S e halogênios. Iônicos Elementos mais eletropositivos (metais alcalinos, alcalinos terrosos e Al) Ex.: Na2C2(s), Al4C3(s) C2-2 : íon [:C≡ ≡C:]-2 Covalentes Metálicos Não metais com eletronegatividade semelhante a do carbono Metais de transição Ex.: SiC, B4C acetileto Íon C-4 Ex.: WC, Fe3C Os 3 tipos de carbetos são obtidos aquecendo o metal ou seu óxido com carbono ou um hidrocarboneto a 2000°C. SiC: sólido muito duro (~10 Mohs), substitui o diamante em muitos usos comerciais, usado em brocas de perfuração de petróleo. Os carbetos do grupo 1 e 2 são fontes sólidas de acetileno: Na2C2(s) + 2H2O(l) → 2NaOH(aq) + C2H2(g) 5.2) COMPOSTOS CONTENDO OXIGÊNIO Os mais estáveis são o monóxido de carbono (CO) e o dióxido de carbono (CO2). O monóxido de carbono é um gás incolor, inodoro e tóxico. Reage com a hemoglobina no lugar do O2, formando um complexo mais estável (carboxihemoglobina). A afinidade pela hemoglobina é 300 vezes maior que a do O2. O CO é formado pela combustão de carbono em quantidades limitadas de oxigênio. É pouco solúvel em água e é considerado um óxido neutro. :C≡O: → possui um par de elétrons livre no carbono. Funciona como um ligante na química de coordenação formando os compostos carbonílicos. O CO é usado como redutor na obtenção de metais; na síntese do metanol e como componente no gás de síntese (1H2:1CO) utilizado na indústria principalmente para a produção de propanal. O dióxido de carbono (CO2) é um gás incolor, denso e inodoro, utilizado em extintores. Possui geometria linear e hibridização sp (2 ligações σ e 2 ligações π). É obtido como produto da combustão completa do carbono e também nos processos de fermentação: C(s) + O2(g) → CO2(g) C6H12O6(aq) → 2C2H5OH(l) + 2CO2(g) Carbonatos: há duas séries de sais derivados do ácido carbônico: os carbonatos (CO3-2) e os hidrogenocarbonatos ou bicarbonatos (HCO3-) A solubilidade e a estabilidade térmica dos carbonatos está relacionada com a razão carga/raio (q/r). Quanto maior q/r→ maior capacidade de polarização do cátion→ menor a estabilidade do carbonato, pois diminui a ressonância do ânion CO3-2→ com isto menor a temperatura de decomposição. ↑ q/r + polarizante ↑ caráter covalente ↓ Solubilidade ↓ q/r - polarizante ↑ caráter iônico ↑ Solubilidade Grupo 1 r (angstron) q/r Li+ 0,9 1,1 Na+ 1,16 0,9 K+ 1,52 0,7 Rb+ 1,66 0,6 Cs+ 1,81 0,5 T decomposição (°C) Carbonatos do grupo 1 são solúveis em água Pouco solúvel Carbonatos do G1 fundem sem decompor Soluções básicas devido a hidrólise do íon CO3-2 Grupo 2 r (angstron) q/r T decomposição Carbonatos do grupo 2 são (°C) insolúveis em água Be+2 0,59 3,4 <100 Mg+2 0,86 2,3 540 Ca+2 1,14 1,8 900 Sr+2 1,32 1,5 1290 Ba+2 1,49 1,3 1360 Soluções neutras ou com pH igual ao da água Os carbonatos solúveis em água precipitam com CO2 os insolúveis se dissolvem pela formação do bicarbonato. Os bicarbonatos de metais alcalinos terrosos são solúveis em água, os de metais alcalinos são insolúveis ou parcialmente solúveis. As soluções são fracamente alcalinas devido à hidrólise do íon HCO3-. O íon carbonato possui geometria trigonal plana e hibridização sp2. Todos os carbonatos reagem com ácido liberando CO2: Na2CO3(s) + 2HCl(aq) → 2NaCl(aq) + CO2(g) + H2O(l) Outros compostos importantes: - CS2: análogo ao CO2; altamente tóxico; possui odor agradável quando puro. - CCl4 - CH4: gás natural - CN-: isoeletrônico ao CO; se liga fortemente à hemoglobina. Nas câmaras de gás usavam: 2NaCN(aq) + H2SO4(aq) → Na2SO4(aq) + 2HCN - Clorofluorcarbonos (CFC’s): CCl2F2. QUÍMICA DESCRITIVA DO SILÍCIO 1) OCORRÊNCIA ∗O silício é o segundo elemento mais importante da crosta terrestre depois do oxigênio; ∗25,7% em massa é composto de Si; ∗Primeiro elemento do seu grupo em abundância no planeta; ∗Normalmente encontrado sob a forma de minerais combinado com oxigênio e outros elementos. 2) FORMAS CRISTALINAS ∗ Amorfo: coloração marrom escuro ∗ Cristalina: estrutura octaédrica igual a do diamante, onde cada átomo de Si está ligado a 4 outros átomos de Si Hibridização: sp3 É duro e quebradiço Conduz corrente elétrica como o grafite e sua condutância aumenta com o aumento da temperatura S ilí c io g r a n u la d o P o lic r is t a l d e s ilí c io B a r r a d e s ilí c io 3) ISÓTOPOS Isótopos mais estáveis 28 Si 92,23% Estável com 14 neutrôns 29 Si 4,67% Estável com 15 neutrôns 30 Si 3,1% Estável com 16 neutrôns 4) OBTENÇÃO 4.1) Mediante aquecimento do SiO2 com coque a 2000°C: SiO2(s) + 2C(s) → Si(l) + 2CO(g) Catalisador de Fe Si grau metalúrgico (98%) Pode haver formação de SiC Excesso de SiO2: 2SiC + SiO2 → 3Si + 2CO 4.2) Aquecimento do SiO2 com Mg ou Al: SiO2 + 2Mg → Si + 2MgO 3SiO2 + 4Al → 3Si + 2Al2O3 4.3) Aquecimento do Si grau metalúrgico a 300°C em uma corrente de HCl gasoso: Si(s) + 3HCl(g) → SiHCl3(g) + H2(g) O SiHCl3 obtido pode ser destilado vários vezes até as impurezas estarem abaixo de 1 ppb A reação reversa é espontânea a 1000°C, depositando Si ULTRAPURO SiHCl3(g) + H2(g) → Si(s) + 3HCl(g) 4.4) A obtenção de cristais ultrapuros é utilizado o refino por zona: As impurezas são mais solúveis na fase líquida que na fase sólida. O processo é repetido até atingir os níveis de pureza desejado. 4.5) Converter Si em SiCl4, purificar por destilação e reduzir o cloreto com Mg ou Zn: SiCl4 + 2Zn → Si + 2ZnCl2 SiCl4 + 2Mg → Si + 2MgCl2 Devido ao alto custo dos processos de purificação, o Si ultrapuro é cerca de 1000 vezes mais caro que o Si grau metalúrgico. 5) APLICAÇÕES 5.1) Na metalurgia para a produção de ligas metálicas Si grau metalúrgico Al-Si (liga leve): usado na indústria automotiva Aço: aumenta a elasticidade do aço 5.2) Semicondutores, transistores e células solares Utiliza Si ultrapuro Pureza necessária de 99,99999% Fabricação de computadores 6) REAÇÕES a) Si(s) + O2(g) → SiO2(s) Reação termodinamicamente favorecida, mas a cinética é lenta, logo necessita altas temperaturas (900°C) b) 2Si(s) + N2(g) → 2SiN(s) (T = 1400°C) 3Si(s) + 2N2(g) → Si3N4(s) c) Si(s) + X2(l) → SiX4(g) X = F (T = ambiente) X = Cl, Br, I (T = 300°C) d) Si(s) + 6HF(aq) → [SiF6]-2(aq) + 2H+(aq) + 2H2(g) e) Si(s) + 4NaOH(aq) → [SiO4]-4(aq) + 4Na+(aq) + 2H2(g) f) Si(s) + H2O(l) → não ocorre devido a SiO2 na superfície 7) COMPOSTOS DE SILÍCIO 7.1) Óxidos de silício 7.2) Silicatos 7.3) Silicones 7.4) Silanos (hidretos de silício) 7.1) ÓXIDOS DE SILÍCIO SiO: monóxido de silício Supõem-se que se forme na redução a altas temperaturas de SiO2 com Si: SiO2 + Si → 2SiO SiO2: dióxido de silício Principal óxido de Si Abundante na forma de areia e quartzo Chamado de sílica São conhecidas 35 formas cristalinas de SiO2, sendo as principais: São constituídos de tetraedros de SiO4 → o oxigênio é compartilhado por 2 tetraedros Diferença entre uma forma para a outra é a maneira como os tetraedros estão arranjados Quartzo é a forma mais comum: REAÇÕES a) SiO2(s) + 6HF(aq) → SiF6-2(aq) + 2H+(aq) + 2H2O(l) Reação usada para marcação e desenho em vidros b) SiO2(s) + 2NaOH(aq) → Na2SiO3(s) + H2O(l) Com solução aquosa de NaOH a dissolução é lenta Com NaOH fundido a dissolução é rápida Explica porque soluções de NaOH e KOH não podem ser guardados em frascos de vidros c) Dos halogênios somente o F ataca SiO2: SiO2 + 2F2 → SiF4 + O2 d) Insolúvel em água, quimicamente resistente SiO2 versus CO2 Como explicar? C-O Energia de ligação=358 kJ/mol C=O Energia de ligação=799 kJ/mol No caso do Si a ligação Si-O tem caráter parcial de dupla ligação (EL= 452 kJ/mol) devido a sobreposição dos orbitais d vazios do Si com os orbitais p preenchidos do oxigênio MATERIAIS A BASE DE SiO2 a) Sílica-gel: forma hidratada do SiO2 (SiO2.xH2O) Comercial possui 4% de H2O em massa, mas absorve muitas moléculas de H2O na sua superfície; Pode ser recuperada Usada em colunas cromatográficas b) Aerogel: SiO2 com grande número de poros Consiste de 99% de ar Isolante térmico e acústico c) Vidros: materiais não cristalinos descritos como líquidos superresfriados Conhecido e usado a 5000 anos Estima-se que a produção anual esteja em torno de 100 milhões de toneladas sólido, líquido ou outro estado da matéria? •Quartzo: produzido pelo aquecimento de SiO2 puro acima de 2000°C e depois moldado •Cristal: contém PbO, possui alto índice de refração Usado em tubos de raios catódicos •Borossilicatos: contém B e às vezes Al Possui baixo coeficiente de expansão e podem resistir a grandes variações de temperatura sem quebrar Pyrex; vidro refratário: material de laboratório •Vidro comum: obtido fundindo CaCO3 com SiO2 Janelas Na2CO3+SiO2: vidro de sódio usado em equipamentos barato de laboratório 7.2) SILICATOS 95% da crosta terrestre constituída por minerais do grupo dos silicatos Geralmente são insolúveis em água e solventes orgânicos •Exceção: silicatos solúveis (silicatos alcalinos) •SiO2(s) + 2NaCO3(l) → Na4SiO4(s) + 2CO2(g) Reagem com a água dura formando silicatos de cálcio insolúveis •Na4SiO4(s) : usado em tintas a prova de fogo; adesivos; fabricação da sílica-gel Os silicatos se baseiam em unidades de (SiO4)-4 •Si tetracoordenado por 4 oxigênios nos vértices de um tetraedro •Na estrutura de um cristal, os cátions ocupam as posições mais afastadas possíveis (distribuem-se nos insterstícios octaédricos e tetraédricos) A diferença de eletronegatividade entre O e Si (3,5-1,8=1,7) sugere que a ligação são quase 50% iônica e 50% covalente ZEÓLITAS Silicato com estrutura muito aberta, semellhante a favos de mel Canais sufucientemente largos para permitir a troca de certos íons Podem absorver ou perder água e outras moléculas pequenas, sem haver quebra na estrutura Na natureza: 40 tipos Sintéticos: 150 tipos Principais aplicações: Troca iônica; agentes de adsorção; separação de gases e catálise. ZSM-5: zeólita sintética mais conhecida (Mobil oil) Na3[(AlO2)3(SiO2)].xH2O 7.3) SILICONES Também chamados de polisiloxanas, são polímeros de organosílicios Fórmula geral: [R2SiO]n (R= grupo orgânico) Obtenção: Si(s) + 2CH3Cl(g) → (CH3)2SiCl2(l) A adição de água causa hidrólise: (CH3)2SiCl2(l) + 2H2O(l) → (CH3)2Si(OH)2(l) + 2HCl(g) Os compostos se polimerizam, com perda de água: OH H3C Si H3C CH3 -H2O OH OH HO CH3 Si Si OH H3C OH CH3 OH CH3 Si OH O Si CH3 O CH3 CH3 Si H3C CH3 OH CH3 -H2O H3C Si CH3 n CH3 O Si Si H3C OH O CH3 As propriedades dependem: 1) Do nº de unidades repetitivas: quanto maior a cadeia, maior a viscosidade e maior o ponto de ebulição Podem variar de consistência: líquido → gel → borracha → plástico duro 2) Do tipo e do tamanho do substituinte alquila 3) Reticulação: duas cadeias se unem formando borracha Si O Si O Si O Si O Si O Si APLICAÇÕES 1) Polímeros com cadeias de 20 a 500 unidades são utilizados como fluídos são mais estáveis que os óleos hidrocarbonetos viscosidade varia pouco com a temperatura 2) Repelente de água: silicone é rodeado por substituintes orgânicos, que visto de fora se assemelha aos alcanos 3) Implantes de silicone: devido a sua inércia fisiológica (questionável) O corpo humano não possui mecanismo de quebrar a ligação Si-O. Assim, o sistema imunológico é acionado para eliminar os fragmentos, causando problemas médicos. ORGANOSILÍCIO Compostos contendo ligações Si-C Maioria inerte e estáveis ao calor A grande variedade de compostos orgânicos não é repetida pelo Si: 1º) Si apresenta reduzida tendência a ligar-se a ele próprio (catenação) 2º) As ligações Si-Si são mais fracas que C-C Ligação Energia de ligação (kJ/mol) As cadeias mais longas de Si são: C-C 348 Si16F34 e Si8H18 Si-Si 297 Ge-Ge 260 Sn-Sn 240 3º) Si não forma ligações duplas 7.4) SILANOS Hidretos saturados de silício Fórmula geral: SinH2n+2 Apresentam cadeias normais ou ramificadas com no máximo 8 átomos de Si Diferente do carbono que forma numerosos compostos com tamanhos variados de cadeia Não há análogos de alcenos e alcinos de Si SiH4: hidreto de silício mais importante Diferença no comportamento entre silanos e alcanos 1º) Eletronegatividade: C= 2,5; Si= 1,8 e H= 2,1 Os elétrons das ligações C-H e Si-H não são distribuídos de modo homogêneo Cδ-—Hδ+ Siδ+—Hδ- Mais vulnerável ao ataque de reagentes nucleofílicos 2º) O maior tamanho do Si facilita o ataque de reagentes 3º) Si apresenta orbitais d de baixa energia que podem ser usados na formação de estruturas intermediárias Ácidos Silícicos: formados pela ação de ácidos sobre soluções de silicatos alcalinos H4SiO4 → ácido ortosilícico (ácido muito fraco)
Baixar