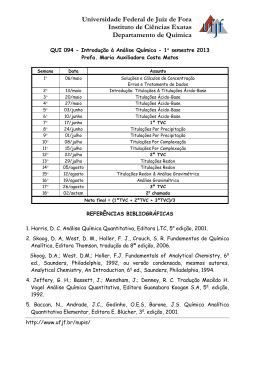
FACULDADE SANTA TEREZINHA - CEST COORDENAÇÃO DO CURSO DE NUTRIÇÃO PLANO DE ENSINO DADOS DA DISCIPLINA CÓDIGO NOME 0311 Química Analítica CARGA HORÁRIA 60 h Teórica 40 h Prática 20 h PERÍODO 2º HORÁRIO Segunda a sexta-feira 07h30 às 09h10 (T) 09h20 às 10h10 (P) GI 10h10 às 11h00 (P) GII PROFESSOR Prof. Dr. Silvio Carvalho Marinho EMENTA Introdução à química analítica. Estudo das soluções e concentração de soluções. Equilíbrio químico. Teoria das reações ácido-base. pH e sistemas tampão. Reações de neutralização, precipitação, complexação e oxi-redução. Métodos quantitativos de análise química: volumétricos, gravimétricos, potenciométricos e espectrofotométricos. OBJETIVOS DA DISCIPLINA Geral Entender a importância da Química Analítica como ferramenta na análise bromatológica e nutricional com a finalidade de identificação e/ou quantificação de espécies ou elementos químicos em alimentos. Específicos Compreender os conceitos fundamentais da Química Analítica quanti e qualitativa, reconhecendo os principais métodos de análises e cálculos envolvendo concentrações e diluições no preparo de soluções químicas. Utilizar os conceitos de equilíbrio químico para a previsão das reações em meio aquoso, relacionando os princípios do equilíbrio químico com as reações biológicas. Entender a teoria das reações ácido-base e sua aplicação no conhecimento acerca de alimentos ácidos e alcalinos. Aplicar os fundamentos da volumetria, gravimetria, potenciometria e espectrofotometria na identificação e quantificação de amostras alimentícias. CONTEÚDO PROGRAMÁTICO UNIDADE 1 – Introdução à Química Analítica (15 horas) 1.1 Análises qualitativa e quantitativa 1.2 Métodos de análise 1.3 Tipos de amostra 1.4 Concentrações e diluição de soluções 1.5 Preparo de soluções UNIDADE 2 – Equilíbrio químico (15 horas) 2.1 Lei da ação das massas 2.2 Princípio de Lê Chatelier 2.3 Equilíbrio iônico 2.4 Diluição de Ostwald 2.5 Efeito do íon comum 2.6 pH, pOH e constante Kw, 2.7 Hidrólise de sais e constantes Kh, Ka e Kb 2.8 Ação tamponante de uma solução UNIDADE 3 – Teoria das reações ácido-base (15 horas) 3.1 Acidimetria e alcalimetria 3.2 Teoria dos indicadores ácido-base 3.3 Produto de solubilidade e Kps 3.4 Íons complexos 3.5 Substâncias complexantes 3.6 Potenciais de oxi-redução UNIDADE 4 – Métodos quantitativos de análise química (15 horas) 4.1 Titulações ácido-base 4.2. Titulações por precipitação 4.3. Titulações complexométricas 4.4. Titulações de oxi-redução 4.5. Curvas de titulação 4.6. Cálculos gravimétricos 4.7. Potenciometria 4.8. Absorção na região do UV-Vis PROCEDIMENTOS DIDÁTICOS Aula dialogada; Pesquisa em grupos; Aplicação de exercícios; Realização de aulas práticas laboratoriais. TRABALHOS DISCENTES EFETIVOS - TDEs TDE 1: Utilização de artigo científico (4h) TDE 2: Utilização de um texto (4h) TDE 3: Estudo dirigido utilizando um texto (4h) RECURSOS DIDÁTICOS Quadro branco e acessórios; data show. SISTEMA DE AVALIAÇÃO A avaliação da disciplina será realizada através de verificações, individuais ou em grupo, feitas ao longo da disciplina (formativa), cumulativas, resultando em três notas atribuídas (somativa). Serão levados em consideração a participação qualitativa durante as atividades, o interesse, a assiduidade, a objetividade, a capacidade de análise e síntese, escrita e oral, clareza de ideias, raciocínio lógico, sobretudo no entendimento de questões, bem como o desempenho das habilidades laboratoriais e sua interrelação com as abordagens teóricas. Além dos aspectos qualitativos, serão observados os critérios objetivos regimentais: três notas parciais (com aproximadamente 1/3 do conteúdo trabalhado, cumulativamente ou não) que serão compostas da seguinte forma: (i) avaliações escritas individuais (provas) na proporção mínima de 70%; (ii) atividades acadêmicas individuais, na proporção de até 30% (quando estas se fizerem necessárias). Estão previstas como atividades acadêmicas: a leitura, análise e produção escrita a partir de texto e artigo científico indicado pelo docente. Em consonância às normas institucionais, não obtendo média para aprovação a partir das três notas parciais, o discente poderá fazer as Provas Substitutiva e Final. Ressalte-se que o discente deverá ter assiduidade mínima de 75% em sua frequência, caso contrário será reprovado. Os critérios de avaliação da disciplina serão discutidos detalhadamente em sala de aula no primeiro encontro com a turma. ARTIGO CIENTÍFICO E TEXTO PARA ATIVIDADES ACADÊMICAS Artigo: MARINHO, S.C. et al. Determinação e avaliação da concentração de cobre em aguardentes de cana produzidas artesanalmente no Maranhão. Revista Higiene Alimentar, v. 26, p.181-184, 2012. Texto: FUNDAÇÃO UNIVERSIDADE DO ESTADO DE MATO GROSSO. Precisão e Exatidão de Medidas I. Departamento de Matemática. Disponível em: < http://www.unemat-net.br/ prof/ foto_p_downloads/medidas-1.pdf > Acesso em 29 dez. 2013. REFERÊNCIAS BÁSICA: BACCAN, N.; ANDRADE, J.C.; BARONE, J.S.; GODINHO, O.E.S. Química Analítica Quantitativa Elementar. 3.ed. São Paulo: Edgard Bucher, 2001. CISTERNAS, J.R.; MONTE, O.; VARGA, J. Fundamentos de bioquímica experimental. São Paulo: Atheneu, 2005. MENDHEM, J.; DENNEY, R.C.; BARNES, J.D.; THOMAS, M.J.K. Vogel: Análise Química Quantitativa. Rio de Janeiro: LTC, 2002. COMPLEMENTAR: AIRES, M.M. Fisiologia. 2. ed. Rio de Janeiro: Guanabara Koogan, 1999. HARRIS, Daniel C. Análise Química Quantitativa. Rio de Janeiro: LTC, 2005. HARRIS, D.C. Explorando a Química Analítica. 4. ed. Rio de Janeiro: LTC, 2011. SKOOG, D.A. Fundamentos de Química Analítica. São Paulo: Cengage, 2009. SKOOG, D.A.; CROUCH, S.R.; HOLLER, F.J. Princípios de Análise Instrumental. 6. ed. São Paulo: Bookman, 2009. São Luís, 04 de janeiro de 2014. Prof. Dr. Silvio Carvalho Marinho
Baixar