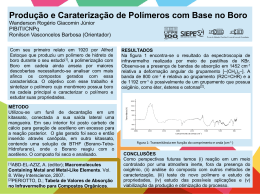
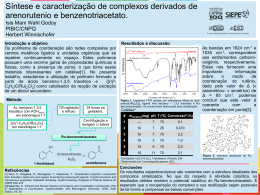
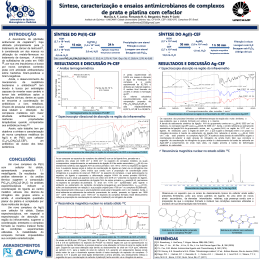
Espectroscopia no Infravermelho Análogo ao UV: irradiação da amostra com luz I.V. Parte absorvida (A) Parte transmitida (T) Espectro I.V : %A (ou %T) versus freqüência ou comprimento de onda ou número de ondas. Faixa do I.V.: 4000 a 600 cm-1 ou 2,5 a 15,0 µm Unidade: comprimento de onda: µm (menos utilizada) Número de onda: cm-1 (mais utilizada) Espectro no Infravermelho: espectroscopia vibracional, mede diferentes tipos de vibração entre átomos de acordo com suas ligações interatômicas. Vibrações Moleculares Modelo simplificado da ligação química entre 2 átomos. Ligação ≡ mola 1 De acordo com a lei de Hooke = 1/2 . (k/(m1m2/(m1 + m2)))1/2 ou = 1/2 . (k/ )1/2 ν = freqüência k = constante de força da ligação m1, m2 = massa dos átomos 1 e 2 = m1. m2 / m1+ m2 = massa reduzida do sistema. Exemplo: C H k = 500 N.m-1 = 5,0 x 105 g.s-2 ν = 1/2π . (k/(m m /(m + m ))) 1 2 1 2 1/2 mC = 2,0 x 10-24g mH = 1,6 x 10-24g = 7 x 2 x 22 ( 5,0 x 105 g.s-2 ) (2,0 x 10-24g )(1,6 x 10-24g)/ (2,0 x 10-24g )+(1,6 x 10-24g) = 9,3 x 1013 s-1 ν = no de onda = ν/c = 9,3 x 1013 s-1/ 3,0 x 108 m s-1 = 3100 cm-1 2 Importante: A freqüência vibracional de uma ligação deve aumentar com o aumento da força de ligação. A freqüência vibracional de uma ligação deve aumentar com a diminuição da massa reduzida do sistema. logo, para um MESMO TIPO DE VIBRAÇÃO, a freqüência de vibração para as ligações simples, duplas e triplas aumenta neste sentido: C C> C=C > N> C=N > C–O C–C da mesma maneira: C C=O > C–N (assim por diante) Modos de Vibração Para uma molécula não linear com n átomos, existem 3n - 6 modos de vibração. Para moléculas muito grandes e com diferentes tipos de ligação ⇒ muitos modos de vibração ⇒ espectros complexos. No espectro de IV: detecção de modos mais característicos de vibração. Para um sistema AX2 (CH2, NH2, NO2) existem os seguintes modos de vibração: 3 Modos de Estiramento (stretching) Assimétrico Simétrico No Plano Tesoura Modos de Deformação (bending) Fora do Plano Rotação Cada tipo de vibração Twist Wag uma banda de absorção Outros tipos de vibração: fora da ν infravermelho. Algumas vibrações têm mesma freqüência: sobreposição Bandas no espectro ⇒ vibração deve produzir uma radiação no momento dipolar da ligação (logo, uma variação no campo elétrico da ligação) que irá interagir com as ondas eletromagnéticas da luz provocando absorção. Diferentes ligações químicas possuem diferentes freqüências vibracionais. O espectro no infravermelho indica a presença destes diferentes tipos de ligações nas moléculas. Tipos de ligações facilmente detectáveis por I.V.: C – C, C – H, C – O, C – N, C – S, C – P, C – M, etc. C = C, C = O, C = N, C = S, S = O, N = O, C = P, C≡C, C≡N, N≡O, etc) 4 Exemplos de espectros: Fatores que influenciam as freqüências vibracionais Diversos fatores influenciam e um efeito está ligado a múltiplos fatores. O Ex: C=O em uma cetona R O em um cloreto da ácido R C C CH 3 é menor que C=O que pode ser devido: Cl Diferença de massa entre CH3 e Cl Efeito indutivo ou mesomérico do Cl sobre a ligação C = O. Efeitos estéricos (de volume) que afetam σ ângulos de ligação. Acoplamento vibracional entre as ligações C = O e C – Cl. 5 Acoplamento Vibracional Numa ligação C–H isolada ⇒ só uma freqüência estiramento nas vibrações de estiramento em grupo CH2 ou CH3 se combinam para produzir vibrações acopladas: de estiramento simétrico e assimétrico. Vibrações de estiramento CH3 ≠ vibrações de estiramento CH2. Acoplamento vibracional acontece entre duas ligações que vibram com freqüências similares produzindo bandas de absorção com freqüências próximas. As vibrações de acoplamento podem ser resultantes do acoplamento de vibrações fundamentais (no caso AX2) ou uma vibração fundamental pode acoplar com a banda de overtone de outra vibração, gerando a ressonância de Fermi. AX2: apresentam acoplamento vibracional gerando duas bandas de absorção de estiramento simétrico e assimétrico: νantissimétrico(cm-1) νsimétrico(cm-1) 3000 2900 Exemplos - CH2 - NH2 - NO2 = O 3400 3300 1500 1400 1350 1150 1600 1400 N O O SO2 = S O O M C O 6 Outros grupos que apresentam acoplamento vibracional são os anidridos de ácidos carboxílicos: O R O O C O C R R C O O O C C R R O C O R fornecem duas bandas de estiramento simétrico e assimétrico, entre 1800 e 1900 cm-1, separadas de aproximadamente 65 cm-1. Acoplamento entre as duas ligações C = O através da ligações O C – O – C: O Amida: R C 1 N N R R C 1 R 2 2 cm-1, Duas bandas de absorção entre 1600 e 1700 devido à vibração de estiramento C = O e de deformação N – H, e também por causa do efeito de ressonância. São chamadas de bandas de amida I e II. Ligações Hidrogênio R Principalmente em compostos contendo O H N e H São afetadas pela natureza do solvente: solventes polares ⇒ efeitos mais pronunciado (acetona, benzeno) do que solventes menos polares (CCl4, CS2 e CHCl3) a) ligações hidrogênio em álcoois e fenóis. Álcoois e fenóis em fases condensadas (filme líquido, em nujol ou KBr) tendem a formar fortes ligações H, na forma de associações poliméricas dinâmicas ⇒ alargamento da banda R de -OH (3500 cm-1) O H R O H O R H R H O H H R O O R 7 b) Enóis e quelatos: Ligação H fortes ⇒ freqüência de estiramento – OH pequenas (abaixo 2800 cm-1) O CH 3 H O O O O H Salicilato de metila O Phe C C Phe O O Pentano- 2,4 – diona (acetilacetona) H H O Dímero do ácido benzóico banda larga: 2500 – 3000 cm-1 c) Aminas: Em fase condensada (filme líquido, nujol e KBr) o estiramento N – H em ligações hidrogênio aparece em 3300 cm-1 em soluções diluídas (sem ligações de H) a 3600 cm-1. N menos eletronegativo que O ⇒ ligações de H afetam menos a posição de bandas de aminas. Efeitos Eletrônicos Efeitos indutivos ⇒ eletronegatividade Efeitos mesoméricos ⇒ presença de pares de e- desemparelhados. a) Conjugação diminui a freqüência de estiramento C = O em compostos carboxílicos. Ex.: O 1720 cm-1 O 1700 cm-1 O 1700 cm-1 Além disso, grupos substituídos em posições meta ou para doadores de elétrons diminuem ainda mais a freqüência de estiramento C = O. 8 Exemplo: Diminui o caráter de ligação dupla da acetona diminuição da força de ligação diminuição da freqüência da absorção. O O CH 3 b) Idem para hidrocarbonetos instaurados 1650 cm-1 1610 cm-1 c) Efeitos indutivos ocorrem paralelamente a efeitos de ressonância (mesoméricos) Exemplos: Amidas: o efeito +M (mesomérico doador) do nitrogênio predomina sobre o efeito -I (eletronegativo) do nitrogênio, diminuindo o caráter de dupla ligação C=O e diminuindo a freqüência de estiramento C=O. O O O NH 2 1720 cm-1 NH 2 1650 – 1690 cm-1 9 Cloretos de Ácido: o efeito -I do cloro predomina sobre o efeito +M , aumentando o caráter de dupla ligação C=O e aumentando a freqüência de estiramento C=O. O O Cl 1720 cm-1 1740 – 1760 cm-1 Ésteres: alquil ésteres têm menores estiramento C=O do que aril ésteres. freqüências de O O R O R = CH3, CH2CH3, etc O 1750 – 1780 cm-1 1740 cm-1 10 Manipulação e Instrumentação Espectrômetro Fonte Monocromadores Detectores Modo de funcionamento Calibração Amostragem Espectrômetros: fonte de luz infravermelha monocromador detector Fontes: filamento de várias composições: “Nernest glower”⇒ óxidos de Zr, Y, Er; “globar”⇒ carbeto de silício; filamento de cerâmica. Monocromadores: prismas e “pentes”. Prismas de NaCl, CsI, ThBr + ThI. Pentes ⇒ melhores resoluções que prisma e não são higroscópicos. Detectores: de termopilha. 11 Modo de funcionamento: ver UV. Calibração: espectro de poliestireno (freqüências conhecidas) geralmente pico em 1601 cm-1. espectro Amostragem: - cela p/ amostras gasosas - cela p/ soluções -pastilhas de KBr 12 Acessórios: Reflectância difusa Reflectância especular Aplicações da Espectrometria no Infravermelho Identificação de grupos funcionais Grupos funcionais característicos ⇒ absorções típicas Identificação TOTAL de um composto por IV: muito difícil. Deve-se conhecer a proveniência do composto e as suas propriedades químicas e físicas características. Espectro no infravermelho: muito útil para indicar a presença de grupos funcionais característicos que absorvem entre 1400 e 4000 cm-1. 13 Regras básicas: Verificar a presença de esqueleto carbônico: freqüência de estiramento C – H freqüência de deformação C – H b) Verificar a presença de grupos carboxílicos: freqüência de estiramento C = O para cetonas freqüência de estiramento C = O associada com freqüência de estiramento C – H para aldeídos freqüências de estiramento C = O associada com freqüência de estiramento C – O para ésteres e etc. c) Verificar presença de bandas fenóis, ácidos, enóis, etc. OH características de álcoois, d) Verificar presença de bandas NH de aminas, sais de amônio quaternários, amidas, imidas, guamidinas, etc. e) Presença de triplas ligações, como C≡C ou C≡N f) Presença de grupos sulfurados como SH, S = O, SO2, etc. g) Presença de grupos fosforados, como P = O, P = N, etc. 14 O Esqueleto de Carbono 1.Grupos Aromáticos Bandas de deformação C – H ,bandas de estiramento C = C e C – H. Bandas de estiramento C – H de aromáticos são menores (menos intensas) que bandas de estiramento C – H de alcanos. Além disso, as bandas de estiramento CH de aromáticos ocorrem ACIMA de 3000 cm-1 enquanto as bandas de estiramento CH de alcanos ocorrem ABAIXO de 3000 cm-1. benzeno Banda em 1400-1450 cm-1 se refere à freqüência do estiramento C=C, mas na maioria dos compostos aromáticos substituídos, ou em espectros complexos, esta banda está ausente. As freqüências das bandas devido às vibrações de deformação C – H fora do plano são características e de intensa absorção devido a vibrações acopladas eletronicamente. A presença e o padrão destas bandas podem ajudar no estabelecimento da posição de SUBSTITUINTES no anel aromático. Esta banda ocorre acima de 800 cm-1 para benzeno para-substituídos. As bandas entre 1650 e 2000 cm-1 são de overtone e de combinação das absorções de deformação C – H. 15 2. Grupos Alcanos Bandas de estiramento C – H e de deformação C – H são intensas em espectros de alcanos. Bandas de estiramento C – H apresentam-se na forma de duas bandas abaixo de 3000 cm-1 . Aparelhos de Infravermelho de alta resolução podem apresentar até quatro bandas (devido ao estiramento simétrico e anti-simétrico). Grupos metilas, H3C-, podem ser diferenciados com facilidade devido às bandas de deformação C – H anti-simétrica em torno de 1390 cm-1. CH 3 H C 3 Por exemplo, grupos C H3 C C e H3 C C CH 3 possuem absorções características. Bandas de alcanos entre 800 e 1300 cm-1 são difíceis de serem atribuídas. 16 3. Grupos Alceno Muitas semelhanças com grupos aromáticos. A presença dos dois grupos na mesma molécula torna sua detecção difícil. Bandas de deformação C – H fora do plano em grupos C = C – H ocorrem entre 1800 e 2000 cm-1. Alquenos trans substituídos dão bandas em 970 cm-1 , cis substituídos apresentam bandas em 700 cm-1. Alquenos tetra-substituídos não apresentam bandas de estiramento C = C, ou então são muito fracas. As bandas de estiramento C = C em alquenos tri-, di- ou mono-substituídos ocorrem na região de 1600 cm-1. Exemplo: espectro Ligações duplas vizinhas, como em alenos, C = C = C, fornecem absorções intensas em 2000 cm-1. Exemplos são alenos (1950 cm-1 ) cetenos, C = C = O (2150 cm-1), isocianatos, - N = C = O (2250 cm-1 ), isotiocianatos, - N = C = S (2100 cm-1) e azidas, - N = N = N (2140 cm-1). 17 4. Grupo Alcino Alcinos terminais, R – C ≡ C – H, são fáceis de serem detectados devido à presença da banda forte de estiramento C – H em 3300 cm-1 e uma banda de estiramento C ≡ C de menor intensidade a 2200 cm-1. Alquinos di-substituídos são muito difíceis de serem detectados, bandas C ≡ C muito fracas. Grupos Funcionais Funções contendo um grupo carbonila O grupo carbonila é o grupo mais estudado em infravermelho. A banda de estiramento C = O é sempre intensa, possuindo uma banda de overtone fraca a 3400 cm-1. 18 Aldeídos e Cetonas (incluindo Quinonas) Aldeídos possuem a banda de estiramento C = O ocorrendo entre 1700 e 1720 cm-1, conjuntamente com bandas de deformação C – H entre 800 e 1400 cm-1. Estas últimas são menos intensas e mais difíceis de serem atribuídas. Aldeídos conjugados têm a freqüência da banda de estiramento C = O diminuída (1685 – 1710 cm-1) incluindo aldeídos aromáticos: H O O H O O benzaldeido H furfural Cetonas Têm comportamento análogo aos aldeídos. Cetonas saturadas alifáticas têm bandas de estiramento C = O em torno de 1700 cm-1. A conjugação diminui a freqüência aumentada de acordo com a diminuição do tamanho do anel. O Ciclobutanona ν C = O 1770 cm-1 O O Ciclopentanona ν C = O 17401750 cm-1 Ciclohexanona ν C = O 1700 cm-1 19 α-dicetonas têm freqüência de estiramento C = O acima de 1720 cm-1. O R' R O β-dicetonas têm freqüência de estiramento C = O abaixo 1650 cm-1 devido à enolização: H O O R O R' R H O O R' R O R' Quinonas p-quinonas têm freqüência νC=O ∼ 1650 cm-1 enquanto quinonas com carbonilas em diferentes anéis têm sua freqüência de estiramento diminuída. O O O ∼ 1650 cm-1 O ∼ 1620 - 1600 cm-1 20 Ésteres e Lactonas A banda de estiramento C = O de ésteres ocorre na região de 1740 cm-1, incluindo formiatos, acetatos e ésteres de cadeia longa; outra banda característica de ésteres ocorre entre 1180 e 1250 cm-1 devido ao estiramento da ligação C – O. A presença de uma dupla ligação conjugada à função éster diminui a freqüência de absorção do grupo C = O. Se a insaturação é em posição α ao grupo – O –, a freqüência de absorção aumenta. O O O νC = O = 1740 cm-1 O νC = O = 1760 cm-1 O νC = O = 1720 cm-1 νC = O = 1760 cm-1 O O O O O O νC = O = 1750 cm-1 O νC = O = 1800 cm-1 21 Como para cetonas, α-ceto ésteres têm sua freqüência de estiramento C = O deslocada para maior no de onda, enquanto β-ceto ésteres para menores. O O O CH 2 CH 2 O CH 3 CH 3 O νC = O = 1740 cm-1 νC = O = 1750-1760 cm-1 H O O O O CH 2 CH 3 O O CH 2 CH 3 νC = O = 1640-1670 cm-1 Ácidos Carboxílicos e Carboxilatos Fáceis de detectar: bandas de estiramento – O – H entre 2500 e 3100 cm-1. Bandas de estiramento C = O: - ácidos saturados : 1700 – 1720 cm-1 - ácidos insaturados: 1690 – 1710 cm-1 - ácidos aromáticos: 1680 – 1700 cm-1 - ânion carboxilato: 1550 – 1630 cm-1 Além da banda de estiramento C – O entre 1230 e 1320 cm-1 22 Espectro de isoamida. Filme liquído Sais de íons carboxilato possuem freqüentemente bandas largas em 3400 cm-1 devido ao fato de serem higroscópicos. Estas bandas resultam de associações inter-moleculares: R' O R H N C N H O C R R' 23 O NH 2 Amidas tendem a formar dímeros e polímeros associados, e devido ao caráter mesomérico da ligação amida, podem assumir diferentes conformações, complicando o acoplamento vibracional e a interpretação “racional” do espectro IV destes compostos: O O R R C C Ligação amida NH 2 NH 2 O O C R N H R' Monômero cis C R N R' H Monômero trans 24 Aminoácidos Aminoácidos existem na sua forma zwinteriônica ou protonada. Na forma protonada, a freqüência de absorção do grupo C = O é maior que na forma zwinteriônica: NH 3 CO 2 NH 3 H CO 2 H νCO 1570 – 1610 cm-1 νCO 1580 – 1620 cm-1 1400 – 1430 cm-1 1300 – 1430 cm-1 simétrica e anti-simétrica Anidridos de ácidos Anidrido acético, anidrido propiônico e outros anidridos saturados possuem 2 bandas de estiramento C = O: - uma entre 1800 e 1850 cm-1 - a outra entre 1750 e 1800 cm-1 Anidridos insaturados (com ftalatos), têm suas duas bandas, com respectiva freqüência diminuídas: - uma em 1790 e 1830 cm-1 - e outra em 1750 e 1770 cm-1 Além das bandas de estiramento C – O características entre 1050 e 1170 cm-1. 25 Amidas Amidas primárias ou secundárias possuem um par característico de bandas a 3200 e a 3400 cm-1. A separação de bandas em espectros feitos em KBr é tabelada: freqüências de absorção em fase sólida. Em fase líquida, o grau de associação diminui, e a banda de estiramento N–H aumento de freqüência enquanto as bandas de estiramento C = O e de deformação N – H diminuem. As vibrações N–H provém seja de dímeros, monômeros, ou cadeias de dímeros (“polímeros”), e varia de acordo com o grau de associação (que depende da concentração). O Amidas primárias R em soluções diluídas possuem C NH 2 νN – H em 3400 e 3500 cm-1 . Em amidas secundárias a segunda banda νN – H aparece em 3450 cm-1. As bandas de estiramento C = O e de formação N – H são vibrações acopladas devido ao caráter mesomérico da ligação amida. Com isso fornecem duas bandas: a primeira (νC = O ) entre 1650 e 1690 cm-1 e a segunda (Def N – H ) entre 1630 e 1660 cm-1. 26 Halogenetos de Acila O Cloreto de acila: H3 C C Cl O Cloreto de propila: H 3 C CH 2 C Cl E outros halogenetos de acila dão bandas de estiramento C = O entre 1770 e 1820 cm-1. Os espectros devem ser feitos em fase líquida ( CHCl3) ou em disco de KBr. Compostos contendo grupos hidroxila Compostos contendo grupos hidroxila apresenta bandas de estiramento O–H larga devido à associação inter- e intramoleculares como conseqüência de deformação de ligações hidrogênio. Bandas O–H livres são observadas somente em soluções diluídas e em solventes que não formam ligações hidrogênio (CCl4, CS2) 27 Álcoois (incluindo carboidratos) A banda de estiramento O–H, entre 3300 e 3500 cm-1, é a absorção mais característica de compostos desta natureza. Outras bandas presentes são de estiramento C – O ( entre 1250 e 1400cm-1) e de deformação O–H (entre 1000 e 1200 cm-1), sua freqüência variando segundo o no de substituintes: álcoois primários e secundários absorvem em menores comprimentos de onda que álcoois terciários. Fenóis Além da banda característica entre 3300 e 3500 cm-1, fenóis exibem as bandas características de compostos aromático: de pequena intensidade em torno de 3000 cm-1(estiramento C–H aromático) e de pequena intensidade em torno de 1600 cm-1 (estiramento C = C). Às vezes a banda de estiramento O–H é tão larga que chega a esconder a banda de estiramento C – H acima de 3000 cm-1. 28 Éteres Difíceis de distinguir, pois a única absorção característica do estiramento C – O – C ocorre numa região aonde muitas outras absorções podem ocorrer. Éteres alifáticos : entre 1050 e 1150 cm-1 O Éteres do tipo: 1250 – 1300 cm-1 1030 – 1110 cm-1 O Éteres do tipo: Éteres do tipo: O R 1100 – 1300 cm-1 O o 1050 – 1150 cm-1 O O 1200 – 1300 cm-1 Epóxidos: Compostos Nitrogenados Aminas Como os álcoois, apresentam fortes associações devido à formação de ligações hidrogênio. R H H N H N R H H R N H H N R H H H N R Por isso apresentam bandas largas se a amostra está em estado condensado (filme líquido ou pastilha de KBr). Se em solução diluída, a banda larga desdobra-se em duas de maiores comprimentos de ondas. 29 Aminas primárias: 2 bandas : ∼ 3200 cm-1 e entre 3300 e 3500 cm-1 Aminas secundárias: entre 3200 e 3500 cm-1 Aminas terciárias: ausente R' Sais de amino quaternário: R ' ' ' N R 2 bandas intensas entre R'' 3000 e 3200 cm-1e entre 2500 e 2700 cm-1. Bandas de deformação N – H : entre 1570 e 1620 cm-1para aminas primárias e entre 1500 e 1620 cm-1 aminas secundárias. Aminas aromáticas, NH 2 , apresentam bandas de estiramento C – N entre 1250 e 1350 cm-1. Iminas R C NH R Banda muito larga na região entre 3000 e 3500 cm-1 (estiramento N – H ) e de menor intensidade entre 1630 e 1700 cm-1 ( estiramento C = N). Grupos Nitro - NO2 Apresentam bandas intensas entre 1500 e 1600 cm-1 e entre 1300 e 1400 cm-1 devido ao estiramento simétrico e anti-simétrico N = O. Nitrilas e Isonitrilas C N e C N Absorvem na região de ligações triplas devido ao estiramento C ≡ N: Nitrilas entre 2200 e 2300 cm-1 e isonitrilas entre 2100 e 2200 cm-1 30 Espectro de bensonitrila Compostos Halogenados (R – Cl , R – Br, R – I ) Absorvem em baixos comprimentos de onda. Halogenetos de alquila entre 650 e 800 cm-1 derivados clorados e entre 500 e 700 cm-1 para derivados bromados. Halogenetos de arila absorvem ainda mais baixo ( entre 400 e 500 cm-1) Compostos Sulfurados SH a)Mercaptanas ( R – SH ), Tiofenóis e O Tiolácidos R C : SH Bandas características: estiramento S – H entre 2450 e 2600 cm-1. 31 b) Sulfetos ( R – S – R ) , disulfetos ( R – S – S – R ), e S Tioácidos R C OH Estiramento C=S: entre 1050 e 1200 cm-1. Estiramento C–S: entre 600 e 700 cm-1. Estiramento S – S: entre 400 e 500 cm-1. c)Ácidos sulfônicos e sues respectivos sais ( SO3H e SO3-) Estiramento O – H: entre 3100 e 3500 cm-1. Estiramento S = O: entre 1150 e 1250 cm-1 e entre 1000 e 1100 cm-1 O d) Ésteres de sulfonatos R S O R' O Estiramento S = O: entre 1350 e 1450 cm-1. S e) Tioamidas R S e Tiouréias C HN 2 NH 2 C : NH 2 Estiramento N – H: 2 bandas entre 3200 e 3400 cm-1. Estiramento C = S: entre 1150 e 1400 cm-1. O S f) Sulfonamidas NR 2 R = H alquil. O Quando R = H : estiramentos N – H entre 3200 e3400 cm-1. Estiramento S = O : entre 1300 e 1350 cm-1 e entre 1130 e 1170 cm-1. O g) Sulfóxido S R R Estiramento S = O entre 1050 e 1100 cm-1 32 O h) Sulfonas R S R O Estiramento S = O ; entre 1130 e 1180 cm-1. Compostos Fosforados Estiramento P – H entre 2300 e 2450 cm-1 Estiramento P = O: entre 1200 e 1300 cm-1 entre 1150 e 1190 cm-1 entre 950 e 1050 cm-1 Estiramento: P – aril entre 1430 e 1470 cm-1 P – O – C entre 1200 e 1300 cm-1 Aplicações da Espectroscopia no Infravermelho Identificação por “Impressão Digital” O espectro no infravermelho contêm muitas absorções associadas com inúmeras formas de vibração das moléculas que são analisadas. Sendo assim, uma molécula em particular fornecerá uma série de bandas características, associadas com seu modo de vibração. Este padrão de absorção é característico desta molécula, constitui o que se chama de “impressão digital”: são as bandas situadas entre 900 e 1400 cm-1, que raramente são atribuídas. Desta forma, se comparados os espectros de 2 substâncias idênticas entre si, realizados nas mesmas condições (tipo de amostra, concentração), eles devem ser idênticos. Por conseqüência, os espectros de 2 compostos muito parecidos também devem ser muito semelhantes. 33 Exemplos: Br Cl O O H3 C CH 2 H3 C H3 C C CH 2 I O CH 3 4 CH 3 CH 2 C O H3 C CH 3 CH 2 5 CH 3 CH 3 34 This document was created with Win2PDF available at http://www.daneprairie.com. The unregistered version of Win2PDF is for evaluation or non-commercial use only.
Baixar