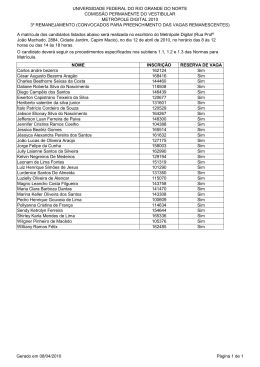
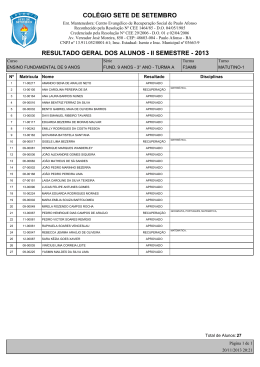
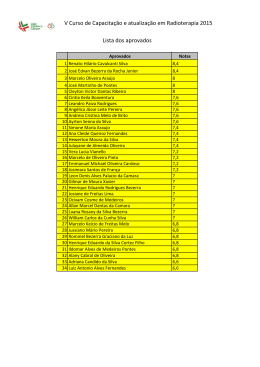
Prof. Willame Bezerra REAÇÕES DE OXIDAÇÃO Quando numa reação um mesmo elemento químico aparece com NOX diferente no reagente e no produto, isso significa que na reação ocorreu transferência de elétrons, ou seja, é uma reação de óxidoredução. Pode-se dividir as reações de oxidação que envolvem hidrocarbonetos em quatro grupos: combustão, oxidação branda, ozonólise e oxidação enérgica. Prof. Willame Bezerra COMBUSTÃO A combustão de uma substância é a sua queima em presença de oxigênio. Ou seja, o combustível é o hidrocarboneto, e o outro reagente, denominado comburente é o gás oxigênio (O2). Existem três tipos de combustão, sendo que a mais importante é a reação de combustão completa, cujos produtos são CO2 e H2O. Ex: Equações genéricas de combustão de hidrocarbonetos: Alcanos: 1 CnH2n+2 + ________ O2 → n CO2 + (n+1) H2O Alquenos e ciclanos: 1 CnH2n + ________ O2 → n CO2 + n H2O Alquinos e dienos: 1 CnH2n-2 + ________ O2 → n CO2 + (n-1) H2O Prof. Willame Bezerra Nessas reações, o carbono proveniente do hidrocarboneto forma sempre o mesmo produto (CO 2), cujo número de oxidação é +4, que é o máximo possível para esse elemento. Por esse motivo, ela é denominada combustão completa ou oxidação total de um hidrocarboneto. OXIDAÇÃO BRANDA Também conhecida com hidroxilação do alceno, é uma reação com um agente oxidante que causa uma adição à ligação dupla, com a entrada de uma hidroxila em cada um dos seus dois carbonos. O KMnO 4 (permanganato de potássio) em solução diluída e fria, em meio neutro ou levemente básico, é um agente oxidante, denominado reativo de Baeyer. ou simplesmente: Prof. Willame Bezerra TESTE DE BAEYER Alcenos e ciclanos possuem a mesma fórmula geral CnH2n. Assim, é frequente encontrarmos alcenos e ciclanos isômeros. Para diferenciá-los em laboratório, o químico alemão Adolf von Baeyer elaborou um teste baseado na oxidação branda com KMnO4 (de cor violeta). A lce n o s C icla n o s [O ] H 2 O B ra n d a [O ] H 2 O B ra n d a Reage N ã o re a g e Alcenos reagem, pois possuem ligação dupla, e ciclanos, não. Assim a cor violeta do KMnO 4, desaparecerá quando a substância for alceno, mas não quando for ciclano. Esse é o teste de Baeyer. Prof. Willame Bezerra OZONÓLISE Como o nome diz, trata-se da quebra pelo ozônio (O3). A reação é feita em meio aquoso e na presença de pó de zinco. A molécula de alceno é quebrada na dupla ligação e um átomo de oxigênio se adiciona a cada lado. A presença da água é fundamental para evitar as explosões que podem ocorrer se a ozonólise for feita na sua ausência. Prof. Willame Bezerra OXIDAÇÃO ENÉRGICA O alceno reage com um agente oxidante capaz de quebrar a molécula na ligação dupla e, além disso, caso seja formado aldeído, oxidá-lo a ácido carboxílico. Prof. Willame Bezerra Prof. Willame Bezerra OUTRAS REAÇÕES DE OXIDAÇÃO • Ozonólise de dienos São reações semelhantes às que ocorrem com os alquenos; porém, como há duas duplas ligações, ocorrerá a formação de duas ozonidas e sua posterior hidrólise. • Oxidação enérgica de dienos São reações semelhantes às que ocorrem com alquenos; porém, como há duas duplas liga ções, ambas serão rompidas no processo. Prof. Willame Bezerra • Oxidação enérgica de alquinos Os alquinos, ao sofrerem oxidação enérgica, produzirão sempre ácidos carboxílicos, desde que a tripla ligação não esteja situada na ponta da cadeia. Caso a tripla esteja na ponta da cadeia, ocorrerá a formação de CO 2 e H2 O, de maneira análoga ao que acontece com os alquenos. Prof. Willame Bezerra • Oxidação enérgica de cicloalcanos A oxidação enérgica de cicloalcanos acontece mais facilmente com os compostos cíclicos de 3 e 4 carbonos, devido a sua instabilidade, ocorrendo ruptura do anel:
Download