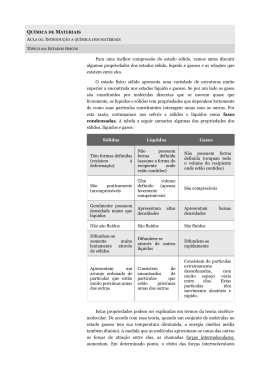
Os estados físicos e a água Para compreender as propriedades da matéria podemos utilizar o seguinte modelo: A matéria é formada por partículas que não podemos ver. Elas estão em contínuo movimento; quanto maior a temperatura, maior a velocidade das partículas. Entre as partículas de matéria existem forças de atração: quanto maior a distância entre elas, mais fraca é a força de atração. Os três estados físicos segundo este modelo Sólido, líquido e gasoso constituem os estados de agregação da matéria. De um modo geral, os materiais que nos rodeiam se encontram em um desses estados de agregação. Nos sólidos, as partículas estão fortemente atraídas, mantendo uma estrutura rígida. Elas movem-se em torno de um ponto fixo, mas sem mudar de disposição. Isso explica a forma e o volume fixos. Nos líquidos, a atração entre as partículas é menor que nos sólidos; elas podem deslocar-se e mudar sua posição, permitindo que o líquido adquira a forma do recipiente. Nos gases, praticamente não existe atração entre as partículas. Elas movem-se rapidamente, em grande velocidade, mantendo-se mais distantes umas das outras que nos líquidos e nos sólidos. Isso explica porque os gases podem ser comprimidos e porque são menos densos que os líquidos e os sólidos. A tabela abaixo informa sobre as características microscópicas mais comuns da matéria. característica sólido Líquido gasoso Organização das partículas organizado desorganizado Desorganizado Movimento das partículas Movimento de vibração em torno de um ponto fixo Movimentos de vibração e deslocamento de umas sobre as outras Movimento de vibração e movimento ao acaso, em todas as direções. Pouca liberdade de movimento Muito próximas umas das outras Liberdade intermediária Muito próximas, embora ligeiramente mais afastadas do que nos materiais sólidos. Muita liberdade de movimento Muito afastadas umas das outras, quando comparamos a distância entre as partículas com o tamanho de cada uma delas. Distância entre as partículas Congelamento, derretimento e fervura Muitas substâncias podem existir na forma de sólido, líquido ou gás. Por exemplo, normalmente, a água é líquida, mas quando refrigerada torna-se gelo. Quando aquecida, ela evapora e torna-se um gás chamado vapor d´água (existe diferença entre vapor e gás) . A fervura é uma forma muito rápida de evaporação que, para a água, acontece a 100º C em condições normais. Até mesmo o diamante pode derreter (a 3550º C) e ferver (a 4832º C). O oxigênio, por outro lado, normalmente é um gás, mas torna-se líquido a -183º C e sólido a -219º C. A mudança entre os estados sólido, líquido e gasoso – por exemplo, quando a água torna-se vapor – é chamada mudança física. Você ainda tem a mesma substância química. Muitos compostos não derretem porque ocorre uma mudança química antes que isso possa acontecer. Por exemplo, se você aquecer madeira, ela não derrete, e sim pega fogo. A combustão é uma mudança química que transforma a madeira em outros compostos que contém oxigênio. O gelo, a água líquida e o vapor de água são constituídos por moléculas de água. A diferença entre eles está no espaçamento das moléculas. No gelo, as moléculas estão firmemente presas entre si, em uma estrutura regular. Mesmo em um sólido como o gelo, as moléculas vibram. Quando o gelo muito frio é aquecido, as vibrações ficam mais violentas até que, ao final, as uniões entre as moléculas começam a desfazer-se e o gelo derrete. Na água líquida, as uniões estão sempre se partindo e se reformulando. As moléculas são livres para mudar de posição, de modo que o líquido pode fluir. Se a água líquida for aquecida, algumas vibrações são tão violentas que as uniões se rompem completamente. As moléculas podem distanciar entre si, formando o vapor d´água. Quando uma substância passa de uma fase para outra, dizemos que ocorre uma mudança de fase ou mudança de estado de agregação. As mudanças de fase possíveis a uma substância e seus respectivos nomes estão representados na figura. Referências Bibliográficas Ciências OXFORD – Charles Taylor e Stephen Pople Os fundamentos da Física – Nicolau, Ramalho e Toledo 10 ed – São Paulo: Moderna, 2009 Construindo Consciências – 9º ano EF – APEC – 2 ed – São Paulo: Scipione, 2006. Ciências 8º ano EF - Projeto araribá - 1 ed - Moderna
Baixar