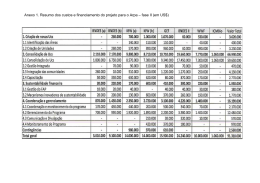
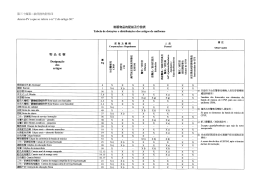
70 ISSN 1677-7042 1 Nº 131, segunda-feira, 13 de julho de 2015 RESOLUÇÃO - RE N° 1.961, DE 9 DE JULHO DE 2015(*) RESOLUÇÃO - RE Nº 1.965, DE 10 DE JULHO DE 2015(*) FUNDAÇÃO NACIONAL DE SAÚDE O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o cumprimento dos requisitos de Boas Práticas de Fabricação preconizados em legislação vigente, para a área de Insumos Farmacêuticos, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo, a Certificação de Boas Práticas de Fabricação de Insumos Farmacêuticos. Art. 2º A presente Certificação tem validade de 02 (dois) anos a partir da sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o descumprimento dos requisitos de Boas Práticas de Fabricação de Medicamentos, ou o descumprimento dos procedimentos de petições submetidas à análise, preconizados em legislação vigente, resolve: Art. 1º Indeferir o(s) Pedido(s) de Certificação de Boas Práticas de Fabricação de Medicamentos da(s) empresa(s) constante(s) no anexo. Art. 2º Esta Resolução entra em vigor na data de sua publicação. PORTARIA Nº 448, DE 6 DE JULHO DE 2015 JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE N° 1.962, DE 10 DE JULHO DE 2015 JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE Nº 1.966, DE 10 DE JULHO DE 2015 O Diretor da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando a necessidade de alteração no Certificado de Boas Práticas de Fabricação, resolve: Art. 1º Alterar a razão social da empresa fabricante DSM Pharmaceuticals, Inc. para Patheon Manufacturing Services LLC na Resolução RE nº 204, de 22 de janeiro de 2015, publicada no Diário Oficial da União n.º 17, de 26 de janeiro de 2015, seção 1, página 38 e em suplemento da Seção 1, página 95, por solicitação da empresa Wyeth Indústria Farmacêutica Ltda, CNPJ n.º 61.072.393/0001-33, expediente nº 0467757/15-9. Art. 2º Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando a necessidade de alteração no Certificado de Boas Práticas de Fabricação, resolve: Art. 1º Alterar a razão social da empresa fabricante Agila Specialties Private Limited (Specialty Formulation Facility) para Mylan Laboratories Limited (Specialty Formulation Facility) na Resolução RE nº 1.388, de 07 de maio de 2015, publicada no Diário Oficial da União n.º 87, de 11 de maio de 2015, seção 1, página 48 e em suplemento da Seção 1, página 205, por solicitação da empresa Agila Especialidades Farmacêuticas Ltda., CNPJ n.º 11.643.096/000122, expediente nº 0453875/15-7. Art. 2º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO RESOLUÇÃO - RE Nº 1.963, DE 10 DE JULHO DE 2015(*) RESOLUÇÃO - RE Nº 1.967, DE 10 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o cumprimento dos requisitos de Boas Práticas de Distribuição e/ou Armazenagem preconizados em legislação vigente, para a área de Medicamentos, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo, a Certificação de Boas Práticas de Distribuição e/ou Armazenagem de Medicamentos. Art. 2º A presente Certificação terá validade de 2 (dois) anos a partir da sua publicação. Art. 3° Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o cumprimento dos requisitos dispostos no art. 43, da Resolução RDC nº 39, de 14 de agosto de 2013, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo, a Certificação de Boas Práticas por meio de sua renovação automática. Art. 2º A presente Certificação tem validade de 2 (dois) anos a partir da sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO Dispõe sobre aprovação do Plano Diretor de Tecnologia da Informação 2015 da Funasa. O PRESIDENTE DA FUNDAÇÃO NACIONAL DE SAÚDE, no uso das atribuições que lhe confere o art. 103, Inciso XII, do Regimento Interno da FUNASA, aprovado pela Portaria nº 270 de 27/02/2014, publicado no D.O.U. de 5.3.2014 e considerando a orientação da Instrução Normativa nº 4, de 14 de setembro de 2014, da Secretaria de Logística e Tecnologia da Informação - SLTI do Ministério de Planejamento, Orçamento e Gestão - MPOG; e Considerando a Resolução nº 01, de 29 de junho de 2015, do Comitê Gestor de Tecnologia da Informação - CGTI da Fundação Nacional de Saúde, resolve: Art. 1º - Aprovar o Plano Diretor de Tecnologia da Informação - PDTI 2015 da Fundação Nacional de Saúde - Funasa, o qual abrange a Presidência e as Superintendências Estaduais da Fundação Nacional de Saúde. Art. 2º - Esta Portaria entra em vigor na data de sua publicação. ANTONIO HENRIQUE DE CARVALHO PIRES SECRETARIA DE ATENÇÃO À SAÚDE PORTARIA Nº 600, DE 10 DE JULHO DE 2015 Indefere o pedido de Concessão do Certificado de Entidade Beneficente de Assistência Social, na área de Saúde, à Fundação Pedro Américo, com sede em Campina Grande (PB). A Secretária de Atenção à Saúde, no uso de suas atribuições, Considerando a Lei n° 12.101, de 27 de novembro de 2009 e suas alterações, que dispõe sobre a certificação das entidades beneficentes de assistência social; Considerando o Decreto nº 8.242, de 23 de maio de 2014, que regulamenta a Lei nº 12.101, de 27 de novembro de 2009; Considerando a competência prevista no art. 2º da Portaria nº 1.970/GM/MS, de 16 de agosto de 2011; Considerando as Normas Brasileiras de Contabilidade do Conselho Federal de Contabilidade; e Considerando o Parecer Técnico nº 247/2015-CGCER/DCEBAS/SAS/MS, constante do Processo nº 25000.228389/2011-48/MS, que concluiu não terem sido atendidos os requisitos constantes da NBCT 10.19.2.5, NBCT 6.2.2.2; alínea "b" do inciso III, alíneas "a", "b" e "c" do inciso V do art. 9º, alíneas "b" e "d" do inciso II, alíneas "c" e "d" do inciso III do art. 30, todos da Portaria nº 1.970/2011/GM/MS e demais legislações pertinentes, resolve: Art. 1º Fica indeferido o pedido de Concessão do Certificado de Entidade Beneficente de Assistência Social, na área de Saúde, da Fundação Pedro Américo, CNPJ nº 06.101.061/0001-21, com sede em Campina Grande (PB). Art. 2º A instituição requerente fica notificada para, caso queira, apresentar recurso administrativo no prazo de 30 (trinta) dias a contar da data da presente publicação, conforme prevê o art. 26 da Lei nº 12.101/2009. Art. 3º Esta Portaria entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO LUMENA ALMEIDA CASTRO FURTADO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. DEPARTAMENTO DE GESTÃO HOSPITALAR/ RJ RESOLUÇÃO - RE Nº 1.964, DE 10 DE JULHO DE 2015(*) RESOLUÇÃO - RE N° 1.992, DE 10 DE JULHO DE 2015(*) PORTARIA CONJUNTA N o- 5, DE 6 DE JULHO DE 2015 O Diretor da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o cumprimento dos requisitos de Boas Práticas de Fabricação preconizados em legislação vigente, para a área de Medicamentos, resolve: Art. 1º Conceder à(s) Empresa(s) constante(s) no ANEXO, a Certificação de Boas Práticas de Fabricação de Medicamentos. Art. 2º A presente Certificação terá validade de 2 (dois) anos a partir da sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; considerando o cumprimento dos requisitos dispostos no art. 43, da Resolução RDC nº 39, de 14 de agosto de 2013, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo a Certificação de Boas Práticas de Distribuição e/ou Armazenagem de Produtos para Saúde por meio de sua renovação automática. Art. 2º A presente certificação terá validade de 2 (dois) anos a partir de sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. Este documento pode ser verificado no endereço eletrônico http://www.in.gov.br/autenticidade.html, pelo código 00012015071300070 Aprovação de Procedimento Operacional Padrão que Disciplina a Aquisição, o Recebimento, a Utilização e o Controle de Órtese, Prótese e Materiais Especiais (OPME) O Diretor do Departamento de Gestão Hospitalar (DGH), o Diretor do INC, o Diretor do INCA e o Diretor do INTO, resolvem: Considerando o Art. 13 da Portaria nº 403, de 07 de maio de 2015, que disciplina a aquisição, o recebimento, a utilização e o controle de Órtese, Prótese e Materiais Especiais (OPME) pelas Unidades Hospitalares subordinadas à Secretaria de Atenção à Saúde do Ministério da Saúde (SAS/MS): Art. 1º - Aprovar o Procedimento Operacional Padrão, que disciplina a aquisição, o recebimento, a utilização e o controle de OPME no âmbito das Unidades Hospitalares subordinadas à SAS/MS, nos termos do documento em anexo. Art. 2º - Esta Portaria entra em vigor na data de sua publicação. Documento assinado digitalmente conforme MP n o- 2.200-2 de 24/08/2001, que institui a Infraestrutura de Chaves Públicas Brasileira - ICP-Brasil.
Download