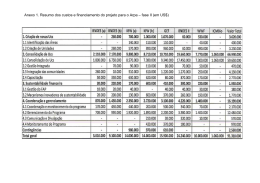
56 ISSN 1677-7042 considerando a confirmação pela empresa Chron do Brasil Ltda. de comercialização do cosmético LOÇÃO HIDRATANTE PROTEÍNAS DO LEITE marca NUTRYDERM com rotulagem diferente da informada na notificação na Anvisa em relação a composição do produto, resolve; Art. 1º Determinar, como medida de interesse sanitário, a suspensão da distribuição, comércio e uso, em todo o território nacional, de lotes fabricados entre 23/06/2013 e 29/12/2014, do cosmético LOÇÃO HIDRATANTE - PROTEÍNAS DO LEITE marca NUTRYDERM, fabricado por Chron Do Brasil Cosméticos Ltda. (CNPJ: 07284537/0001-70). Art. 2º Determinar que a empresa promova o recolhimento do estoque existente no mercado, relativo ao produto descrito no art. 1º. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO 1 RESOLUÇÃO - RE N o- 1.905, DE 3 DE JULHO DE 2015 (*) RESOLUÇÃO - RE N o- 1.909, DE 3 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o cumprimento dos requisitos de Boas Práticas de Fabricação preconizados em legislação vigente, para a área de Medicamentos, resolve: Art. 1º Conceder à(s) Empresa(s) constante(s) no ANEXO, a Certificação de Boas Práticas de Fabricação de Medicamentos. Art. 2º A presente Certificação terá validade de 2 (dois) anos a partir da sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; considerando o cumprimento dos requisitos de Boas Práticas de Distribuição e/ou Armazenagem preconizados em legislação vigente, para a área de produtos para a saúde, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo a Certificação de Boas Práticas de Distribuição e/ou Armazenagem de Produtos para Saúde. Art. 2º A presente certificação terá validade de 2 (dois) anos a partir de sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO RESOLUÇÃO-RE N o- 1.902, DE 3 DE JULHO DE 2015 O Diretor da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o Decreto de nomeação de 09 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, publicada no DOU de 28 de abril de 2015, tendo em vista o disposto nos incisos IV e IX do art. 165, aliado ao inciso I e § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do Anexo I da Portaria nº 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014, considerando o art. 7º da Lei nº 6.360, de 23 de setembro de 1976; considerando o comunicado de recolhimento voluntário, encaminhado pela empresa Multilab Indústria Farmacêutica Ltda., em razão da embalagem primária (blister) do medicamento MENOCOL 40 mg (sinvastatina) estar identificada como sendo de concentração de 80 mg para o lote 306817, resolve: Art. 1º Determinar, como medida de interesse sanitário, a suspensão, em todo o território nacional, da distribuição, comercialização e uso do lote 306817 (Val.: 04/2017) do medicamento MENOCOL 40mg (sinvastatina) comprimidos revestidos, fabricado por Multilab Indústria e Comércio de Produtos Farmacêuticos Ltda. (CNPJ: 92265552/0001-40). Art. 2º Determinar que a empresa promova o recolhimento do estoque existente no mercado, relativo ao produto descrito no art. 1º, na forma da Resolução-RDC nº 55/2005. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO RESOLUÇÃO - RE N o- 1.903, DE 3 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014, resolve; Art. 1º Cancelar o Certificado de Boas Práticas de Fabricação concedido por meio da Resolução - RE N o- 2.187, de 10 de junho de 2014, publicada no Diário Oficial da União N o- 110, de 11 de Junho de 2014, seção I, página 54, da empresa Orion Corporation, Orion Pharma Espoo, processo 25351.705679/2013-00, em atendimento ao previsto no § 2º do art. 7º da RDC 39/2013. Art. 2º Esta Resolução entra em vigor na data de sua publicação JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando a necessidade de inclusão no Certificado de Boas Práticas de Fabricação, resolve: Art. 1º Incluir a forma farmacêutica, comprimidos revestidos, na certificação da empresa Lilly S.A. concedida pela Resolução RE nº 2.884, de 01 de agosto de 2014, publicada no Diário Oficial da União n.º 147, de 04 de agosto de 2014, seção 1, página 76 e em suplemento da Seção 1, página 129, por solicitação da empresa Biolab Sanus Farmacêutica Ltda., CNPJ n.º 49.475.833/0001-06, expediente nº 0476263/15-1. Art. 2º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE N o- 1.906, DE 3 DE JULHO DE 2015(*) RESOLUÇÃO - RE N o- 1.910, DE 3 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o descumprimento dos requisitos de Boas Práticas de Fabricação de Medicamentos, ou o descumprimento dos procedimentos de petições submetidas à análise, preconizados em legislação vigente, resolve: Art. 1º Indeferir o(s) Pedido(s) de Certificação de Boas Práticas de Fabricação de Medicamentos da(s) empresa(s) constante(s) no anexo. Art. 2º Esta Resolução entra em vigor na data de sua publicação. O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; considerando o cumprimento dos requisitos de Boas Práticas de Fabricação preconizados em legislação vigente, para a área de produtos para a saúde, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo a Certificação de Boas Práticas de Fabricação de Produtos para Saúde. Art. 2º A presente certificação terá validade de 2 (dois) anos a partir de sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. o- RESOLUÇÃO - RE N 1.907, DE 3 DE JULHO DE 2015 O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando a necessidade de inclusão no Certificado de Boas Práticas de Fabricação, resolve: Art. 1º Incluir os insumos farmacêuticos ativos biológicos: polissacarídeos pneumocócicos 4, 9V, 14, 19A e 23F, na certificação da empresa Pfizer Ireland Pharmaceuticals, concedida pela Resolução RE nº. 1.945, de 22 de maio de 2014, publicada no Diário Oficial da União n.º 98, de 26 de maio de 2014, seção 1, página 92 e em suplemento da Seção 1, páginas 69 e 70, por solicitação da empresa Wyeth Indústria Farmacêutica Ltda., CNPJ n.º 61.072.393/0001-33, expediente nº 0477961/15-4. Art. 2º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE N o- 1.904, DE 3 DE JULHO DE 2015 Nº 126, segunda-feira, 6 de julho de 2015 RESOLUÇÃO - RE N o- 1.908, DE 3 DE JULHO DE 2015 O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando a necessidade de alteração no Certificado de Boas Práticas de Fabricação, resolve: Art. 1º Alterar a razão social da empresa fabricante Pfizer Manufacturing Deutschland GmbH para R-Pharm Germany GmbH na Resolução RE nº 3.586, de 12 de setembro de 2014, publicada no Diário Oficial da União n.º 177, de 15 de setembro de 2014, seção 1, página 90 e em suplemento da Seção 1, páginas 198 a 200, por solicitação da empresa Wyeth Indústria Farmacêutica Ltda, CNPJ n.º 61.072.393/0001-33, expediente nº 0251032/15-4. Art. 2º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO Este documento pode ser verificado no endereço eletrônico http://www.in.gov.br/autenticidade.html, pelo código 00012015070600056 JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE N o- 1.911, DE 3 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; Considerando o descumprimento dos requisitos de Boas Práticas Fabricação, ou o descumprimento dos procedimentos de petições submetidas à análise, preconizados em legislação vigente, resolve: Art. 1º Indeferir o Pedido de Certificação de Boas Práticas de Fabricação de Produtos para Saúde da(s) empresa(s) constante(s) no anexo. Art. 2º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. RESOLUÇÃO - RE N o- 1.912, DE 3 DE JULHO DE 2015(*) O Diretor da Agência Nacional de Vigilância Sanitária no uso das atribuições que lhe conferem o Decreto de nomeação de 9 de maio de 2014, da Presidenta da República, publicado no DOU de 12 de maio de 2014, e a Portaria nº 504, de 27 de abril de 2015, tendo em vista o disposto no inciso I, § 1º do art. 6º do Regimento Interno da ANVISA, aprovado nos termos do anexo I da Portaria n.º 650, de 29 de maio de 2014, publicada no DOU de 02 de junho de 2014; considerando o cumprimento dos requisitos dispostos no art. 43, da Resolução RDC nº 39, de 14 de agosto de 2013, resolve: Art. 1º Conceder à(s) empresa(s) constante(s) no anexo a Certificação de Boas Práticas de Fabricação de Produtos para Saúde por meio de sua renovação automática. Art. 2º A presente certificação terá validade de 2 (dois) anos a partir de sua publicação. Art. 3º Esta Resolução entra em vigor na data de sua publicação. JOSÉ CARLOS MAGALHÃES DA SILVA MOUTINHO (*) Esta Resolução e o anexo a que se refere serão publicados em suplemento à presente edição. Documento assinado digitalmente conforme MP n o- 2.200-2 de 24/08/2001, que institui a Infraestrutura de Chaves Públicas Brasileira - ICP-Brasil.
Download