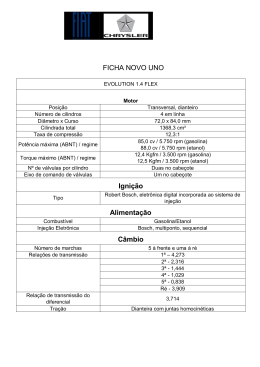
Atividade Prática de Laboratório Determinação do teor de álcool na gasolina comercial Materiais - Gasolina Comum - Mistura de água e álcool - Duas provetas, sendo uma com rolha ou filme de PVC Procedimento Experimental Nas provetas, coloque separadamente volumes iguais de gasolina e da mistura (água + álcool). A seguir , despeje o conteúdo de uma das provetas na outra e agite. Deixe o sistema em repouso. Observe. Lembre-se 1. Petróleo e seus derivados (gasolina, querosene, óleo diesel) são compostos apolares; a água é polar. 2. A gasolina no Brasil pode conter até 25% em volume de etanol. O etanol é uma substância polar que apresenta uma parte polar e outra apolar. H3C CH2 Apolar OH Polar A interação entre as moléculas e a parte polar do etanol é muito intensa: ligações de hidrogênio: pólo negativo O H3C CH2 O H H H pólo postivo Estas ligações de hidrogênio são forças mais intensas do que as que existem entre a parte apolar do etanol e as moléculas de gasolina, por isso o etanol se dissolve de preferência na água. Com base no experimento realizado e nas informações fornecidas acima, responda: 1. O sistema final é homogêneo ou heterogêneo? 2. De que é constituída a fase mais densa? E a menos densa? 3. Leia o volume final de gasolina (Vf) e compare com seu volume inicial (Vi), determinando a procentagem de etanol. Vi Vf 100% x% x% - porcentagem da gasolina Portanto a porcentagem de etanol + água na amostra é dado por (100- x)% 4. A gasolina analisada está adulterada?
Baixar