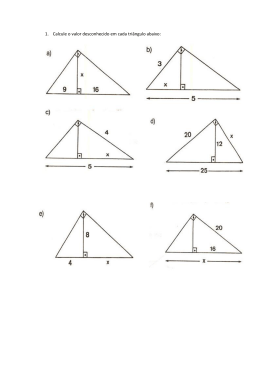
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
PRIMEIRA LEI DA TERMODINÂMICA
TRABALHO
REALIZADO
DURANTE
VARIAÇÕES DE VOLUME
CAMINHOS
ENTRE
ESTADOS
TERMODINÂMICOS
1. Dois moles de um gás ideal são aquecidos à
pressão constante de 2 atm, de 300 K até 380 K.
(a) Desenhe um diagrama pV para este processo;
(b) Calcule o trabalho realizado pelo gás.
1
2. Três moles de um gás ideal possuem uma
temperatura inicial igual a 127.00C. Enquanto a
temperatura é mantida constante, o volume aumenta até
que a pressão caia até um valor igual a 40% do seu valor
inicial,
(a) Desenhe um diagrama pV este processo,
(b) Calcule o trabalho realizado pelo gás.
3. Um cilindro metálico com paredes rígidas
contém 2,50 mol do gás oxigênio. O gás é resfriado de
300K a 200K até que sua pressão decresça de 30% do seu
valor original 3 atm. Despreze a contração térmica do
cilindro,
(a) Desenhe um diagrama pV para este processo.
(b) Calcule o trabalho realizado pelo gás.
4. Um gás sob pressão constante de 1,50.105 Pa e
com volume inicial igual a 0,0900 m é resfriado até que
seu volume fique igual a 0,0600 m.
(a) Desenhe um diagrama p V para este processo,
(b) Calcule o trabalho realizado pelo gás.
5. Um gás realiza dois processos. No primeiro, o
volume permanece constante a 0,200 m e a pressão cresce
de 2,00.105 Pa até 5,00.105 Pa. O segundo processo é uma
compressão até o volume 0,120 m3 sob pressão constante
de 5,00.105 Pa.
(a) Desenhe um diagrama pV mostrando estes
dois processos.
(b) Calcule o trabalho total realizado pelo gás
nos dois processos.
6. Trabalho realizado em um processo cíclico,
(a) Na Figura, considere a malha l
3 2 4
l. Este processo é cíclico porque o estado final coincide
com o estado inicial. Calcule o trabalho total realizado
pelo sistema neste processo cíclico e mostre que ele é
igual à área no interior da curva fechada.
(b) Como se relaciona o trabalho realizado no
item (a) com o trabalho realizado quando o ciclo for
percorrido em sentido inverso, l
4
2
3
l?
Explique.
ENERGIA
INTERNA
E
PRIMEIRA LEI DA TERMODINÂMICA
7. Em um certo processo químico, um técnico de
laboratório fornece 254 J de calor a um sistema.
Simultaneamente, 73 J de trabalho são realizados pelas
vizinhanças sobre o sistema. Qual é o aumento da energia
interna do sistema?
8. Um gás no interior de um cilindro se expande de
um volume igual a 0,110 m até um volume igual a 0,320
m3. O calor flui para dentro do sistema com uma taxa
suficiente para manter a pressão constante e igual a l
,80.105 Pa durante a expansão. O calor total fornecido ao
sistema é igual a l,15.105 J.
(a) Calcule o trabalho realizado pelo gás.
(b) Ache a variação da energia interna do gás.
(c) O resultado depende ou não do gás ser ideal?
Justifique sua resposta.
9. Um gás no interior de um cilindro é mantido sob
pressão constante igual a 2,30.105 Pa sendo resfriado e
comprimido de l ,70 m até um volume de l ,20 m . A
energia interna do gás diminui de l ,40.105 J.
(a) Calcule o trabalho realizado pelo gás.
(b) Ache o valor absoluto do calor |Q| trocado com
as vizinhanças e determine o sentido do fluxo do calor,
(c) O resultado depende ou não de o gás ser ideal?
Justifique sua resposta.
10. Um sistema evolui do estado a até o estado b ao
longo dos três caminhos indicados na Figura.
(a) Ao longo de qual caminho o trabalho realizado é
maior? Em qual caminho é menor?
(b) Sabendo que Ub > Ua, ao longo de qual caminho
o valor absoluto do calor |Q| trocado com as vizinhanças é
maior? Para este caminho, o calor é libertado ou
absorvido pelo sistema?
11. Sonhos: desjejum dos campeões! Um sonho
típico contém 2.0 g de proteína, 17,0 g de carboidratos e
7,0 g de gordura. Os valores médios de energia
alimentícia destas substâncias são 4,0 kcal/g para a
proteína e os carboidratos e 9,0 kcal/g para a gordura,
(a) Durante um exercício pesado, uma pessoa média
gasta energia com uma taxa de 510 kcal/h. Durante quanto
tempo você faria exercício com o "trabalho obtido" por
um sonho?
(b) Caso a energia contida em um sonho pudesse de
algum modo ser convertida em energia cinética do seu
corpo como um todo, qual seria sua velocidade máxima
depois de comer um sonho? Considere sua massa igual a
60 kg e expresse a resposta em m/s e km/h.
12. Um líquido é agitado irregularmente em um
recipiente bem isolado e, portanto, sua temperatura
aumenta. Considere o líquido como o sistema,
(a) Ocorre transferência de calor? Como você pode
garantir?
(b) Existe trabalho realizado? Como você pode
garantir? Por que é importante que a agitação seja
1
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
irregular?
(c) Qual é o sinal de Aí/? Como você pode garantir?
2
13. Um sistema realiza o ciclo indicado na Figura do
estado a até o estado b e depois de volta para o estado a.
O valor absoluto do calor transferido durante um ciclo é
igual a 7200 J.
(a) O sistema absorve ou liberta calor quando ele
percorre o ciclo no sentido indicado na Figura? Como
você pode garantir?
(b) Calcule o trabalho W realizado pelo sistema em
um ciclo.
(c) Caso o sistema percorra o ciclo no sentido antihorário, ele absorve ou liberta calor quando percorre o
ciclo? Qual é o valor absoluto do calor absorvido ou
libertado durante um ciclo percorrido no sentido antihorário?
14. Um sistema termodinâmico realiza o processo
cíclico indicado na Figura. O ciclo é constituído por duas
curvas fechadas, a malha I e a malha II.
(a) Durante um ciclo completo,o na realiza trabalho
positivo ou negativo?
(b) O sistema realiza lho positivo ou negativo para
cada malha separada I e II?
(c) Durante um ciclo completo, o sistema absorve ou
liberta calor?
(d) Para cada malha I e II, o sistema absorve ou
liberta calor?
15. Um estudante realiza uma experiência de
combustão pieimando uma mistura de combustível e
oxigênio em um recipiente metálico com volume
constante envolvido em um banho com água. Durante a
experiência, verifica que a temperatura da água aumenta.
Considere a mistura de combustível oxigênio como o
sistema,
(a) Ocorre transferência de calor? Como você pode
garantir?
(b) Existe trabalho realizado? Como você pode
garantir? Por que é importante que a agitação seja
regular?
(c) Qual é o sinal de U? Como você pode garantir?
16. Ebulição da água sob pressão elevada. Quando
a água atra em ebulição sob pressão de 2,00 atm, o calor
de vaporização igual a 2,20.106 J/kg e o ponto de ebulição
é igual a 120°C. Para esta pressão, l ,00 kg de água possui
volume igual a 1,00.10-3 m3, e l,00 kg de vapor d'água
possui volume igual a 0,824 m3,
(a) Calcule o trabalho realizado quando se forma l
,00 kg: vapor d'água nesta temperatura,
(b) Calcule a variação da energia interna da água.
TIPOS
DE
PROCESSOS
TERMODINÂMICOS; ENERGIA INTERNA DE
UM GÁS IDEAL; CALOR ESPECÍFICO DE UM
GÁS IDEAL
17. Em uma experiência para simular as condições
no interior um motor de automóvel, 645 J de calor são
transferidos para 0,185 mol de ar contido no interior de
um cilindro com volume igual a 40,0 cm3. Inicialmente o
nitrogênio está a uma pressão uai a 3,00.106 Pa e à
temperatura de 780 K.
(a) Se o volume do indro é mantido constante, qual é
a temperatura final do ar? Suponha que o ar seja
constituído essencialmente de nitrogênio e e os dados da
Tabela. Faça um desenho do diagrama pV para este
processo,
(b) Ache a temperatura final do ar supondo que o
volume do cilindro possa aumentar enquanto a pressão
permanece constante. Faça um desenho do diagrama pV
para este processo.
18. Um cilindro contém 0,0100 mol de hélio a uma
Temperatura T= 300 K.
(a) Qual é o calor necessário para aumentar
emperatura para 340 K enquanto o volume permanece
nstante? Faça um desenho do diagrama PV para este
processo. Se em vez de manter o volume constante, a
pressão do hélio, se mantida constante, qual seria o calor
necessário para mentar a temperatura de 300 K para 340
K? Faça um desenho diagrama PV para este processo,
(c) Qual é o fator responsável pela diferença obtida
nos itens (a) e (b)? Em qual dos dois casos o calor
necessário é maior? O que ocorre com o calor adicional?
(d) Caso o sistema fosse um gás ideal, qual seria a
variação da energia interna da parte (a)? E da parte (b)?
Como você compara as duas respostas? Por quê?
19. A temperatura de 0,150 mol de um gás ideal é
mantida constante em 77,00C enquanto seu volume é
reduzido para 25% do volume inicial. A pressão inicial do
gás é igual a l,25 atm.
(a) Calcule o trabalho realizado pelo gás.
(b) Qual é a variação da sua energia interna?
(c) O gás troca calor com suas vizinhanças? Se
troca, qual é o valor absoluto deste calor? O gás absorve
ou libera calor?
2
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
20. Durante a compressão isotérmica de um gás
ideal, é necessário remover do gás 335 J de calor para
manter sua temperatura constante. Qual é o trabalho
realizado pelo gás neste processo?
21. O gás propano (C3,H8) pode ser considerado um
gás ideal com = l,127. Determine o calor específico
molar a volume constante e o calor específico molar à
pressão constante.
3
22. Um cilindro contém 0,250 mól do gás dióxido
de carbono (CO2) à temperatura de 27,00C. O cilindro
possui um pistão sem atrito, que mantém sobre o gás uma
pressão constante igual a l ,00 atm. O gás é aquecido e sua
temperatura aumenta para 127,00C. Suponha que o CO2,
possa ser considerado um gás ideal.
(a) Desenhe um diagrama pV para este processo,
(b) Qual é o trabalho realizado pelo gás neste
processo?
(c) Sobre o que este trabalho é realizado?
(d) Qual é a variação da energia interna do gás?
(e) Qual é o calor fornecido ao gás? O Qual seria o
trabalho realizado se a pressão fosse igual a 0.50 atm?
23. O gás etano (C2H6) pode ser considerado um gás
ideal com = l,220.
(a) Qual é o calor necessário para aquecer 2,40 mol
de etano de 20,0°C até 25,00C à pressão constante de l,00
atm?
(b) Qual deverá ser a variação da energia interna do
etano?
27. Durante uma expansão adiabática a temperatura
de 0,450 mol de argônio (Ar) cai de 50,0°C para 10,0°C.
O argônio pode ser tratado como um gás ideal,
(a) Desenhe um diagrama pV para este processo,
(b) Calcule o trabalho realizado pelo gás.
(c) O gás troca calor com suas vizinhanças? Se a
resposta for positiva, qual é o valor absoluto e o sentido
desta troca de calor?
(d) Qual é a variação da sua energia interna?
28. Um cilindro contém 0,100 mol de um gás
ideal monoatômico. No estado inicial o gás está sob
pressão de l,00 x 105 Pa e ocupa um volume igual a
2,50.10-3 m3 .
(a) Ache a temperatura inicial do gás em kelvins.
(b) Se o gás se expande até o dobro do seu volume
inicial, ache a temperatura final do gás (em kelvins) e a
pressão do gás sabendo que a expansão é:
(i) isotérmica;
(ii) isobárica;
(iii) adiabática.
29. Uma quantidade do gás dióxido de enxofre (SO2)
ocupa um volume igual a 5,00.10-3 m à pressão de 1,10.
105 Pa.
O gás sofre uma expansão adiabática até um
volume igual a l,00.10-2 m3 , realizando um trabalho de
285 J sobre suas vizinhanças. Este gás pode ser tratado
como um gás ideal,
(a) Ache a pressão final do gás.
(b) Qual é o trabalho realizado pelo gás sobre suas
vizinhanças?
(c) Qual é a razão entre a temperatura final e a
temperatura inicial do gás?
PROCESSO ADIABÁTICO DE UM GÁS
IDEAL
24. Um gás ideal monoatômico possui uma pressão
inicial igual a l,50.105 Pa e, partindo de um volume de
0,0800 m3 , ele sofre uma compressão adiabática até um
volume igual a 0,0400 m3.
(a) Qual é a pressão final?
(b) Qual é o trabalho realizado pelo gás neste
processo?
(c) Qual é a razão entre a temperatura final e a
temperatura inicial do gás? O gás é aquecido ou resfriado
neste processo de compressão?
25. O motor do carro esportivo Ferrari F355 F1
injeta o ar a 20,0°C e l,00 atm e o comprime
adiabaticamente até atingir 0,0900 do seu volume inicial.
O ar pode ser considerado um gás ideal com = l,40.
(a) Desenhe um diagrama/impara este processo,
(b) Calcule a temperatura e a pressão no estado final.
26. Um gás ideal inicialmente a 4,00 atm e 350 K
sofre uma expansão adiabática até 1,50 vez seu volume
inicial. Calcule a temperatura e a pressão no estado final
sabendo que o gás é
(a) monoatômico;
(b) diatômico com Cv = 5R/2.
3
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
PROBLEMAS
30. Uma quantidade de ar vai do estado a até o
estado b ao longo de uma linha reta no diagrama pV.
(a) Neste processo a temperatura do gás aumenta,
diminui ou permanece constante?Explique,
(b) Se Va = 0,0700 m3 Vb = 0,1100 m3 pa = 1,00.105
Pa e pb = 1,40.105 Pa, qual é o trabalho W realizado pelo
gás neste processo? Suponha que o gás possa ser tratado
como um gás ideal.
processos ab, bc, cd e dc. Em cada um destes processos,
verifique se o sistema absorve ou liberta calor.
4
31. Quando um sistema vai do estado a até o estado
b ao longo do caminho acb, um calor igual a 90,0 J flui
para o interior do sistema e um trabalho de 60,0 J é
realizado pelo sistema,
(a) Qual é o calor que flui para o interior do sistema
ao longo do caminho adb, sabendo que o trabalho
realizado pelo sistema é igual a 15,0 J?
(b) Quando o sistema retorna de b para a ao longo
do caminho encurvado, o valor absoluto do trabalho
realizado pelo sistema é igual a 35,0 J. O sistema absorve
ou liberta calor? Qual é o valor deste calor?
(c) Sabendo que Ua = 0 e Ub = 8,0 J, calcule os
calores absorvidos nos processos ad e db.
33. A Figura mostra quatro estados de um
sistema termodinâmico, a, b, c e d. O volume do sistema é
Va para os estados a e b e é igual a Vc, para os estados c e
d. A pressão do sistema é pa para os estados a e d e é igual
a pc para os estados b e c. As energias internas de cada um
dos quatro estados são Ua, Ub, Uc e Ud. Para cada um dos
quatro processos ab, bc, cd e da, calcule:
(a) o trabalho realizado pelo sistema durante o
processo e
(b) o calor que flui para o interior do sistema
durante o processo.
(c) O sistema pode evoluir do estado a até o
estado c ao longo do caminho abc ou ao longo do
caminho adc. Ache o calor total trocado com as
vizinhanças e o trabalho total realizado pelo sistema para
cada caminho. Para qual caminho o calor é maior? Para
qual caminho o trabalho realizado é maior?
(d) Um amigo disse para você que o calor ao
longo do caminho abe deve ser igual ao calor ao longo do
caminho adc, visto que o estado inicial (a) e o estado final
(c) do sistema são os mesmos nos dois caminhos. O que
você responderia para ele?
17.34 O gás nitrogénio no interior de um recipiente que
pode se expandir é resfriado de 50,0°C até 10,0°C,
mantendo-se a pressão constante e igual a 3,00 x IO Pa. O
calor total libertado pelo gás é igual a 2,50 x IO 4 J.
Suponha que o gás possa ser tratado como <im gás ideal,
a) Calcule o número de moles do gás. b) Calcule a
i
variação da energia interna do gás. c) Ache o trabalho
realizado j pelo gás. d) Qual seria o calor libertado pelo
gás para a mesma variação da temperatura caso o volume
permanecesse constante?
32. Um sistema termodinâmico vai do estado a
até o estado c indicado na Figura ao longo do caminho
abe ou ao longo do caminho adc. Ao longo do caminho
abe o trabalho W realizado pelo sistema é igual a 450 J.
Ao longo do caminho adc, W é igual a 120 J. As energias
internas de cada um dos quatro estados indicados na
figura são Ua = 150 J, Ub = 240 J, Uc = 680 J e Ud = 330
J. Determine o calor trocado em cada um dos quatro
35. Em um certo processo, o calor libertado pelo
sistema é igual a 2,15.105 J e, ao mesmo tempo, o sistema
se contrai sob a ação de uma pressão externa constante
igual a 9,50.105 Pa. A energia interna é a mesma no
estado inicial e no estado final. Ache a variação de
volume do sistema. (O sistema não é um gás ideal.)
36. Um cilindro com um pistão móvel sem atrito, como o
indicado na Figura 17.5, contém uma quantidade do gás
hélio. Inicialmente o gás está a uma pressão igual a
l,00.105 Pa, possua uma temperatura de 300 K e ocupa um
volume igual a l,50 L. A seguir o gás realiza dois
4
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
2
processos. No primeiro, o gás é aquecido e o pistão se
move para manter a temperatura constante igual a 300 K.
Este processo continua até que a pressão atinja o valor
2,50.104 Pa. No segundo processo, o gás é comprimido a
pressão constante até que ele retome ao seu volume inicial
de 1,50 L. Suponha que o gás possa ser tratado como um
gás ideal.
(a) Em um diagrama PV, mostre os dois
processos,
(b) Ache o volume do gás no final do primeiro
processo; calcule a temperatura e a pressão no final do
segundo processo,
(c) Calcule o trabalho total realizado pelo gás nos
dois processos,
(d) O que você faria para o gás voltar a possuir a
pressão e a temperatura originais?
37. Um Processo termodinâmico em um
líquido. Uma engenheira química está examinando as
propriedades do metanol (CH 3,OH) no estado líquido. Ela
usa um cilindro de aço com área da seção reta igual a
0,0200 m2 e contendo l,20.10-2 m3 de metanol. O cilindro
possui um pistão bem ajustado que suporta uma carga
igual a 3,00.104 N. A temperatura do sistema aumenta de
20,0°C para 50,0°C. Para o metanol, o coeficiente de
dilatação volumétrica é igual a l,20.10-3 K-1, a densidade é
igual a 791 kg/m3 e o calor específico à pressão constante
é dado por Cp = 2,51.103J/(kgK). Despreze a dilatação
volumétrica do cilindro de aço. Calcule:
(a) o aumento de volume do metanol;
(b) o trabalho mecânico realizado pelo metanol
contra a força de 3,00.104 N;
(c) o calor fornecido ao metanol;
(d) a variação da energia interna do metanol;
(e) Com base em seus resultados, verifique se
existe alguma diferença substancia] entre o calor
específico c (à pressão constante) e o calor específico Cp
(a volume constante) do metanol nestas circunstâncias.
38. Um processo termodinâmico em um
sólido. Um cubo de cobre com aresta igual a 2,00 cm é
suspenso por um fio. O cubo é aquecido com um bico de
gás de 20,0°C até 90,0°C. O ar nas vizinhanças do cubo
está na pressão atmosférica (1,01.105 Pa). Calcule:
(a) o aumento de volume do cubo;
(b) o trabalho mecânico realizado pelo cubo
contra a pressão do ar circundante;
(c) o calor fornecido ao cubo;
(d) a variação da energia interna do cubo.
(e) Com base em seus resultados, verifique se
existe alguma diferença substancial entre o calor
específico cP, (à pressão constante) e o calor específico cV,
(a volume constante) do cobre nestas circunstâncias.
39. Um processo termodinâmico em um inseto. Para
sua defesa, o escaravelho africano Stenaptinus insignis
pode emitir um jato espalhado através de uma
extremidade móvel do seu abdómen. O corpo do
escaravelho possui reservatórios com duas substâncias
diferentes; quando ele é perturbado, estas substâncias são
combinadas em uma câmara de reação, produzindo um
composto que é aquecido de 20,0°C até 100,0°C pelo
calor da reação. A pressão elevada produzida permite que
o composto seja espalhado para fora com velocidades da
ordem de 19 m/s (68 km/h), varrendo para fora os seus
predadores.
(O escaravelho mostrado nesta figura está preso a um fio
colado com cera em suas costas. Ele está reagindo ao
estímulo do aperto produzido por um fórceps em sua
perna dianteira. O comprimento do escaravelho é igual a 2
cm.) Calcule o calor da reação das substâncias (em J/kg).
Suponha que os calores específicos das substâncias e do
líquido borrifado sejam iguais ao calor específico da água,
4,19.103 (J/kg.K), e que a temperatura inicial das
substâncias seja igual a 20,0°C.
40. Motor com ar comprimido. Você está
projetando um motor que usa ar comprimido. O ar entra
no motor com uma pressão igual a l,60.106 Pa e sai com
uma pressão igual a 2,80.105 Pa. Qual deve ser a
temperatura do ar comprimido para que não haja
possibilidade da formação de gelo nos tubos de exaustão
do motor? Suponha que a expansão seja adiabática.
{Nota: O gelo se forma quando o ar úmido é resfriado
abaixo de 0°C na expansão.)
41. Durante certas estações, ventos fortes
chamados de "chinooks" sopram provenientes do oeste e
atingem o leste das Montanhas Rochosas descendo as
inclinações até Denver e áreas adjacentes. Embora as
montanhas sejam frias, o vento em Denver é muito
quente; depois de alguns minutos da chegada dos ventos
chinooks. a temperatura pode aumentar de até 20°C (a
palavra "chinook" deriva de uma homónima tribo de
índios americanos e significa "comedor de neve"). Ventos
semelhantes ocorrem nos Alpes (chamados de "foehns") e
no sul da Califórnia (chamados de "Santa Anãs"),
(a) Explique por que a temperatura do vento
chinook aumenta à medida que ele desce a montanha. Por
que é importante que a velocidade do vento seja grande?
(b) Suponha que um vento forte esteja se
dirigindo para Denver (altitude igual a 1630 m)
proveniente de Grays Peak (a 80 km a oeste de Denver, a
uma altitude igual a 4350 m) onde a pressão do ar é de
5,60.104 Pa e a temperatura é igual a -15,0°C. Em Denver,
antes da chegada do vento, a pressão do are de 8,12.104 Pa
e a temperatura é igual a 2,0°C. Qual deve ser a elevação
da temperatura em Denver quando o chinook chegar?
42. Um certo gás ideal possui calor específico
molar a volume constante Cv; . Uma amostra deste gás
inicialmente ocupa um volume V0 a uma pressão p0 e uma
temperatura absoluta T0. O gás se expande isobaricamente
até um volume 2V0, a seguir sofre uma expansão
adiabática até um volume final igual a 4V0.
2
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
(a) Desenhe um diagrama PV para esta sequência
de processos,
(b) Calcule o trabalho total realizado pelo gás
nesta sequência de processos.
(c) Ache a temperatura final do gás.
(d) Ache o valor absoluto do calor |Q| trocado
com as vizinhanças nesta sequência de processos e
determine o sentido do fluxo do calor.
3
43. Uma bomba de ar possui um cilindro com um
comprimento igual a 0,250 m com um pistão móvel. A
bomba é usada para comprimir o ar (a uma pressão
absoluta igual a l,01.105 Pa) para o interior de um tanque
muito grande que está a uma pressão manométrica igual a
4,20.105 Pa. (Para o ar, CV = 20,8 J/(kg.K).
(a) O pistão começa a compressão na
extremidade superior aberta do cilindro. Qual é a distância
entre este ponto e o ponto do cilindro para o qual o ar
começa e se escoar para o interior do tanque? Suponha
que a compressão seja adiabática.
(b) Se o ar entra na bomba à temperatura de
27,0°C, qual é a temperatura do ar comprimido?
(c) Qual é o trabalho realizado pela bomba para
fazer 20.0 mol de ar entrar no tanque?
44. Motor com turbocompressor e interresfriador. A potência do motor de um automóvel é
diretamente proporcional à massa de ar forçada para o
interior dos cilindros do motor para produzir uma reação
química com a gasolina. Muitos carros possuem um
turbocompressor que produz a compressão do ar antes de
ele entrar no motor, fornecendo maior quantidade de
massa por unidade de volume. Esta compressão rápida,
essencialmente adiabática, também aquece o ar. Para
poder comprimi-lo ainda mais, o ar passa através de um
inter-resfriador no qual o ar troca calor com suas
vizinhanças à pressão constante. O ar é a seguir injetado
nos cilindros. Em uma instalação típica o ar é conduzido
ao turbocompressor sob pressão atmosférica (l,01.105 Pa),
com densidade
= 1,23 kg/m3 e temperatura igual a
0
15,0 C. Ele é comprimido adiabaticamente até l,45.105 Pa.
No inter-resfriador, ele é resfriado até sua temperatura
original de 15.00C a uma pressão constante de l,45.105 Pa.
(a) Desenhe um diagrama PV para esta sequência
de processos,
(b) Se o volume de um dos cilindros for igual a
575 cm3, qual será a massa de ar proveniente do interresfriador que encherá um cilindro à pressão de l,45.105
Pa? Em comparação com a potência de um motor que
recebe ar a uma pressão de 1,01.105 Pa e à temperatura de
15.0°C, qual é a porcentagem de aumento de potência
obtida usando-se um turbocompressor e um interresfriador?
(c) Caso o inter-resfriador não seja usado, qual
deverá ser a massa de ar proveniente do turbocompressor
que encherá um cilindro à pressão de l,45.105 Pa? Em
comparação com a potência de um motor que recebe ar a
uma pressão de l,01.105 Pa e à temperatura de 15,0°C,
qual é a porcentagem de aumento de potência obtida
usando-se apenas o turbocompressor?
lentamente até ocupar um volume igual ao dobro do
volume inicial, realizando um trabalho igual a 300 J neste
processo. Calcule o calor fornecido ao gás e a variação da
energia interna do gás, sabendo que o processo é:
(a) isotérmico;
(b) adiabático;
(c) isobárico.
46. Um cilindro com um pistão contém 0,250
mol de oxigênio a uma pressão de 2,40.105 Pa e à
temperatura de 355 K. Suponha que o oxigénio possa ser
tratado como um gás ideal. O gás inicialmente se expande
isobaricamente até ocupar um volume igual ao dobro do
volume inicial. A seguir ele é comprimido
isotermicamente de volta para seu volume inicial e
finalmente ele é resfriado isocoricamente até atingir sua
pressão inicial.
(a) Desenhe um diagrama/? V para esta
sequência de processos.
(b) Ache a temperatura durante a compressão
isotérmica.
(c) Calcule a pressão máxima,
(d) Calcule o trabalho total realizado pelo pistão
sobre o gás nesta sequência de processos.
47. Use as condições e os processos
mencionados no Problema 46 para calcular:
(a) o trabalho realizado pelo gás. o calor
fornecido ao gás e a variação da energia interna durante a
expansão inicial;
(b) o trabalho realizado pelo gás, o calor
fornecido ao gás e a variação da energia interna durante o
resfriamento final;
(c) a variação da energia interna durante a
compressão isotérmica.
48. Um cilindro com um pistão contém 0,150
mói de nitrogênio a uma pressão de l,80.105 Pa e à
temperatura de 300 K. Suponha que o nitrogênio possa ser
tratado como um gás ideal. O gás inicialmente é
comprimido isobaricamente até ocupar a metade do seu
volume inicial. A seguir ele se expande adiabaticamente
de volta para seu volume inicial e finalmente ele é
aquecido isocoricamente até atingir sua pressão inicial.
(a) Desenhe um diagrama pV para esta sequência
de processos.
(b) Ache a temperatura no início e no fim da
expansão adiabática.
(c) Calcule a pressão mínima.
49. Use as condições e os processos
mencionados no Problema 48 para calcular:
(a) o trabalho realizado pelo gás, o calor
fornecido ao gás e a variação da energia interna durante a
compressão inicial;
(b) o trabalho realizado pelo gás, o calor
fornecido ao gás e a variação da energia interna durante a
expansão adiabática;
(c) o trabalho realizado pelo gás, o calor
fornecido ao gás e a variação da energia interna durante o
aquecimento final.
45. Um gás ideal monoatômico se expande
3
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
4
50.
Comparação
entre
processos
termodinâmicos. Um cilindro contém l,20 mol de gás
ideal monoatômico inicialmente a uma pressão de
3,60.105 Pa e à temperatura de 300 K e se expande até o
triplo do seu volume inicial. Calcule o trabalho realizado
pelo gás quando a expansão é:
(a) isotérmica;
(b) adiabática;
(c) isobárica;
(d) Usando um diagrama pV, indique cada um
destes processos. Em qual deles o trabalho realizado pelo
gás possui o maior valor absoluto? E o menor valor
absoluto?
(e) Em qual destes processos o calor trocado
possui o maior valor absoluto? E o menor valor absoluto?
(f) Em qual destes processos a variação da
energia interna possui o maior valor absoluto? E o menor
valor absoluto?
51. Um balão flexível contém 0,350 mol de
sulfeto de hidrogénio (H2S) gasoso. Inicialmente o H2S
está a uma temperatura de 27,0°C e ocupa um volume
igual a 7,00.103cm3. O H2S inicialmente se expande
isobaricamente até ocupar um volume igual ao dobro do
volume inicial. A seguir ele se expande adiabaticamente
até que sua temperatura retome ao valor inicial. Suponha
que o H2S possa ser tratado como um gás ideal.
(a) Desenhe um diagrama PV para cada um
destes processos.
(b) Qual é o calor total libertado pelo H2S nesta
transformação?
(c) Qual é a variação total da energia interna do
H2S?
(d) Qual é o trabalho total realizado pelo H2S?
(e) Qual é seu volume final?
52. Oscilações de um pistão. Um cilindro vertical
de raio r contém uma quantidade de gás ideal e possui um
pistão ajustado de massa m que pode se mover livremente
(Figura). O pistão e as paredes do cilindro não possuem
atrito e são feitos com um material isolante perfeito. A
pressão do ar eterno é p0. No equilíbrio, o pistão está a
uma altura h acima da base do cilindro,
(a) Calcule a pressão absoluta do gás preso
abaixo do pistão na posição de equilíbrio,
(b) O pistão é puxado para cima até uma
distância pequena e a seguir é libertado. Calcule a força
resultante que atua sobre o pistão quando ele está a uma
distância igual a h + y acima da base do cilindro, onde y é
muito menor do que h.
(c) Depois que o pistão é puxado para cima e libertado,
ele oscila para cima e para baixo. Ache a frequência
destas pequenas oscilações. Se o deslocamento não for
pequeno, o movimento
continua sendo harmônico
simples? Como você pode garantir sua resposta?
Aberto para o ar externo, pressão p0
53. A equação de estado de van der Waals
fornece o lento aproximado de gases com pressões
elevadas
an2
V nb nRT
V2
Onde a e b são constantes que possuem valores diferentes
para cada tipo e gás. (No caso particular, a = b = 0, ela
fornece a iodo gás ideal.
(a) Calcule o trabalho realizado por um gás para
esta equação de estado quando ele se expande de um
volume V1, até um volume V2.
(b) Para o etano (C2H6, a = 0,554 J.m3/mol2 e b =
-5
6,38.10 m3/mol. Calcule o trabalho W realizado por l,80
mol de etano quando ele se expande de 2,00.10-3 m3 até
4,00.10-3 m3 à temperatura constante de 300 K. Faça os
cálculos usando:
(i) a equação de estado de van der Waals e
(ii) a equação de estado do gás ideal.
(c) Qual é o valor da diferença entre os dois
resultados do cálculo de W no item (b)? Para qual equação
de estado W possui o maior valor? A diferença entre as
duas equações de estado é importante neste caso?
p
54. Um sistema constituído por 0,32 mol de gás
ideal monoatômico, cm cv = 3R/2, ocupa um volume de
2,2 L sob a pressão de 2,4 atm, no estado do ponto A da
figura.
O sistema efetua um ciclo constituído por 3
processos:
(i) O gás é aquecido isobaricamente até atingir o
volume de 4,4 L n ponto B.
(ii) O gás é então resfriado isocoricamente até a
pressão se reduzir a 1,2 atm (Ponto C).
(iii) O gás retorna ao ponto A por meio de uma
compressão isotérmica.
(a) A que temperatura correspondem os pontos
A, B e C?
(b) Calcular W, Q e U para cada processo e
para todo o ciclo.
4
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
MÁQUINAS DE COMBUSTÃO INTERNA
6. Qual deve ser a razão de compressão r de um
ciclo Otto para que ele atinja uma eficiência ideal de
65.0% para = l .40?
P(atm)
2.4
A
1.2
B
C
2.2
4.4
V(L)
5
MÁQUINAS TÉRMICAS
1. Um motor Diesel produz 2200 J de trabalho
mecânico e rejeita 4300 J de calor em cada ciclo,
(a) Qual deve ser a quantidade de calor a ser
fornecida para a máquina em cada ciclo?
(b) Qual é a eficiência térmica da máquina?
2. O motor de um avião recebe um calor de 9000
J e rejeita 6400 J em cada ciclo,
(a) Qual é o trabalho realizado pela máquina em
cada ciclo?
(b) Qual é a eficiência térmica da máquina?
3. Motor a gasolina. Um motor a gasolina
consome 16.100 J de calor e realiza 3700 J de trabalho em
cada ciclo. O calor é obtido pela queima de gasolina que
possui calor de combustão igual a 4,60.104 J/g.
(a) Qual é a eficiência térmica?
(b) Qual é a quantidade de calor rejeitada em
cada ciclo?
(c) Qual é a massa de combustível queimada em
cada ciclo?
(d) Se o motor gira com 60.0 ciclos por segundo,
qual é a potência fornecida pelo motor em quilowatts?
4. Um motor a gasolina produz uma potência
igual a 180 kW. Sua eficiência é igual a 28%.
(a) Qual é a quantidade de calor fornecida para a
máquina por segundo?
(b) Qual é o calor rejeitado pela máquina por
segundo?
5. Uma certa usina termoelétrica alimentada por
reação nuclear produz uma potência mecânica (usada para
operar um gerador elétrico) igual a 330 MW. Sua taxa de
absorção de calor do reator nuclear é igual a 1300 MW. a)
Qual é a eficiência térmica? b) Com que taxa o calor é
rejeitado?
7. Para um ciclo Otto com = l ,40 e r = 9,50. a
temperatura da mistura ar-gasolina quando ela entra no
cilindro é igual a 22.0°C(Ponto (a)).
(a) Qual é a temperatura no final do tempo da
compressão (ponto b)?
(b) A pressão inicial da mistura de ar-gasolina
(ponto a) é igual a 8,50.104 Pa, ligeiramente abaixo da
pressão atmosférica. Qual é a pressão no final do tempo
da compressão?
8. O motor com ciclo Otto de uma MercedesBenz SLK230 possui uma razão de compressão igual a
8,8.
(a) Qual é a eficiência ideal do motor? Use = l
,40.
(b) O motor de um Dodge Viper GT2 possui uma
razão de compressão ligeiramente maior e igual a 9.6.
Qual é o aumento da eficiência ideal produzida por este
aumento da razão de compressão?
Refrigeradores
9. Um refrigerador possui coeficiente de
performance igual a 2,10. Ele absorve 3,40.10 4J de calor
de um reservatório frio em cada ciclo.
(a) Qual a energia mecânica em cada ciclo para
operar o refrigerador?
(b) Durante cada ciclo, qual é o calor rejeitado
para o reservatório quente?
10. Um líquido refrigerante a uma pressão de l
,34.105 Pa deixa a válvula de expansão de um refrigerador
a -23,0°C. Ele a seguir flui através das serpentinas de
vaporização dentro do refrigerador e sai como vapor com
a mesma pressão e a -20,5°C, a mesma temperatura que
existe dentro do refrigerador. O ponto de ebulição do
refrigerante a esta pressão é igual a -23,0°C, o calor de
vaporização é igual a l ,60.105 J/kg e o calor específico do
vapor à pressão constante é igual a 485 J/(kgK). O
coeficiente de performance do refrigerador é Kp = 2,8. Se
8,00 kg se escoam através do refrigerador a cada hora,
calcule a potência elétrica que deve ser fornecida ao
refrigerador.
11. Uma unidade de condicionador de ar em uma
janela absorve 9,80.104 J de calor por minuto de uma sala
que está sendo resfriada e no mesmo intervalo de tempo
despeja l.44.105 J de calor no ar externo,
(a) Qual é o consumo de potência desta unidade
em watts?
(b) Qual é a eficiência energética desta unidade?
12. Um freezer possui um coeficiente de
performance igual a 2.40. O freezer deve converter l,80 kg
de água a 25,0°C para l.80 kg de gelo a -5,0°C em uma
hora.
5
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
(a) Qual é a quantidade de calor que deve ser
necessário para operar o refrigerador?
(b) Qual é a energia elétrica consumida pelo
freezer durante uma hora?
(c) Qual é a quantidade de calor desperdiçado
rejeitado para a sala na qual o freezer está localizado?
O CICLO DE CARNOT
6
13. Uma máquina de Carnot cujo reservatório
quente está a uma temperatura de 620 K absorve 550 J de
calor nesta temperatura em cada ciclo e fornece 335 J
para o reservatório frio.
(a) Qual é o trabalho produzido pela máquina
durante cada ciclo?
(b) Qual é a temperatura da fonte fria?
(c) Qual é a eficiência térmica do ciclo?
14. Uma máquina de Carnot opera entre dois
reservatórios com temperaturas de 520 K e 300 K.
(a) Se a máquina recebe 6,45 kJ de calor do
reservatório a 520 K em cada ciclo, quantos joules por
ciclo ela rejeita ao reservatório a 300 K?
(b) Qual é o trabalho mecânico produzido pela
máquina durante cada ciclo?
(c) Qual é a eficiência térmica da máquina?
15. Uma máquina que produz gelo opera com um
ciclo de Carnot. Ela recebe calor da água a 0,0°C e
rejeita calor para uma sala a 24.0°C. Suponha que 85,0
kg de água a 0,0°C sejam convertidos para gelo a 0,0°C.
(a) Qual é o calor rejeitado para a sala?
(b) Qual é a energia que deve ser fornecida para
a máquina?
16. Um refrigerador de Carnot opera entre dois
reservatórios de temperaturas de 320 K e 270 K.
(a) Se em cada ciclo o refrigerador recebe 415 J
de calor do reservatório a 270 K, qual é a quantidade de
calor em joules transferida para o reservatório a 320 K?
(b) Se o refrigerador executa 165 ciclos em cada
minuto, qual é a potência necessária para operar o
refrigerador?
(c) Qual é o coeficiente de performance do
refrigerador?
17. Um dispositivo de Camot extrai 5,0 kJ de
calor de um corpo a -10,0°C. Que trabalho é realizado
quando o dispositivo rejeita calor para o ambiente a uma
temperatura de
(a) 25,0°C;
(b) 0,0°C;
(c) -25,0°C?
Em cada caso, o dispositivo funciona como uma
máquina ou como um refrigerador?
18. Um inventor alega ter desenvolvido uma
máquina que em cada ciclo retira 2,60.108 J de calor a
uma temperatura de 400 K. realiza um trabalho mecânico
de 42,0 kWh e rejeita calor a uma temperatura de 250 K.
Você investiria dinheiro para comercializar esta
máquina? Justifique sua resposta.
19. (a) Mostre que a eficiência e de uma máquina
de Carnot e o coeficiente de performance Kp de um
refrigerador de Carnot são relacionados por Kp = (l - e)/e.
A máquina e o refrigerador operam entre os mesmos
reservatórios quentes e frios,
(b) Qual é o valor de Kp para os valores limites
quando e → l e e → 0? Explique.
ENTROPIA
20. Um estudante universitário, na falta do que
fazer, aquece 0,350 kg de gelo a 0,0°C até ele se fundir
completamente.
(a) Qual é a variação da entropia da água?
(b) A fonte de calor é um corpo com massa
muito grande a uma temperatura igual a 25,0°C. Qual é a
variação de entropia do corpo?
(c) Qual é a variação total de entropia da água e
da fonte de calor?
21. Calcule a variação de entropia que ocorre
quando misturamos l ,00 kg de água a 20,0°C com 2,00
kg de água a 80,0°C.
*18.22 Em um processo reversível três moles de um gás
ideal são comprimidos isotermicamente a 20,0°C. Durante
a compressão, um trabalho de 1850 J é realizado sobre o
gás. Qual é a variação de entropia do gás?
22. Qual é a variação de entropia de 0.130 kg do
gás hélio no seu ponto de ebulição normal quando ele se
condensa totalmente isotermicamente para l,.00 L de hélio
líquido?
23. Qual a variação de entropia de 0,130 kg de
gás hélio no seu ponto de ebulição normal quando ele se
condensa totalmente isotermicamente para 1,00l de hélio
líquido?
24. (a) Calcule a variação de entropia quando l
,00 kg de água a 100°C é vaporizado e convertido em
vapor d'água a 100°C.
(b) Compare sua resposta com a variação de
entropia quando l,00 kg de gelo se funde a 0°C. A
variação de entropia é maior ou menor do que a variação
de entropia na liquefação? Interprete sua resposta, usando
a ideia de que a entropia está associada com o grau de
desordem de um sistema.
25. (a) Calcule a variação de entropia quando
ocorre vaporização de l .00 mol de água (massa molecular
18,0 g/mol) a 100°C.
(b) Repita o cálculo da parte (a) para l ,00 mol de
nitrogénio líquido, l,00 mol de prata e l ,00 mol de
6
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
mercúrio quando cada um destes materiais é vaporizado
em seu ponto de ebulição normal. Note que a molécula do
nitrogénio é N2.
(c) As respostas que você encontrou nos itens (a)
e (b) concordam com boa aproximação. (Resultado
conhecido como regra de Crepes e Trouton.} Explique a
razão deste resultado, usando a ideia de que a entropia
mede o grau de desordem de um sistema.
7
26. Um bloco de cobre com massa igual a 3,50
kg, inicialmente a 100,0°C. é colocado em um recipiente
com 0,800 kg de água inicialmente a 0,0°C.
(a) Qual é a temperatura final do sistema?
(b) Qual é a variação total de entropia do
sistema?
27. Dois moles de gás ideal sofrem expansão
isotérmica reversível de 0,0280 m3 até 0,0420 m3 a uma
temperatura de 25.0°C. Qual é a variação de entropia do
gás?
INTERPRETAÇÃO MICROSCÓPICA
DA ENTROPIA
28. Uma caixa possui dois compartimentos
separados por uma partição. O lado esquerdo da caixa
contém 500 moléculas do gás nitrogênio, o lado direito
contém 100 moléculas do gás oxigênio. Os dois gases
estão na mesma temperatura. A partição é perfurada e o
equilíbrio é atingido. Suponha que o volume da caixa seja
suficientemente grande para que cada gás sofra uma
expansão livre mantendo sua temperatura constante,
(a) Na média, quantas moléculas de cada gás
estarão em cada metade da caixa?
(b) Qual é a variação de entropia do sistema
depois que a partição foi perfurada?
(c) Qual seria a probabilidade de encontrar as
29. Dois moles de gás ideal ocupam um volume
V. O gás sofre uma expansão isotérmica reversível até
um volume 3 V. a) A probabilidade das velocidades se
altera pela expansão isotérmica? Explique, b) Use a
Equação (18.23) para calcular a variação de entropia do
gás. c) Use a Equação (18.18) para calcular a variação de
Entropia do gás. Compare este resultado com o obtido na
parte (b).
30. Você lança quatro moedas idênticas sobre o
piso. Cada moeda possui a mesma probabilidade de
mostrar o lado da cara ou da coroa,
(a) Qual é a probabilidade de todas as quatro
moedas mostrarem cara? De todas indicarem coroa?
(b) Qual é a probabilidade da ocorrência de três
caras e uma coroa? Qual é a probabilidade da ocorrência
de três coroas e uma cara?
(c) Qual é a probabilidade da ocorrência de duas
caras e duas coroas?
(d) Qual é a soma de todas as probabilidades
calculadas em todos os itens anteriores? Explique.
FONTES DE ENERGIA:
31. Aquecimento solar no inverno. Uma casa
bem isolada em Columbus, Ohio, possui uma área
construída de 150 m2 e necessita de 1,50.1010 J de calor
durante o mês de janeiro. Este calor deve ser fornecido
por um coletor solar com uma eficiência de 60% para a
captação da energia solar. Em Columbus, a energia solar
incidente média (dia e noite) durante o mês de janeiro é
igual a 65,7 W/m . Qual é a área necessária do coletor
solar? O coletor se encaixaria no telhado da casa?
32.
(a) O proprietário de uma casa em um país de
clima frio possui uma lareira que queima 4500 kg de
carvão durante o inverno. O carvão usado possui calor de
combustão igual a 2,70.107 J/kg. Sabendo que as perdas
das camadas (calor perdido ao longo da chaminé) são de
20%, quantos joules foram efetivamente usados para
aquecer a casa?
(b) O proprietário propõe a construção de um
sistema de aquecimento solar, aquecendo grandes tanques
de água com a energia solar durante o verão e usando a
energia armazenada para aquecimento durante o inverno.
Ache as dimensões necessárias para o tanque de
armazenamento a fim de que a energia armazenada no
tanque seja igual à calculada no item (a). Suponha que o
tanque seja um cubo e que a água possua uma
temperatura de 49,0°C no verão e de 27,0°C no inverno.
33. O telhado de uma casa suburbana é equipado
com painéis coletores solares com área igual a 8,0 m2 e
eficiência de 60%, usados para aquecer água de 15,0°C
até 55,0°C para uso das necessidades domésticas,
(a) Se a energia solar média incidente for igual a
150 W/m2, qual é o volume de água que pode ser
aquecido em uma hora?
(b) Durante um dia médio, o consumo médio
para satisfazer as necessidades domésticas é cerca de 75
L de água quente a 55,0°C por pessoa. Quantas pessoas
este sistema de aquecimento de água pode satisfazer?
34. Uma usina elétrica com uso da energia solar
deve ser construída para gerar uma potência igual a 850
MW. Calcule a área necessária do terreno que os coletores
solares devem ocupar, supondo que eles sejam
(a) fotocélulas com 60% de eficiência;
(b) espelhos que geram vapor para uma turbina a
vapor com eficiência global de 30%. Suponha que a
potência média dos raiol^B1 solares que atingem a
superfície terrestre seja igual a 200 W/m2. Expresse sua
resposta em quilómetros quadrados.
35. Uma "casa solar" possui dispositivos que
podem armazenar 4,00.109 J de energia. Compare as áreas
necessárias (em m3) para este armazenamento supondo
que
(a) a energia seja armazenada na água aquecida
de uma temperatura mínima de 21,0°C até uma
temperatura máxima de 49,0°C;
(b) a energia seja armazenada no sal de Glauber
aquecido no mesmo intervalo de temperatura.
7
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
PROPRIEDADES DO SAL DE GLAUBER (Na2SO4 10H20)
Calor específico - sólido
Calor específico - líquido
Densidade
Ponto de fusão
Calor de fusão
1930 J/(kg-K)
2850 J/(kg • K)
1600 (kg/m3)
32°C
2,42.105J/kg
(c) Qual é a vantagem do uso do sal de Glauber?
36. Uma usina termoelétrica alimentada pela
8 queima de carvão produz uma potência mecânica de 1100
MW com uma eficiência térmica igual a 35,0%.
(a) Qual é a taxa de fornecimento de calor
decorrente da queima do carvão?
(b) Caso se use o: carvão de West Virgínia, que
possui calor de combustão igual a 3,00.104 J/g, qual é a
massa de carvão queimada por segundo? E por dia?
(c) Com que taxa o calor é rejeitado pelo
sistema?
(d) Se o calor rejeitado for fornecido para a água
de um rio e a temperatun da água não deve aumentar mais
do que 4,0°C, qual é o volume de água necessário por
segundo?
(e) Na parte (d), se o rio possui seção reta
retangular com profundidade igual a 5,0 m e largura de
100 m, qual deve ser a velocidade de escoamento da
água?
37. Automóvel elétrico versus automóvel
comercial.
(a) Considere um processo de conversão de
energia envolvendo duas etapas; tais como usar o calor
para vaporizar água e usar o vapor para acionar a turbina
de um gerador elétrico. Cada etapa possui uma eficiência
própria. A eficiência global do processo é igual ao
produto das eficiências, igual à soma das efíciências, igual
à diferença das eficiências ou igual a quê? Explique seu
raciocínio,
(b) Um automóvel convencional possui
eficiência global aproximadamente igual a 15%; ou seja,
somente 15% da energia queimada pelo combustível pode
ser aproveitada na obtenção da energia cinética do
automóvel, ou seja, somente 15% da energia queimada
pode ser convertida na energia cinética do automóvel. No
carro elétrico, com um motor alimentado por bateria, a
energia é fornecida pelo gerador de uma usina elétrica que
carrega a bateria. Calcule a eficiência de um automóvel
elétrico usando os seguintes dados:
(i) Uma usina elétrica típica possui uma
eficiência de 40%;
(ii) 10% da energia
(b) De quantos graus Celsius a temperatuili da
fonte fria deve diminuir mantendo constante a
temperatura da fonte quente?
39. Uma máquina térmica usa 0,350 mol de um
gás diatômico ideal e executa o ciclo indicado no
diagrama? Ver Figura. O processo l → 2 ocorre a volume
constante, o processo 2 → 3 é adiabático e o processo 3
→ l ocorre com uma pressão constante de l ,00 atm. O
valor de para este gás é igual a l,40.
(a) Ache a pressão e o volume nos pontos l, 2 e
3.
(b) Calcule Q, W e U para cada um dos três
processos,
(c) Ache o trabalho total realizado pelo gás no
ciclo,
(d) Calcule o fluxo de calor total para o interior
da máquina em um ciclo,
(e) Qual é a eficiência térmica da máquina?
Como isto se compara com a eficiência de um ciclo de
Camot operando entre as mesmas temperaturas extremas
T1 e T2?
40. Uma usina elétrica experimental no
Laboratório de Energia Natural no Havaí gera energia
elétrica a partir do gradiente de temperatura do oceano. A
água da superfície está a 27°C e a água em profundidades
elevadas está a 6°C.
(a) Qual é a eficiência teórica máxima desta
usina?
(b) Se a usina deve produzir 210 kW de potência,
com que taxa o calor deve ser extraído da água quente?
Com que taxa o calor deve ser absorvido da água fria?
Suponha a eficiência máxima teórica,
(c) A água fria que sai da usina possui
temperatura igual a 10°C. Qual deve ser a vazão da água
fria através do sistema? Dê a sua resposta em kg/h e em
L/h.
41. Calcule a eficiência térmica da máquina que
usa n moles de um gás ideal diatômico e executa o ciclo l
→ 2 →3 → 4 →l indicado na Figura:
38. Uma máquina de Carnot cujo reservatório
frio está a -90,0°C possui eficiência de 40%. Um
engenheiro recebeu a tarefa de fazer a eficiência aumentar
para 45%.
(a) De quantos graus Celsius a temperatura do
reservatório quente deve aumentar sabendo que a
temperatura do reservatório frio permanece constante?
8
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
9
42. Um cilindro contém oxigênio a uma pressão
de 2,00 atm. O seu volume é igual a 4,00 L e a
temperatura é igual a 300K, Suponha que o oxigênio
possa ser considerado um gás ideal.
O oxigênio é submetido aos seguintes processos:
(i) Aquecido à pressão constante do estado
inicial (estado 1) até o estado 2, cuja temperatura é T =
450K.
(ii) Resfriado a volume constante até 250K
(estado 3).
(iii) Comprimido à temperatura constante até um
volume de 4,00 L (estado 4),
(iv) Aquecido a volume constante até 300 K.
fazendo o sistema retornar ao estado l.
(a) Identifique estes quatro processos em um
diagrama PV, fornecendo os valores numéricos de P e V
em cada um dos quatro estados,
(b) Calcule Q e W para cada um dos quatro
processos.
(c) Ache o trabalho total realizado pelo oxigênio,
(d) Qual é a eficiência deste dispositivo como
máquina térmica? Como se compara esta eficiência com a
eficiência de um ciclo de Carnot entre as mesmas
temperaturas extremas de 250 K e 450 K?
43. Processos termodinâmicos para um
refrigerador. Um refrigerador opera mediante o ciclo
indicado na Figura. Os processos de compressão (d→a) e
expansão (b→c) são adiabáticos. A pressão, a temperatura
e o volume do refrigerante em cada um dos quatro estados
a, b, c e d são dados na tabela abaixo.
Estado
a
b
c
d
T(°C)
80
80
5
5
P(kPa)
2305
2305
363
363
V (m3)
0,0682
0,00946
0,2202
0,4513
U(kJ)
1969
1171
1005
1657
Percentagem
de liquido
0
100
54
5
(a) Em cada ciclo, qual é o calor retirado do
interior do refrigerador para o líquido refrigerante
enquanto ele se encontra no evaporador?
(b) Em cada ciclo, qual é o calor rejeitado do
refrigerante para fora do refrigerador enquanto o
refrigerante está no condensador?
(c) Em cada ciclo, qual é o trabalho realizado
pelo motor que aciona o compressor?
(d) Calcule o coeficiente de performance do
refrigerador.
44. Um gá monoatômico ideal executa o ciclo da
figura no sentido indicado. A trajetória no processo c → a
é uma linha reta no diagrama PV.
Calcule:
(a) Q, W e U para cada processo: a → b, b → c,
c → d, d → a.
(b) Quais os valores de Q, W e U para o ciclo
completo?
(c) Qual é a eficiência do ciclo?
45. Ciclo Stirling. O ciclo Stirling é semelhante
ao ciclo Oito, exceto quando a compressão e a expansão
do gás ocorrem isotermicamente e não adiabaticamente
como no caso do ciclo Otto. O ciclo Stirling é usado em
uma máquina de combustão externa, ou seja, a máquina
na qual o gás no interior do cilindro não é usado no
processo de combustão. O calor é fornecido
continuamente pelo fluido combustível no exterior do
cilindro, em vez de ser oriundo de uma explosão no
interior do cilindro como no ciclo Otto. Por esta razão, as
máquinas que funcionam com o ciclo Stirling são mais
silenciosas do que as máquinas que funcionam com o
ciclo Otto, uma vez que não existe válvula de admissão
nem válvula de exaustão (a principal fonte de ruído do
motor). Embora pequenas máquinas de Stirling possam
ser usadas em diversas aplicações, o uso do ciclo Stirling
em um automóvel não teve êxito porque o motor é maior,
mais pesado e mais caro do que o motor convencional do
automóvel. No ciclo, o fluido de trabalho realiza os
seguintes processos (Figura):
(i) Compressão isotérmica à temperatura T, do
estado inicial a até o estado b, com uma razão de
compressão r.
(ii) Aquecimento a volume constante até o estado
c com temperatura T1.
(iii) Expansão isotérmica à temperatura T2; até o
estado d.
(iv) Esfriamento a volume constante retornando
para o estado inicial a.
Suponha que o fluido de trabalho seja n moles de
um gás ideal (para o qual CV não depende da
temperatura),
(a) Calcule Q, W e U para os processos a → b,
b → c, c → d, d → a.
(b) No ciclo Stirling, os calores transferidos no
processos b → c, e d → a não envolvem fontes de calor
externas, porém usam a regeneração: a mesma substância
que transfere calor ao gás dentro do cilindro no processo b
→ c também absorve calor de volta do gás no processo d
→ a. Portanto, os calores transferidos Qb→c, e Qd→a não
desempenham pape! na determinação da eficiência da
máquina. Explique esta última afirmação comparando as
expressões de Qb→c, e Qd→a, obtidas na parte (a),
(c) Calcule a eficiência de um ciclo Stirling em
termos das temperaturas T1 E T2. Como ele se compara
com a eficiência de um ciclo de Camot operando entre
estas mesmas temperaturas? (Historicamente o ciclo
Stirling foi deduzido antes do ciclo de Carnot.) Este
resultado viola a segunda lei da termodinâmica? Explique.
Infelizmente a máquina que funciona com o ciclo Stirling
não pode atingir esta eficiência, devido a problemas
oriundos de transferência de calor e perdas de pressão na
9
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
máquina.
10
46. Uma máquina de Carnot opera entre dois
reservatórios de calor com temperaturas TH e TC. Um
inventor propõe aumentar sua eficiência fazendo uma
máquina operar entre TH e uma temperatura intermediária
T' e uma segunda máquina entre T' e TC, usando nesta
segunda máquina o calor rejeitado pela primeira máquina.
Calcule a eficiência desta máquina composta e compare-a
com a eficiência da máquina original.
47. A potência máxima que pode ser extraída de
uma turbina de vento acionada por uma corrente de ar é
aproximadamente P kd 2v3 , onde d é o diâmetro da
lâmina, v é a velocidade do vento e k = 0,5 W • s2/m5,
(a) Explique a dependência de P com d e com v
considerando um cilindro de ar passando sobre a lâmina
da turbina no instante t (Figura). Este cilindro possui
diâmetro d, comprimento L = vt e densidade .
(b) A turbina de vento Mod-5B em Kahaku, na
ilha Oahu do Havaí, possui uma lâmina com 97 m de
diâmetro (comparável com um campo de futebol) e se
encontra no alto de uma torre de 58 m. Esta turbina pode
produzir uma potência elétrica de 3,2 MW. Supondo uma
eficiência de 25%, qual é a velocidade do vento necessária
para produzir esta potência? Dê a resposta em m/s e km/h.
(c) As turbinas de vento comerciais são
localizadas geralmente nas passagens entre morros ou na
direçâo do vento de um modo geral. Por quê?
l galão = 3,788 litros). A gasolina possui um calor de
combustão igual a 4,60.107 J/kg e sua densidade é igual a
740 kg/m3.
(a) A 105 km/h qual é a taxa de consumo de
gasolina em L/h?
(b) Qual é a eficiência teórica deste motor? Use
= 1,40.
(c) Qual é a potência produzida pelo motor a 105
km/h? Suponha que o motor esteja operando com sua
eficiência teórica máxima e forneça sua resposta em
watts,
(d) Por causa do atrito e das perdas de calor, a
eficiência real é da ordem de 15%. Repita a parte (c)
usando esta informação. Qual é a fração da potência
máxima teórica possível que é usada na velocidade
mencionada?
49. Termodinâmica do automóvel. Um Passat
possui um motor a gasolina com seis cilindros operando
mediante o ciclo Otto com uma razão de compressão r =
10,6. O diâmetro do cilindro, chamado de. furo do motor,
é igual a 82,5 mm. A distância que o pistão percorre
durante a compressão indicada na Figura, chamada de
curso, é igual a 86,4 mm. A pressão inicial da mistura de
ar com gasolina (no ponto o a da Figura) é igual a
8,50.104 Pa e a temperatura inicial é igual a 300 K (igual à
temperatura do ar externo). Suponha que 200 J de calor
sejam fornecidos para cada cilindro em cada ciclo de
queima de gasolina e que o gás possua CV. = 20,5 J/(mol.
K) e = 1.40.
(a) Calcule o trabalho total realizado em um
ciclo em cada cilindro do motor e o calor rejeitado quando
o gás se esfria até a temperatura do ar externo,
(b) Calcule o volume da mistura de ar com
gasolina no ponto a do ciclo,
(c) Calcule a pressão, o volume e a temperatura
do gás nos pontos, b. c e d do ciclo. Em um diagrama pV,
mostre os valores numéricos de p. V e T para cada um dos
quatro estados,
(d) Calcule a efiiência de um ciclo de Camot
operando entre as mesmas peraturas extremas.
50. Calcule novamente a variação de entropia entre os
pontos 'ftbón Figura se o caminho reversível for (a) uma
expansão isobárica até 2 V seguida de um processo
isocórico;
(b) um resfriamento isocórico até p seguido de uma
expansão liobárica.
51. Um cubo de gelo de 0,0500 kg com uma
temperatura fcial de -15,0°C é colocado em 0,600 kg de
água a uma temperatura T = 318 K de água em um
recipiente isolado com fass desprezível. Calcule a
variação de entropia do sistema.
48. Economia de combustível e performance
de um automóvel. O motor do ciclo Otto de um
automóvel Volvo V70 possui uma razão de compressão r
= 8,5. A Agência de Proteção Ambiental dos Estados
Unidos verificou que o consumo deste carro com uma
velocidade mais económica em uma estrada (105 km/h) é
igual a 25 milhas por galão (l milha = l ,609 km:
52. (a) Para o ciclo Otto indicado na Figura,
calcule as transformações de entropia do gás em cada um
dos processos a volume constante b → c e d → a em
termos das temperaturas Ta,Tb, Tc e Td, do número de
moles n e do calor específico Cv do gás.
(b) Qual é a variação total de entropia durante o
ciclo? ingestão: Use a relação entre Ta e Tb e a relação
10
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
entre Td e Tc.
(c) Os processos b → c e d → a ocorrem de
modo irreversível em um ciclo Otto real. Explique como
conciliar isto com o resultado que você achou no item (b).
11
53. Diagrama TS. (a) Faça um gráfico do ciclo
de Camot. indicando a entropia no eixo horizontal e a
temperatura Kelvin no eixo vertical. Trata-se de um
diagrama temperatura-entropia ou diagrama TS.
(b) Mostre que a área embaixo da curva que
representa qualquer processo reversível no diagrama TS
apresenta o calor absorvido pelo sistema,
(c) Utilize o diagrama ÏSpara deduzir a eficiência
térmica do ciclo de Carnot.
(d) Faça um diagrama TS para o ciclo Stirling
descrito no Problema 45, use este diagrama para
relacionar a eficiência do ciclo Stirling com a eficiência
do ciclo de Carnot.
(b) Mostre que a variação de entropia S,
considerada como função de T, toma-se máxima quando T
= T', que é precisamente a condição de equilíbrio
termodinâmico,
(c) Discuta o resultado da parte (b) considerando
a ideia de que a entropia indica o grau de desordem de um
sistema.
57. Considere um ciclo Diesel que começa (no
ponto a da Figura com a temperatura do ar igual a Ta. O ar
pode ser considerado um gás ideal,
(a) Se a temperatura do ponto c é T,.,deduza uma
expressão para a eficiência do ciclo em termos da razão de
compressão r.
(b) Calcule o valor da eficiência considerando T,
= 300 K, T, = 950 K, = 1,40 e r = 21,0.
54. Um aluno de física mergulha uma
extremidade de uma barra de cobre na água fervendo a
100°C e a outra extremidade em uma mistura de água e
gelo a 0°C. Os lados das barras são isolados. Depois que o
estado estacionário é atingido na barra, ocorreu a fusão de
0,160 kg de gelo em um certo intervalo de tempo. Para
este intervalo de tempo, calcule
(a) a variação de entropia da água que estava
fervendo;
(b) a variação de entropia da mistura de água e
gelo;
(c) a variação de entropia da barra de cobre;
(d) a variação total de entropia do sistema.
55. Para aquecer uma xícara de água (250 cm )
para fazer café você coloca um resistor de aquecimento
dentro da água. A medida que a temperatura da água
aumenta de 20°C até 65°C, a temperatura do resistor de
aquecimento se mantém constante e igual a l20°C.
Calcule a variação de entropia
(a) da água;
(b) do resistor de aquecimento;
(c) do sistema constituído pela água mais o
resistor. (despreze o calor que flui para a cerâmica da
xícara de café.)
(d) Este processo é reversível ou irreversível?
Explique.
56. Um objeto de massa m1, calor específico c1, e
temperatura T1, é colocado em contato com um segundo
objeto de massa m2, calor específico c2, e temperatura T2;
> T1. Por causa disto, a temperatura do primeiro objeto
cresce para T a temperatura do segundo objeto diminui
para T',
(a) Mostre que o aumento de entropia do sistema
é dado por:
T
T
S m1c1 ln
m2 c2 ln
T1
T2
e mostre que a conservação da energia exige que:
T
T
m1c1 ln
m2 c2 ln
T1
T2
11
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
12
12
Termodinâmica – Prof. Dr. Cláudio S. Sartori – Exercícios
13
13
Baixar