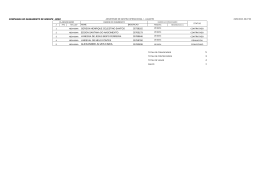
03/10/2009 Validação de equipamentos de Esterilização Aplicações em esterilizadores a vapor Gerson R. Luqueta Eng. Gerson R. Luqueta Origens da Validação Origem Remota – Antigo Egito Origem Clássica – Europa – Desenv. Método científico Origem Técnica – EUA – Década de 40 - Aeronáutica Origem histórica na saúde – Década 60 - Farmacêutica Gerson R. Luqueta Eng. Gerson R. Luqueta 1 03/10/2009 VALIDAÇÃO DO PROCESSO DEFINIÇÃO 1 (FDA- GMP) AÇÃO DE PROVAR, DE ACORDO COM AS BOAS PRÁTICAS (BP) E POR MÉTODOS DE PROVA DOCUMENTAL, QUE QUALQUER PROCEDIMENTO, EQUIPAMENTO, MATERIAL, ATIVIDADE OU SISTEMA CONDUZ REALMENTE AOS RESULTADOS ESPERADOS Gerson R. Luqueta Eng. Gerson R. Luqueta VALIDAÇÃO DO PROCESSO DEFINIÇÃO (SOBECC) PROCEDIMENTO DOCUMENTADO PARA A OBTENÇÃO DE REGISTRO E INTERPRETAÇÃO DE RESULTADOS DESEJADOS PARA O ESTABELECIMENTO DE UM PROCESSO, QUE DEVE CONSISTENTEMENTE FORNECER PRODUTOS, CUMPRINDO ESPECIFICAÇÕES PRÉ--DETERMINADAS. PRÉ Fonte : Práticas Recomendadas SOBECC – 5ª Edição - 2009 – página 281 Gerson R. Luqueta Eng. Gerson R. Luqueta 2 03/10/2009 VALIDAÇÃO DO PROCESSO Objetivos: Demonstrar a capacidade de operação dentro de parâmetros estabelecidos para: Equipamento Instrumentação Utilidades Estudo do comportamento térmico da máquina e da carga Gerson R. Luqueta Eng. Gerson R. Luqueta VALIDAÇÃO DO PROCESSO Algumas vantagens: Conhecer o perfil e qualidade do processo Proporcionar segurança aos responsáveis Atender as normas vigentes Otimizar os custos de processo Quem é o responsável? Gerson R. Luqueta Eng. Gerson R. Luqueta 3 03/10/2009 Resoluções - ANVISA RDC156/06 – Reprocessamento de artigos médicos RE 2.606/06: Validação do reprocessamento de produtos Consulta Pública nº 34, de 3 de junho de 2009: Dispõe sobre o funcionamento de serviços que realizam processamento de produtos para saúde e dá outras providências Gerson R. Luqueta Eng. Gerson R. Luqueta VALIDAÇÃO DO PROCESSO Deve ser baseada em uma metodologia Deve seguir um conjunto de protocolos Todos os procedimentos devem estar evidenciados É uma tarefa periódica A periodicidade é determinada pelo usuário, de acordo com o estudo de desvios do processo (ISO 9000) Gerson R. Luqueta Eng. Gerson R. Luqueta 4 03/10/2009 EXEMPLOS DE METODOLOGIAS MS – Recomendações para CME – Manual 108. AORN – Recommended Practices Good Automation Manufacturing Practics (GMP) NBR-ISO / ISO – AAMI standards Metodologia validada por Benchmarking Gerson R. Luqueta Eng. Gerson R. Luqueta Metodologia GAMP - FDA PQ REU Especif. Funcional OQ Especif. Detalhada IQ Construção do Sistema Gerson R. Luqueta Eng. Gerson R. Luqueta 5 03/10/2009 REQUERIMENTO DO USUÁRIO Documento formal – Base da licitação ou compra Deve ser o mais completo possível Deve contemplar as normas a serem atendidas Deve apresentar respostas às necessidades Baseado em metodologia ou lista de verificação Gerson R. Luqueta Eng. Gerson R. Luqueta REU mal desenvolvido? Gerson R. Luqueta Eng. Gerson R. Luqueta 6 03/10/2009 REQUERIMENTO DO USUÁRIO O quê, quando, onde, porquê, quem, quanto e como Equipamento alvo – o que deve cumprir Necessidades imediatas e futuras – plano e cenários Prazos – Instalação, testes, liberação, etc. Custos de aquisição, operação e MANUTENÇÃO Gerson R. Luqueta Eng. Gerson R. Luqueta Metodologia GAMP - FDA PQ REU Especif. Funcional OQ Especif. Detalhada IQ Construção do Sistema Gerson R. Luqueta Eng. Gerson R. Luqueta 7 03/10/2009 QUALIFICAÇÃO INSTALAÇÕES Baseada nas especificações do fabricante A base deve ser o manual de instalação Relatório com “check-list” de todos os suprimentos Visão das especificações do produto - desempenho Gerson R. Luqueta Eng. Gerson R. Luqueta QUALIFICAÇÃO INSTALAÇÕES Deve incluir demonstração com desempenho de projeto “FAT” –do Teste de aceitação em5 fábrica Documentação equipamento (item da ISO) Calibração dos instrumentos de operação e teste * Demonstração da qualidade e conformidade das utilidades* Teste de remoção de ar – quando aplicável Gerson R. Luqueta Eng. Gerson R. Luqueta 8 03/10/2009 Metodologia GAMP - FDA PQ REU Especif. Funcional OQ Especif. Detalhada IQ Construção do Sistema Gerson R. Luqueta Eng. Gerson R. Luqueta QUALIFICAÇÃO DE DESEMPENHO Deve demonstrar que o equipamento atende ao requerimento do usuário Realização de testes operacionais Testes de alarmes, falhas e segurança Realização de “desafios” físicos, mecânicos, biológicos, etc. Gerson R. Luqueta Eng. Gerson R. Luqueta 9 03/10/2009 QUALIFICAÇÃO DE DESEMPENHO Etapa de pré-operação do equipamento Deve desafiar o equipamento e o processo ao máximo Contratação de empresa para análise do perfil térmico Pode envolver a re-avaliação dos procedimentos internos Gerson R. Luqueta Eng. Gerson R. Luqueta Metodologia GAMP - FDA PQ REU Especif. Funcional OQ Especif. Detalhada IQ Construção do Sistema Gerson R. Luqueta Eng. Gerson R. Luqueta 10 03/10/2009 QUALIFICAÇÃO DESEMPENHO Demonstração da reprodutibilidade de processo Elaboração do Procedimento Operacional Padrão (POP) Correlação entre parâmetros físicos e letalidade microbiológica Controle de intervenções periódicas e não periódicas Gerson R. Luqueta Eng. Gerson R. Luqueta PASTA DE DOCUMENTOS Protocolo de validação Manual do equipamento Certificados dos instrumentos (internos e externos) Relatórios de qualificação térmica e estudo de penetração Comprovação do desafio microbiológico Certificados de treinamento dos usuários Relatórios assinados pela(o) enfermeira(o) responsável Plano de Manutenção preventiva Gerson R. Luqueta Eng. Gerson R. Luqueta 11 03/10/2009 EXEMPLO DE PROCEDIMENTO DE VALIDAÇÃO - ESTERILIZADOR A VAPOR - Gerson R. Luqueta Eng. Gerson R. Luqueta IQ - UTILIDADES Geração de vapor (água) – limites de contaminantes Água para o sistema de vácuo – potável a 15°C Instalações elétricas – ANEEL – Res. 676 19/12/2003 Ar comprimido seco – lubrificante isento de contaminantes Gerson R. Luqueta Eng. Gerson R. Luqueta 12 03/10/2009 Gerson R. Luqueta Eng. Gerson R. Luqueta TESTE BOWIE & DICK Padrão ISO - NBR ISO11.140 / Padrão Europeu BS7720 Forma de uso – De acordo com a AORN e AAMI Procedimentos descritos: “Recomendações Gerais para Central de Esterilização” do ministério da Saúde / 2001 no item 5.1.2.2 “Práticas Recomendadas – SOBECC – 5ª Edição – 2009 páginas 250, 275” Gerson R. Luqueta Eng. Gerson R. Luqueta 13 03/10/2009 TESTES A VAZIO Conhecer o perfil térmico e qualidade do esterilizador Determinar o “ponto frio” Comparar os resultados obtidos com a norma Gerson R. Luqueta Eng. Gerson R. Luqueta TESTES A VAZIO Gerson R. Luqueta Eng. Gerson R. Luqueta 14 03/10/2009 Gerson R. Luqueta Eng. Gerson R. Luqueta TESTES EM VAZIO Critério – NBRNBR-ISO 11.134 Temperatura deve ficar na faixa de até 3K acima do mínimo Diferença entre pontos não deve ser maior que ± 2K O mesmo ponto não deve flutuar fora da faixa de ± 1K Nota: Os anexos A, B e C da NBR ISO 11134:2001 são de caráter informativo Gerson R. Luqueta Eng. Gerson R. Luqueta 15 03/10/2009 Validação de processo Variação na esterilização - ciclo 3 136,5 136 S 01 S 02 Tem peratura (°C ) 135,5 S 03 S 04 135 S 05 S 07 134,5 S 08 S 09 S 10 134 S 11 S 12 133,5 00 00 00 00 00 00 11 :4 5: 11 :4 4: 11 :4 3: 11 :4 2: 11 :4 1: 00 11 :3 9: 11 :4 0: 00 00 11 :3 8: 00 00 11 :3 7: 11 :3 6: 00 00 11 :3 5: 11 :3 4: 11 :3 3: 00 00 11 :3 2: 00 11 :3 1: 11 :3 0: 11 :2 9: 28 133 Hora Gerson R. Luqueta Eng. Gerson R. Luqueta TESTES EM VAZIO – caso 1 126 125 Temperatura (C) 124 123 122 121 120 1 2 3 4 5 6 7 8 9 10 Tempo Gerson R. Luqueta Eng. Gerson R. Luqueta 16 03/10/2009 TESTES EM VAZIO – caso 2 126 125 Temperatura (C) 124 123 122 121 120 1 2 3 4 5 6 7 8 9 10 Tempo Gerson R. Luqueta Eng. Gerson R. Luqueta TESTES EM VAZIO – caso 3 126 125 Temperatura (C) 124 123 122 121 120 1 2 3 4 5 6 7 8 9 10 Tempo Gerson R. Luqueta Eng. Gerson R. Luqueta 17 03/10/2009 LETALIDADE DO PROCESSO Cinética de inativação do MO alvo – modelo linear Determinação do microorganismo a ser utilizado Determinação da população inicial Determinação do valor D Cálculo da letalidade mínima esperada (Valor F) Determinação do tempo equivalente de processo Gerson R. Luqueta Eng. Gerson R. Luqueta SENSORES NA CARGA Gerson R. Luqueta Eng. Gerson R. Luqueta 18 03/10/2009 SENSORES NA CARGA Estudo de penetração de carga - análise 45 40 MinALeth S 01 S 02 35 S 03 S 05 S 06 30 S 07 S 08 25 20 15 10 5 0 Hora Gerson R. Luqueta Eng. Gerson R. Luqueta Elaboração do POP Deve passar, de forma clara, a informação Deve ser fixado na frente do equipamento Todos devem ser treinados e participar da elaboração. Exemplo de POP Gerson R. Luqueta Eng. Gerson R. Luqueta 19 03/10/2009 MANUTENÇÃO DE EQUIPAMENTOS Orientações Gerais para Central de Esterilização – MS –2001 Item 2.2.4: Realizar manutenções corretivas e/ou preventivas nos equipamentos de forma a montar o histórico dos mesmos. Nos casos de manutenção preventiva, o setor de engenharia clínica deve manter registros de suas realizações (cronograma e check-list) bem como controlar sua periodicidade Gerson R. Luqueta Eng. Gerson R. Luqueta Manutenção mal sucedida ? Gerson R. Luqueta Eng. Gerson R. Luqueta 20 03/10/2009 TENDÊNCIAS Estreitamento da faixa de temperatura Liberação multiparamétrica por instrumentação Consiste na liberação da carga pela comparação de: Critérios físicos x biológicos Executado pelo próprio esterilizador Monitoração exclusiva por indicadores multiparamétricos Gerson R. Luqueta Eng. Gerson R. Luqueta CONCLUSÕES Validação – Determinação dos aspectos técnicos e econômicos Baseado em protocolos e metodologias bem definidos Deve incluir : Testes físicos, químicos e biológicos Treinamento de usuários Planos de manutenção corretiva e preventiva Documentação formal de todas as etapas do processo Gerson R. Luqueta Eng. Gerson R. Luqueta 21 03/10/2009 NORMAS NORMAS BRASILEIRAS • NBR ISO 11.816: 2003 - Esterilizadores a vapor grandes – Requisitos • NBR - 8165 :1995 - Estufas Esterilizadoras de Circulação Forçada • NBR - 8166 -1995 - Esterilizadores à gás óxido de etileno e suas misturas • NBR – 12946 - 1993 -Papel grau cirúrgico para embalagem produtos odonto-médico-hospitalares; •NBR ISO-11.134:2001 - Controle de Rotina e Validação da Esterilização por Vapor Gerson R. Luqueta Eng. Gerson R. Luqueta NORMAS NORMAS INTERNACIONAIS • ISO/ANSI 11.140:1997 - Sterilization of health care products Chemical indicators (Parts 1,2,3,4,5 and 6) • ISO/ANSI ST8:1994 - Hospital steam sterilizers • ISO/ANSI 11.134:1993 - Sterilization of health care products equirements for validation and routine control - Industrial moist heat sterilization. Gerson R. Luqueta Eng. Gerson R. Luqueta 22 03/10/2009 Para refletir • Validação é um processo trabalhoso e demanda custo razoável... • O retorno (mensurável e não mensurável) é grande, uma vez que garante a qualidade do processo com o menor custo operacional possível. • Garante a segurança do paciente e dos profissionais envolvidos. Gerson R. Luqueta Eng. Gerson R. Luqueta Nunca se esqueça... • Seu trabalho é em prol da felicidade do teu próximo... • E o único lugar onde o Sucesso vem antes do Trabalho, é no dicionário! Gerson R. Luqueta Eng. Gerson R. Luqueta 23 03/10/2009 OBRIGADO ! www.baumer.com.br Prof. Eng. Gerson Roberto Luqueta [email protected] Para obter esta e outras apresentações visite: www.gerson.110mb.com e clique na área de saúde. Site alternativo: www.gerson.orgfree.com Gerson R. Luqueta Eng. Gerson R. Luqueta 24
Baixar