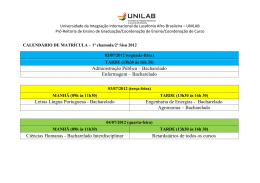
QUÍMICA GERAL Roteiros de Aulas Práticas CEATEC – Faculdade de Química - 2012 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA ÍNDICE Página Conteúdo 3 Informações gerais 4 Experimento 01: conceitos introdutórios, técnicas e desafios 10 Experimento 02: Medidas 16 Experimento 03: Misturas: separação e purificação 20 Experimento 04: Diferenças entre compostos orgânicos e inorgânicos, determinação do teor de umidade no sal de cozinha 24 Experimento 05: Tabela periódica: estudando o grupo II e determinação da massa atômica do cobre 27 Experimento 06: Ponto de fusão e métodos cromatográficos 30 Experimento 07: ocorrência e classificação de reações químicas e sua diferenciação de fenômenos físicos 34 Experimento 08: Dióxido de carbono, investigando a produção da chuva ácida 38 Experimento 09: água potável e água dura 43 Experimento 10: propriedades das cerâmicas 47 Experimento 11: fórmula empírica de um hidrato e princípios do processo fotográfico 51 Experimento 12: ponto de ebulição e destilação 53 Anexo 1: modelo de relatório das atividades práticas 60 Anexo 2: equipamentos básicos de laboratório. 2 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Informações Gerais 1. Objetivos Os experimentos selecionados para esta disciplina visam reforçar conceitos fundamentais da Química, complementando o conteúdo visto na teoria e familiarizando o aluno com novos métodos, técnicas e equipamentos. Além disso, espera-se que o aluno desenvolva e amplie sua capacidade de compreensão de fenômenos, aplicação da metodologia científica, desenvolvimento de modelos e capacidade de relatá-los de maneira crítica, clara e objetiva. 2. Equipes As equipes serão de, no máximo, 3 alunos, e constituídas conforme suas afinidades pessoais. Estas equipes serão mantidas durante todo o semestre letivo, salvo exceções com a concordância do professor. Do mesmo modo, cada equipe deverá ocupar sempre o mesmo local no laboratório, designado na primeira aula. 3. Horários No dia da aula de laboratório, os alunos deverão dirigir-se ao laboratório designado para a sua turma, onde receberão as explicações iniciais sobre o experimento. O aluno que não estiver presente durante esta explicação não poderá realizar a prática. Só será permitida a permanência no laboratório daqueles alunos que obedecerem às regras de segurança estabelecidas pela Engenharia de Segurança do Trabalho para os laboratórios de Química. 4. Critérios de Avaliação No laboratório, os alunos serão avaliados da seguinte maneira: Cada equipe de laboratório deverá entregar um relatório (vide anexo 1) sobre o experimento realizado, quando solicitado pelo professor. Este relatório deverá ser entregue no prazo máximo de duas semanas após o término da prática. Relatórios entregues com atraso poderão até ser corrigidos, mas serão considerados com nota zero para o cálculo da média final. Alunos que não realizaram o experimento não poderão ter o seu nome incluído no relatório correspondente, entregue pelo grupo. 3 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 01 CONCEITOS INTRODUTÓRIOS, TÉCNICAS E DESAFIOS Objetivos: Após completar este experimento, os estudantes deverão ter aprendido: as bases do método científico, o uso do bico de bunsen, as técnicas básicas de trabalhos com vidro, algumas diferenças entre metais e não-metais, a relação entre os elementos e seus compostos. Introdução: A ciência é uma atividade holística, que envolve observação, reflexão e ação. Para aprender e entender ciência, você deve não somente estudá-la, mas também experimentá-la, sendo que para isso é que temos aulas em laboratórios. Neste curso você vai explorar os princípios e técnicas que possibilitam aos químicos investigar o desconhecido, desenvolver teorias e levantar hipóteses. O Método Científico: A análise de muitas descobertas científicas e avanços tecnológicos revela que este processo pode ser dividido em 5 etapas: observação: O primeiro passo é atentar para o universo ao nosso redor. O “quebra-cabeças” que nos cerca leva ao questionamento, que é uma peça chave para a execução da boa ciência. O observador atento não ignora aquilo que não entende, mas faz uma pausa, acompanhada e observação e reflexão, no sentido de desvendar o mistério. hipótese: O próximo passo é desenvolver possíveis respostas ou explicações para as questões que surgiram a partir das observações. experimentos ou testes: Uma das características da ciência, é que normalmente é possível testar experimentalmente as hipóteses e explicações formuladas teoria: Uma hipótese é elevada ao nível de teoria quando experimentos realizados lhe dão suporte e nos possibilitam usar a teoria para propósitos de previsão. modificação: Teorias científicas são sempre objeto de outros testes. Quando obtém-se resultados que aparentemente contradizem uma teoria existente, esta teoria deve então ser modificada, melhorada ou descartada. É importante ter em mente que os cientistas não param e perguntam “em qual etapa eu estou hoje?” As cinco etapas do método científico apresentados, são simplesmente uma estratégia de avaliação dos passos que conduzem as descobertas científicas e/ou progresso tecnológico. Com o passar do tempo e com o constante exercício da ciência você vai passar a considerar todas as etapas de uma maneira conjunta. Por enquanto, no decorrer de nossas aulas, procure usá-las como um referencial para a conduta do raciocínio e atitudes científicas. Lembre-se que aquilo que pode ser muito óbvio, pode esconder importantes considerações científicas. No decorrer desta disciplina procure observar e dedicar atenção a eventos aparentemente simples, como o fato do gelo flutuar sobre a água. Pergunte-se se um sólido é mais ou menos denso do que um líquido, quando ambos são constituídos pela mesma substância e responda, “Por que o gelo flutua na água?” Fique igualmente alerta para o não usual, para o inesperado e para aquilo que aparentemente é inexplicável. Muitas das grandes descobertas foram realizadas porque alguém dedicou tempo para investigar pequenas diferenças entre os resultados esperados e aqueles que realmente foram obtidos. Dentre as grandes descobertas que contaram com a combinação do acaso e de um aguçado espírito investigativo de algum cientista, pode destacar as criações da sacarina e do aspartame, da borracha e do teflon. 4 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Se for necessário, não hesite em dedicar um tempo extra as suas investigações. Contudo, por uma questão de segurança, caso você queira conduzir algum experimento ou variante de experimento que não estejam neste roteiro, consulte antes o seu professor. A QUÍMICA DENTRO DAS CIÊNCIAS: O braço da ciência chamado química é definido em dicionários como “A ciência que ocupa-se da composição, estrutura e propriedades das substâncias e das transformações que estas substâncias podem sofrer.” Na verdade hoje a química desempenha diferentes papéis, ela usa outras ciências como ferramenta e ao mesmo tempo auxilia outras ciências em seus trabalhos investigativos, numa interação onde muitas vezes não existe fronteira entre a química, a física, a biologia, a geologia, a geografia, a medicina, a farmacologia e as engenharias. A cada dia um maior número de substâncias químicas desenvolvidas pelo homem entram no nosso dia a dia. Basta lembrar, que de acordo com uma publicação recente da Pure and Applied Chemistry, a revista da IUPAC (International Union of Pure and Applied Chemistry), o homem possui hoje em seu organismo, em quantidade mensurável, cerca de 500 substâncias que não eram nem conhecidas na segunda década do século XX. Existem ainda substâncias sintéticas em agentes de limpeza, fármacos, chips de computadores, materiais plásticos, aditivos para alimentos e baterias. SUBSTÂNCIAS E MISTURAS: PROPRIEDADES FÍSICAS E QUÍMICAS. O uso da palavra substância, para um químico já implica em alguma coisa pura, daí freqüentemente, para evitar-se confusões, usar-se o termo substância pura. Se mais do que uma substância estão presentes em um mesmo recipiente, tem-se uma mistura. Existem dois tipos de substâncias, as elementares e as compostas, que por sua vez são encontradas nos três estados comuns da matéria, que são o sólido, o líquido e o gasoso, dependendo de combinações de pressão e temperatura. As substâncias compostas são constituídas de elementos quimicamente combinados em razões definidas. Uma questão que merece reflexão é a relação entre as características dos elementos e de seus compostos; p. ex., “As propriedades do sódio e do cloro lembram em alguma coisa as propriedades do cloreto de sódio? Explique” Todas as substâncias têm um conjunto próprio de características físicas e químicas, que nos possibilitam distinguir, identificar e utilizar as substâncias. Propriedades físicas são aquelas que são medidas sem uma mudança química na composição, como ponto de fusão, ponto de ebulição, cor, densidade e solubilidade. As propriedades químicas são aquelas que são determinadas quando ocorre uma mudança na composição ou estrutura da substância, por decomposição ou reação com outros reagentes. Substâncias usualmente ocorrem na natureza junto com outras substâncias, como misturas. Mesmo os reagentes que temos estocados no laboratório contém uma pequena porcentagem de impurezas; mesmo os mais puros contém pelo menos 0,00001% de alguma impureza. Observe sempre e atentamente rótulos e catálogos de produtos químicos para ir familiarizando-se com as impurezas características de cada reagente. Se possível tente relacionar diferentes graus de pureza com preços! Geralmente as misturas podem ser separadas em substâncias puras, antes que o trabalho para a sua efetiva identificação seja iniciado. Os procedimentos usuais para a separação de misturas baseiam-se nas diferenças das propriedades físicas de seus constituintes, como ponto de ebulição (destilação) e solubilidade (recristalização, filtração e cromatografia). A discussão a respeito de misturas e o uso dos procedimentos citados serão objeto de outros experimentos. O trabalho de hoje será centrado na observação qualitativa das propriedades físicas e químicas de muitos elementos e compostos. Um dos mais antigos objetivos dos químicos é entender a matéria e, um dos mecanismos mais usados para este fim, foi o de buscar similaridades entre os elementos bem como maneiras de classificá-los. Para este fim foi desenvolvida a Tabela Periódica dos Elementos, que é uma maneira extremamente útil de arranjo dos elementos e que 5 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA nos permite prever suas propriedades. Parte do experimento de hoje irá propiciar uma breve introdução à Tabela Periódica. Uma cópia da tabela está disponível no início desta apostila; observe-a para acompanhar a discussão. Imagine uma linha com perfil de escada (apresentada em algumas Tabelas Periódicas), que começa com um segmento horizontal entre o Boro (B) e o Alumínio (Al) e termina com um segmento vertical entre o Polônio (Po) e o Astato (At). Esta linha separa os metais dos não-metais ou ametais, sendo que alguns elementos adjacentes a esta linha são chamados de semi-metais ou metalóides. A Tabela 1 compara algumas das propriedades físicas dos metais e dos nãometais. TABELA 1 – Propriedades físicas dos metais e não-metais. Propriedade Metal Não-metal Aparência brilhante não brilhante maleabilidade alta baixa Ductibilidade alta baixa condutividade elétrica alta baixa (isolantes) condutividade térmica alta baixa energia de ionização relativamente baixa relativamente alta eletronegatividade relativamente baixa relativamente alta estado físico (T ambiente) sólido (exceto Hg) 10 gases, 1 líquido, 10 sólidos Além das propriedades físicas, você irá observar as propriedades químicas de alguns elementos e compostos. As reações químicas são normalmente detectadas quando um dos seguintes indicadores é observado: formação de um produto insolúvel (precipitado), evolução de um gás (bolhas), mudança de temperatura ou cor. Procedimento Experimental: A. MATERIAIS E EQUIPAMENTOS DE USO COMUM EM LABORATÓRIOS: Observar os materiais e equipamentos dispostos no laboratório, bem como a aplicação de cada um, conforme apresentado pelo professor. B. OBSERVAÇÃO DE UMA REAÇÃO QUÍMICA O biodiesel é um biocombustível obtido através da transesterificação (uma reação orgânica na qual um éster é transformado em outro através da troca dos grupos alcóxidos) dos triglicerídeos de óleos e gorduras de origem vegetal ou animal com um mono-álcool de cadeia curta, tipicamente metanol ou etanol, na presença de um catalisador, produzindo uma mistura de ésteres alquílicos de ácidos graxos e glicerol (Figura 1). O O O C R1 H2C O H C O C H2C R1 O C OH + + 3 CH3OH R2 C CH3 + R3 O H2 C O catalisador R2 C CH3 + HC OH H2C OH O R3 C CH3 Óleo de soja (Triglicerídeo) Glicerol Mistura de ésteres (Biodiesel) Figura 1- Esquema representativo da reação de transesterificação (na síntese de biodiesel). 6 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Neste experimento vamos observar uma reação química entre um óleo vegetal e o álcool (metanol) avaliando visualmente a transformação dos reagentes em produtos. O METANOL é um líquido VOLÁTIL, INFLAMÁVEL e TÓXICO, por isso deve ser manipulado na CAPELA e com PÊRA de sucção. Em um Erlenmeyer de 125 mL (seco) adicionar 7,5 mL de metanol e 0,25 g de KOH (hidróxido de potássio). Adicionar uma barra de agitação magnética e cubrir com papel alumínio. (ATENÇÃO: Alguns agitadores também aquecem. Desligue o aquecimento.) Após a completa dissolução do KOH no metanol, interrompa a agitação e adicione 25,0 g de óleo de soja ao frasco. Anote suas observações. Cubra novamente a boca do erlenmeyer com papel alumínio. Agite a mistura moderadamente por 30 min. Anote os tempos de mudanças de coloração e homogeneidade da mistura durante a reação. Transfira o conteúdo do erlenmeyer para uma proveta de 100 mL (identifique a proveta com as iniciais de cada aluno da equipe. Acompanhe a separação de fases até o final desta aula, voltando a observar na aula seguinte.1 C. O BICO DE BUNSEN E TRABALHOS COM VIDRO: Acompanhe a demonstração do professor, referente ao uso do Bico de Bunsen e manuseio dos seus controles. Para verificar as diferenças de temperatura no interior da chama, utilize um palito de fósforo queimado, que deve ser introduzido perpendicularmente na chama. A seguir acompanhe a demonstração do professor a respeito do trabalho com vidros e então prepare as peças mostradas na Figura 1.1. FIGURA 1.1 – Peças que deverão ser preparadas com auxílio do Bico de Bunsen. 1 Este experimento foi baseado no trabalho de Rinaldi, R.; Garcia; C.; Marciniuk, L. L.; Rossi, A. V.; Schuchardt, U. (2007) SÍNTESE DE BIODIESEL: UMA PROPOSTA CONTEXTUALIZADA DE EXPERIMENTO PARA LABORATÓRIO DE QUÍMICA GERAL Quim. Nova, Vol. 30, No. 5, 1374-1380. 7 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Existem dois ajustes no Bico de Bunsen, conforme mostra a Figura 1.2. O primeiro é uma válvula agulha, localizada na parte inferior ou lateral do equipamento, que controla a vazão do gás. O segundo consiste em um anel rotatório provido de aberturas e que controla a entrada de ar atmosférico. Quando as aberturas estão completamente fechadas, é observada uma chama amarela, chamada de chama luminosa. Se o anel for posicionado de modo a se obter a máxima abertura, a chama se apaga. Quando o Bico de Bunsen é ajustado corretamente a chama é totalmente azul e não luminosa. Para acendê-lo é necessário fechar totalmente as janelas, abrir a válvula do gás e só então aproximar a fonte de ignição (palito de fósforo aceso, isqueiro ou acendedor). Quando a chama amarela for observada, o anel rotatório deverá ser girado cuidadosamente até a obtenção da chama azul. Explique qual a função do gás e do ar atmosférico. Porque a chama é amarela quando as aberturas estão fechadas e azul quando temos um suprimento de ar atmosférico? FIGURA 1.2 – Bico de Bunsen D. OBSERVAÇÕES E MÉTODO CIENTÍFICO: O menisco: Adicione água até a metade de um cilindro graduado de 50 ml (proveta) e observe o formato da superfície da água. Descreva e desenhe a sua observação. O fenômeno que você observa é chamado de menisco. Os frascos volumétricos são calibrados para propiciar um volume correto quando a leitura é feita na linha da parte inferior do menisco. Qual a razão para o fenômeno observado? Tente relacionar o fato com as propriedades de tensão superficial e interação do líquido com o vidro (mergulhe um tubo de vidro na água e observe o nível do líquido no seu interior). Qual o comportamento esperado se ao invés de água tivéssemos mercúrio? E. PROPRIEDADES FÍSICAS DAS SUSBSTÂNCIAS: 1. Sólidos, Líquidos e Gases: Coloque pequenos pedaços de gelo em um béquer de 250 mL e, em um segundo béquer de 250 mL, adicione 100 mL de água. Compare algumas propriedades facilmente observáveis da água no estado liquido e sólido. Misture o conteúdo dos dois béqueres e aqueça com o Bico de Bunsen sobre uma tela de amianto suportada em um tripé. Explique a origem das bolhas que você observa. Se a água fosse aquecida até que todo o líquido evaporasse seria possível calcular o volume ocupado pelo vapor? 2. Mobilidade molecular em líquidos: Em um béquer de 150 mL, adicione 100 mL de água em ebulição (use luvas de amianto para não queimar as mãos!). A um 8 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA segundo béquer idêntico, adicione 100 mL de água de torneira. Cuidadosamente, adicione a cada um dos béqueres, da mesma maneira, algumas gotas de corante e anote as suas observações. Explicar. 3. Compostos e misturas: Um composto consiste de elementos combinados quimicamente em razões específicas. Compostos podem ser quebrados por meios químicos e resultar em novos compostos ou elementos. Diga qual foi a quebra de composto químico que você já realizou neste experimento. Diferentemente dos compostos, as misturas têm composição variável. Diferentes quantidades de sal podem ser dissolvidas em água, para forma soluções com diferentes quantidades de sal em solução. Ao contrário dos compostos, as misturas podem ser separadas em substâncias usando meios físicos. Neste procedimento, você fará algumas observações a respeito de soluções de sulfato de cobre e da dependência da solubilidade deste em função da temperatura. Adicione cerca de 100 mL de água em um béquer de 250 mL. Aqueça o béquer utilizando um Bico de Bunsen. Lembre-se que o aquecimento não deve ser direto e que você deve empregar a tela de amianto e o tripé. Enquanto você espera que a água aqueça, adicione cerca de 0,1 g de sulfato de cobre pentahidratado (CuSO4.5H2O) a cerca de 5 mL de água contidos em um tubo de ensaio. Peça auxílio ao professor para utilizar a balança. Agite até total dissolução e observe a cor e sua intensidade. Adicione mais 1g de CuSO4.5H2O e repita o processo de dissolução. Adicione então mais 2,5 de CuSO4.5H2O e tente repetir o processo; caso você tenha dificuldade para obter a total dissolução do sal, coloque o tubo dentro do béquer e auxilie a dissolução com um bastão de vidro. Retorne o tubo a uma estante de tubos de ensaio e deixe-o retornar a temperatura ambiente. Se nada ocorrer, mergulhe um bastão de vidro na solução e raspe o interior do tubo com um bastão de vidro. Anote as suas observações. QUESTÕES: 1. Como você explica uma combustão? 2. Porque a janela do Bico de Bunsen deve ficar aberta durante o seu uso? 3. O que é GLP e qual a sua composição básica? 4. Por que, quando o Bico de Bunsen está aceso e com a janela fechada a chama fica amarela e há produção de fuligem? 5. Qual a composição aproximada do ar atmosférico? 6. Qual a diferença entre vidro comum e vidro pirex? 7. Quais foram suas observações e conclusões sobre a reção química realizada no ítem B? 8. Qual a função do aquecimento e da raspagem no interior do tubo no procedimento D3? 9 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 02 MEDIDAS Objetivos: Após completar este experimento, os estudantes deverão ter aprendido: a usar e fazer leituras em termômetros, balanças, provetas e pipetas, os significados dos termos exatidão e precisão, a avaliar a exatidão e precisão de instrumentos. Também deverão ter aprendido conceitos de densidade, massa e volume, a determinar densidades de líquidos e sólidos, a construir alguns tipos de gráficos, a aplicar métodos científicos. Introdução: Em todas as ciências as medidas são essenciais. As propriedades mais fundamentais que podem ser medidas são comprimento, massa e tempo. Em química, a temperatura é freqüentemente tratada como uma propriedade fundamental. Outras propriedades da matéria, como volume, densidade ou velocidade são razões ou produtos das propriedades fundamentais; basta verificar que: 1. Unidades de volume são comprimento3. 2. Unidades de densidade são massa/volume ou, massa/comprimento3. 3. Unidades de velocidade são comprimento/tempo. Em ciência nós usamos o Sistema Internacional (SI) de medidas, sendo que nossas unidades básicas são o metro, o quilograma e o segundo. No entanto, o metro e o quilograma são unidades muito grandes, sendo comum fracioná-las em múltiplos de 10. Assim temos: pico trilionésimo 10-12 nano bilionésimo 10-9 micro milionésimo 10-6 mili milésimo 10-3 centi centésimo 10-2 deci décimo 10-1 kilo mil 103 mega milhão 106 Desse modo, um centímetro é um centésimo de um metro, um quilograma contém mil gramas e um mililitro é um milésimo de um litro. Experimentos científicos não são inteiramente livres de erros. Erros podem ser resultantes de limitações dos equipamentos, ou então falta de habilidade de quem os utiliza. É extremamente raro que um resultado experimental seja exatamente aquele que foi previsto teoricamente; portanto é muito provável que vários erros sejam observados neste experimento, bem como em todos os outros. Faz parte do nosso amadurecimento científico explicá-los e assim conseguir prevê-los e minimizá-los. A medida do quão próximo um resultado experimental está do valor verdadeiro (previsto teoricamente) é chamada de exatidão. Como os erros são inevitáveis (podem apenas ser minimizados), é comum realizar-se uma medida várias vezes e utilizar o resultado médio. A média é normalmente mais exata do que um resultado individual. Se os resultados de várias repetições de uma mesma medida são muito próximos um do outro, diz-se que a medição apresenta precisão. Se além dos resultados serem muito próximos um do outro, estiverem também próximos do valor verdadeiro, teremos gerado experimentalmente um resultado exato e preciso. Alguns tipos de equipamentos são mais exatos e/ou precisos do que outros. A densidade de uma substância é definida como a massa dividida pelo volume: d = m/v. 1,00 mL de mercúrio tem uma massa de 13,6 g, ou seja, a sua densidade é igual a 13,6 g mL-1. Como uma substância pura, a uma dada temperatura e pressão, tem uma densidade fixa, o valor da densidade pode ser utilizado para identificar uma substância. Assim a densidade de 13,6 g mL-1 para um líquido, é uma forte evidência de que este 10 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA líquido é mercúrio. A densidade é também um bom parâmetro para calcular o volume que ocupará uma determinada massa de substância. Por exemplo, calcule a massa de mercúrio que você poderia colocar em um copo de requeijão vazio, sabendo que o volume desse copo é de 250 mL. PROCEDIMENTO: PARTE I A. MEDIDAS DE TEMPERATURA 1. Usando um termômetro, determine a temperatura de uma amostra de água de torneira. Certifique-se que: a) O mercúrio ou álcool na coluna do termômetro não esteja em movimento. b) O bulbo do termômetro esteja totalmente em contato com a água e também que não esteja tocando as paredes de vidro do béquer. c) Que você tenha estimado corretamente a leitura. Explique as razões da necessidade dos cuidados “a” e “b”. Qual a vantagem de um termômetro que utiliza álcool como indicador, em relação a outro que utiliza Hg? 2. Aqueça aproximadamente 100 mL de água em um béquer de 250 mL até a ebulição e meça a temperatura da água em seu ponto de ebulição. 3. Efeito do NaCl sobre a temperatura de fusão da água: a) Faça, em um béquer de 250 mL, uma mistura contendo aproximadamente 50% de gelo e 50% de água. b) Meça a temperatura da mistura até que o sistema atinja o equilíbrio (antes de todo o gelo derreter). c) Adicione cerca de 5g de cloreto de sódio à mistura de gelo e água e agite. Meça a temperatura. Aguardar 5 min e medir novamente a temperatura. B. MEDIDAS DE MASSA 1. Pese os objetos que você tem disponível na bancada. Antes de pesá-los, pegueos e tente estimar a sua massa. Repita as pesagens na mesma balança, de modo a verificar se a gordura e umidade que suas mãos depositam nos objetos causa alguma alteração. Repita agora as pesagens em outra balança, para avaliar se estas apresentam erros. 2. Pese um pequeno béquer. Adicione ao béquer 20 gotas de água, utilizando um conta gotas. Tente estimar a massa e o volume de cada gota. Parta do princípio de que 1 mL de água pesa 1 grama. C. VOLUME, EXATIDÃO E PRECISÃO: Neste item, iremos comparar os resultados de medições de volumes utilizando uma pipeta volumétrica e uma proveta. Pese um béquer seco de 250 mL e anote sua massa (a). Adicione a ele 10 mL de água destilada, medido em uma proveta e anote a massa obtida (b). Adicione mais 2 alíquotas de 10 mL de água destilada, anotando a massa após cada adição (c,d). Seque o béquer e repita as pesagens, utilizando agora uma pipeta volumétrica de 10 mL. Com os seu dados complete a Tabela 2.1 a seguir apresentada. TABELA 2.1 – Comparação entre medições de volume utilizando proveta e pipeta volumétrica. proveta (g) pipeta (g) a. massa inicial do béquer (antes das adições) ___________ __________ b. Depois da primeira adição ___________ ___________ 11 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA c. Depois da segunda adição ___________ ___________ d. Depois da terceira adição ___________ ___________ e. Massa da primeira adição de 10 mL (b-a) ___________ ___________ f. Massa da segunda adição de 10 mL (c-b) ___________ ___________ g. Massa da terceira adição de 10 mL (d-c) ___________ ___________ h. Massa média ___________ ___________ i. Desvio da primeira medida em relação à média (h-e) ___________ ___________ j. Desvio da segunda medida em relação à média (h-f) ___________ ___________ k. Desvio da terceira medida em relação à média (h-g) ___________ ___________ l. Média dos desvios ___________ ___________ PARTE II D. DENSIDADE DE LÍQUIDOS: Nesta primeira parte você irá determinar a densidade de líquidos por diferentes métodos. D.1: Neste procedimento você vai medir volumes e massas e então calcular as densidades. 1. Pese uma proveta limpa e seca 2. Adicione a proveta, exatamente 10,0 mL de álcool etílico (lembre-se de ler corretamente o menisco). Para facilitar o trabalho, você pode adicionar ~ 9 mL e completar até 10 mL com o auxílio de um conta gotas. 3. Pese a proveta mais os 10,0 mL de álcool etílico e calcule a densidade. 4. Adicione álcool etílico até a marca de 30,0 mL e pese. 5. Adicione álcool etílico até a marca de 50,0 mL e pese. 6. Calcule a densidade do álcool etílico nos três casos. 7. Repita o procedimento utilizando água. 8. Lembre-se de medir a temperatura da água, pois a densidade varia quando ocorrem mudanças de temperatura. Você saberia explicar porque? 9. Você acredita que as temperaturas do álcool e da água são as mesmas? Tentar descobrir uma eventual diferença de temperatura por meio da sensibilidade da pele aos dois líquidos. Seria um teste cientificamente adequado? D.2: Neste procedimento você deverá utilizar um equipamento chamado de densímetro, para medir diretamente as densidades. Existem densímetros com diferentes escalas. Os densímetros sempre se prestam a medir densidades em determinadas faixas de valores, o que torna muito importante a escolha da escala correta. Para a aula estarão disponíveis densímetros que operam nas faixas: 0,700 a 1,000 g mL-1; 1,000 a 1,500 g mL-1 e 1,500 a 2,000 g mL-1. Você saberia dizer qual deles é o mais apropriado para medir a densidade da água? Neste procedimento você medirá a densidade da água, do álcool etílico e do óleo comestível. Esteja sempre certo de você está utilizando provetas e densímetros limpos e secos. 1. Observe atentamente o densímetro e calcule os valores de cada divisão de sua escala. 2. Coloque água em uma proveta de 250 mL, introduza cuidadosamente o densímetro até a sua extremidade estar próxima ao fundo da proveta, confira-lhe um leve movimento giratório e solte-o. Deixe o densímetro flutuar no líquido, sem que encoste nas paredes da proveta. Leia a densidade no ponto em que a escala do densímetro coincide com o menisco do líquido. 3. Repita o procedimento com o álcool etílico. 12 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 4. Repita o procedimento com o óleo comestível. D.3: Neste procedimento você irá medir a densidades utilizando um equipamento chamado de picnômetro. Os picnômetros são pequenos balões volumétricos empregados Para pesar e medir o volume de líquidos. Com a massa e o volume podemos calcular a densidade. Os picnômetros possuem um pequeno orifício em sua tampa. Esse orifício dispensa o acerto do menisco, pois o líquido deve transbordar por ele, ficando o picnômetro totalmente cheio. 1. Anote o volume do picnômetro. 2. Pese cuidadosamente o picnômetro vazio. 3. Encha-o até a boca com álcool. 4. Coloque a tampa no picnômetro e enxugue o líquido que transbordar. 5. Anote a massa do conjunto picnômetro mais líquido. 6. Calcule a densidade 7. Repita o mesmo procedimento utilizando água. E. DENSIDADE DE SÓLIDOS: Neste procedimento você irá determinar a densidade do Ferro, do Cobre e de um pedaço de madeira. E.1: Metais 1. 2. 3. 4. 5. 6. 7. Pese um prego e anote a massa. Certifique-se de que o prego está seco. Coloque 40 mL de água em uma proveta de 50mL Mergulhe o prego e meça o deslocamento do volume. Calcule a densidade. Repita este procedimento mais duas vezes, com pregos diferentes. Calcule a amplitude das densidades encontradas. Agora pese 10 pregos e anote a massa. Certifique-se de que todos os pregos estejam secos. 8. Coloque 40 mL de água em uma proveta de 50mL 9. Mergulhe os pregos e meça o deslocamento do volume. 10. Calcule a densidade. 11. Repita este procedimento mais duas vezes, com diferentes conjuntos de 10 pregos diferentes. 12. Calcule a amplitude das densidades encontradas. Qual procedimento é mais preciso, o que envolve a pesagem de um único prego ou o que envolve a pesagem de 10 pregos? Discuta a sua resposta. 13. Repita os itens de 1 a 12 utilizando pedaços de cobre. Sabendo que a densidade do cobre é de 8,92 g cm3, qual procedimento é mais exato, o que envolve a pesagem de um único fio de cobre ou o que envolve a pesagem de 10 fios de cobre? Discuta a sua resposta. E.2: Madeira 1. Escreva um procedimento para a determinação da densidade de um pedaço de madeira disponível no laboratório e execute-o. F. DENSIDADE DE SOLUÇÕES SALINAS: Uma solução salina tem uma densidade que aumenta à medida que mais sal é dissolvido nesta solução. As densidades de várias soluções de cloreto de sódio são apresentadas a seguir na Tabela 2.1 TABELA 2.1 – Densidades de soluções aquosas com diferentes teores de NaCl %(m/V) NaCl densidade (g.mL-1) 0,0 0,998 5,0 1,034 13 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 10,0 1,071 15,0 1,108 20,0 1,148 25,0 1,189 Com os dados apresentado na Tabela 2.1 acima, construa um gráfico, lançando os valores de concentração no eixo “x” e densidades no eixo “y”. Agora, meça a densidade de uma solução de NaCl, que apresenta uma concentração desconhecida e determine, através de interpolação no gráfico que você construiu, a concentração (m/V) da solução problema. Utilize para este fim, o procedimento que julgar mais adequado. QUESTÕES: 1. Sabendo que a densidade do álcool etílico é 0,80 g mL-1, responda: 14 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA a. Se 15 gotas de etanol pesam 0,60 g, quantas gotas são necessárias para dispensar 1g? b. Qual o volume em mililitros de uma gota de etanol? E em microlitros? 2. A massa de um peso padrão, é de 3,500 g. Esta massa é medida em triplicata em 2 diferentes balanças, tendo sido obtidos os resultados: Pesagem 1 2 3 Balança 1 (g) 3,53 3,55 3,51 Balança 2 (g) 3,37 3,45 3,47 a. Qual é a balança mais precisa? Explique. b. Qual é a balança mais exata? Explique. 3. Quais as temperaturas que você observou no item “A” do procedimento? Como age o sal sobre o ponto de fusão do água? 4. Explique a razão pela qual os países frios jogam sal na neve quando esta causa obstrução de ruas. Você vê algum problema ambiental no procedimento que tais países adotam? 5. Quais as massas que você observou para os objetos pesados? Qual a sua opinião sobre a exatidão e precisão das balanças utilizadas? 6. Qual instrumento é mais preciso, a proveta ou a pipeta volumétrica? Explique a sua resposta. 7. Sabendo que massa de 10 mL de água a 250C é de 9,960g, qual dos instrumentos utilizados é o mais exato, a proveta ou a pipeta volumétrica? 8. Suponha que a uma proveta de massa igual a 89,22g foram adicionados 25,0 mL de etanol. A proveta, agora com o etanol, passou a pesar 108,95g. Qual a densidade do etanol? 9. Uma peça cilíndrica de titânio, que pesa 101,93g, tem um diâmetro de 1.84 cm e uma altura de 8,50 cm. Qual a densidade do titânio? 10. Suponha que você vai comprar uma barra de ouro, que pesa 1000g. O vendedor garante-lhe que se trata de ouro com pureza mínima de 99,9999%. Porém você suspeita que pode tratar-se de uma liga contendo cobre. Ao medir a barra, você descobre que ela tem dimensões de 4,893cm X 4,893cm X 2,501cm. Qual a sua conclusão? 11. Imagine que você tem em sua bancada duas provetas de 250mL, a primeira contendo 200 mL de Hg e a segunda contendo 200 mL de água. Em qual proveta um determinado densímetro teria uma maior porção submersa? Explique a sua resposta. 12. Você acha que seria interessante realizar experimentalmente o teste sugerido na questão 4? Quais seriam os prós e contras? 13. Se 1 litro de óleo comestível e 1quilograma do mesmo óleo custassem o mesmo preço, seria mais vantajoso comprar um 1 L ou 1kg? 14. Por que o óleo flutua na água? 15. Quais os erros mais comuns que podem ser cometidos no uso de um picnômetro? 16. Por que o ferro afunda na água? 17. A água quente é mais densa ou menos densa do que a água fria? Explique. 18. A água do mar tem densidade maior, menor ou igual a da água destilada? Explique. 15 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 03 MISTURAS: SEPARAÇÃO E PURIFICAÇÃO Objetivos: após completar este experimento, os estudantes deverão ter aprendido algumas diferenças entre substâncias e misturas, a terminologia de soluções, a separar misturas usando filtrações a vácuo e por gravidade, a purificar sólidos utilizando recristalização, a determinar concentrações de soluções por pesagem, evaporação e nova pesagem, o efeito da temperatura sobre a solubilidade de compostos orgânicos. Introdução: Existem dois tipos de substâncias: as elementares e as compostas. Quando duas ou mais substâncias são quimicamente combinadas, tem-se uma mistura. Se dissolver açúcar em água, tem-se uma mistura homogênea, que também pode ser chamada de solução homogênea. Muitas das soluções com as quais nos deparamos no nosso dia a dia, são constituídas predominantemente de água. Ao contrário de uma solução de açúcar em água, um suco de laranja apresenta partículas perceptíveis, o que faz com que a mistura não seja a mesma em todos os pontos, tornando-a, assim, uma mistura heterogênea. A quantidade de cloreto de sódio dissolvida em uma solução saturada pode ser determinada por evaporação até a secura, de uma massa conhecida de solução. A secagem total é confirmada por repetidas secagens, seguidas de pesagem até que a massa fique constante, evidenciando assim a ausência de água para ser evaporada. Procedimento: PARTE I A. Preparação de uma solução de NaCl (utilizando soluto sólido) Parte A: Preparo de uma solução a partir de soluto sólido. Preparar 100 cm3 (200 mL) de uma solução de NaCl com concentração em quantidade de matéria de 0,1 mol.L-1 (0,1 M). 1. Calcular a quantidade de matéria do soluto nos 100 cm3 (= 100 mL = 0,1 L). 2. Calcular a quantidade necessária de massa do soluto n = m / MM onde: n = nº de mols; m = massa do soluto (g); MM=massa molécula (g.mol-1) 3. Pesada a massa calculada, dissolve-se em aproximadamente 50 mL de água destilada, e completa-se com a técnica recomendada o volume até 100 cm3 (100 mL). Cuidado na leitura do menisco. 4. Calcula-se a concentração em massa (g.L-1). B. EVAPORAÇÃO: 1. Pese uma cápsula de porcelana limpa e previamente seca a 105 oC. 2. Com uma pipeta, transfira 5 mL da solução de cloreto de sódio previamente preparada na cápsula de porcelana e pese novamente o conjunto. 3. Coloque água até aproximadamente a metade de um béquer de 250 mL, e coloque-o para aquecer, utilizando para isto um suporte universal, uma argola de aço (ou um tripé), uma tela de amianto e um Bico de Bunsen. Faça uma montagem conforme mostra a Figura 3.1. Sobre o béquer, mantenha a cápsula de porcelana, de modo que o vapor gerado evapore a água da solução de cloreto de sódio. 16 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA FIGURA 3.1 – Sistema para evaporação da solução de cloreto de sódio. 4. Quando toda a água da cápsula tiver evaporado, retire a cápsula do béquer, seque-a totalmente, deixe esfriar e pese. 5. Repita o procedimento descrito no item 4, para certificar-se da pesagem (é aconselhável uma variação de massa entre uma pesagem e outra inferior a 0,02g). Calcule o teor percentual de NaCl na mistura. B. FILTRAÇÃO: 1. Dobre um papel de filtro ao meio. Corte cerca de meio centímetro de um de seus cantos e então o dobre em quatro. Pese-o e abra-o de forma a fazer um cone. Coloque-o dentro do funil. Molhe-o com água destilada utilizando uma pisseta, de forma a que o papel fique aderido à parede interna do funil. Execute a montagem conforme ilustra a Figura 3.2. FIGURA 3.2 – Sistema para filtração por gravidade utilizando funil de haste. 2. Coloque 10 mL de uma solução de carbonato de sódio 1 mol L-1 em um béquer de 150 mL. Adicione 10 mL de uma solução de cloreto de cálcio 1 mol L-1. Anote as suas observações. 17 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 3. Agite suavemente a mistura resultante por alguns segundos e filtre metade do produto resultante utilizando filtração por gravidade (Fig. 3.2). A outra metade filtrar a vácuo (Figura 3.3). Compare os dois métodos de filtração e avalie a eficiência. PARTE II C. RECRISTALIZAÇÃO DA VANILINA (4-hidroxi-3-metoxibenzaldeído): Assuma que você trabalha em uma empresa de flavorizantes e que um novo lote de vanilina que está chegando pode conter impurezas. O seu dever nesta semana será o de purificar a vanilina por recristalização. Na Aula 06 você irá avaliar a pureza da vanilina impura, bem como da pura, por meio da verificação do ponto de fusão. Você irá também determinar a porcentagem de recuperação. 1. Pese, em um erlenmeyer de 125 mL ou de 250 mL, cerca de 2 g da vanilina. 2. Adicione cerca de 50 mL de água ao frasco e agite vigorosamente 3. Usando um Bico de Bunsen, aqueça a solução até a sua ebulição e agite-a. 4. Coloque agora o erlenmeyer em um banho de gelo e agite-o ocasionalmente. 5. Coloque um papel de filtro, de tamanho adequado, no funil de Buchner. Certifiquese de que todos os orifícios estão cobertos. Molhe cuidadosamente o papel com água destilada e filtre a vácuo os cristais de vanilina. Lave o erlenmeyer uma ou duas vezes com água gelada, utilizando uma pisseta e use esta água para lavar os cristais no funil. Execute a montagem conforme mostra a Figura 3.3. 6. Transfira os cristais para um pedaço de papel de filtro previamente pesado e coloque-o em um lugar seguro para ser utilizado no experimento 6. FIGURA 3.3 – Sistema para filtração a vácuo, utilizando funil de Buchner. QUESTÕES: 1. Defina os termos: a. evaporação b. solução saturada c. solução insaturada d. solução homogênea e. solução heterogênea 2. 8,5 mL de água de mar foram adicionados a uma cápsula de porcelana com massa igual a 44,317. Após a adição, o conjunto passou a pesar 52,987 g. Depois da 18 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA evaporação, a cápsula e seu conteúdo pesaram 44,599 g. Qual a porcentagem m/V de sal na amostra? 3. A recristalização de 1,75 g de uma amostra de aspirina rendeu 1,50 g de aspirina. Qual a porcentagem de recuperação observada? 4. Qual é o melhor indicador de que uma solução está saturada? 5. Por que você repete o ciclo de aquecimento, resfriamento e pesagem até a obtenção de uma massa constante? 6. O que você observou quando misturou as soluções de carbonato de sódio e a de cloreto de sódio? 7. Por que se utilizou um procedimento de filtração por gravidade e não de evaporação? 8. Edifícios e estátuas contêm uma quantidade significativa de carbonatos. Com base em sua experiência, diga qual é o efeito das chuvas ácidas sobre tais estruturas. 9. Por que a solução de vanilina é resfriada antes da filtração a vácuo? 10. Como que o procedimento de recristalização remove as impurezas que são solúveis no solvente? 11. Que etapa adicional poderia ser adicionada ao procedimento para remover impurezas insolúveis no solvente? 12. Tanto as filtrações a vácuo, quanto a filtração por gravidade são utilizadas para separar sólidos insolúveis da fase aquosa. Sugira critérios para escolher um ou outro método. 19 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 04 (Parte I) DIFERENÇAS ENTRE COMPOSTOS ORGÂNICOS E INORGÂNICOS Objetivos a serem atingidos: Geral: Diferenciar um composto iônico de um composto molecular. Específicos: - diferenciar os compostos através de ponto de fusão. - diferenciar os compostos através da solubilidade. - diferenciar os compostos através da condutividade elétrica. - diferenciar os compostos através da combustão. Introdução Teórica: Os compostos orgânicos (moleculares) possuem ligações covalentes, enquanto os compostos inorgânicos são formados, em sua maior parte, por ligações iônicas. As forças de atração entre as moléculas orgânicas são as forças de van der Waals, cuja intensidade é fraca. No caso de compostos formados por ligações iônicas, existem também forças de atração Eletrostáticas, que são muito mais fortes do que as de van der Waals. As diferenças nas forças de atração resultam em comportamentos diferentes dos compostos moleculares e iônicos quanto à fusão, solubilidade em água, em solvente orgânico e condutividade elétrica. Além disto, os compostos orgânicos participam de reações de combustão (um tipo de reação química), podendo sofrer combustão completa ou incompleta. Na combustão completa ocorre apenas a formação de CO2 (C CO2), enquanto na combustão incompleta há a formação de coque (carbono puro) e CO (C C + CO). Quando são queimados, os compostos orgânicos liberam água, de acordo com as reações abaixo: R - H + O2 CO2 + H2O - (combustão completa) Ar - H + O2 CO + C + H2O – (combustão incompleta) Materiais e reagentes: 01 Espátula 09 Tubos de ensaio 01 Bico de Bunsen 02 Pipetas graduadas de 5 mL 01 Pêra de borracha 01 Lâmpada com instalação elétrica 01 Bagueta de vidro 02 Copos de béquer 01 Funil de vidro 02 Cápsulas de porcelana Cloreto de sódio P.A. Sacarose P.A. Ácido esteárico P.A. Etanol P.A. Tolueno ou Benzeno P.A. Água de cal ou de barita (solução) Procedimento: 1a. Parte: Diferenças observadas na fusão 1. Acender e regular a chama de um bico de Bunsen. 2. Colocar, com o auxílio de uma espátula, uma pequena quantidade de cloreto de sódio em um tubo de ensaio limpo e seco. 3. Aquecer o tubo de ensaio, lentamente, em chama direta. ATENÇÃO: Para executar esta operação, utilizar uma pinça de madeira para prender o tubo de ensaio. Manter o tubo de ensaio inclinado à cerca de 45o e certificar-se que a boca do tubo de ensaio esteja voltada para uma direção em que não possa ocorrer a projeção de material quente sobre o operador ou um colega. 4. Observar e anotar quais as alterações sofridas pela amostra durante o aquecimento. 5. Repetir as etapas (1) a (4) utilizando sacarose como amostra em um outro tubo de ensaio. 6. Repetir as etapas (1) a (4) utilizando ácido esteárico como amostra em um terceiro tubo de ensaio. 20 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 2a. Parte: Diferenças observadas na solubilidade 1. Numerar 6 tubos de ensaio e colocar, com o auxílio de uma espátula, uma pequena quantidade amostra em cada um dos tubos, de acordo com a lista abaixo. Tubos (1) e (2): cloreto de sódio Tubos (3) e (4): sacarose Tubos (5) e (6): ácido esteárico 2. Adicionar, com o auxílio de uma pipeta graduada, 5 mL de água aos tubos identificados como (1), (3) e (5). Agitar as misturas, observar e anotar as alterações sofridas pelas amostras. 3. Adicionar, com o auxílio de uma pipeta volumétrica graduada, 5 mL de etanol (álcool etílico) aos tubos identificados como (2), (4) e (6). Agitar as misturas, observar e anotar as alterações sofridas pelas amostras. 3a. Parte: Diferenças observadas na condutividade elétrica 1. Preparar, em um copo de béquer, uma solução com 30 mL de água e cerca de 2 g de cloreto de sódio. Agitar, com a bagueta de vidro, até a completa dissolução da amostra. 2. Inserir os pólos de condução elétrica da lâmpada na solução e ligar o conector na tomada. Ver na Figura 4.1, abaixo como deverá ficar a montagem do ensaio. Observar o comportamento da lâmpada e anotar o resultado. 3. Desconectar o conector da tomada e secar os pólos de condução com um papel absorvente. ATENÇÃO: se o conector não for desligado da tomada antes de ser manuseado, existe o risco de choque elétrico. 4. Repetir as etapas (1) a (3), utilizando uma solução preparada com cerca de 2 g de sacarose. Figura 4.1 - Esquema da aparelhagem usada para avaliar a condutividade de soluções de diferentes compostos. 4a. Parte: Diferenças observadas na combustão 1. Em outra cápsula de porcelana limpa e seca, colocar 3 gotas de benzeno(C6H6). 2. Usando um palito de fósforo aceso, inflamar a amostra dentro da capela. ATENÇÃO: executar esta operação cuidadosamente, pois há o risco de queimaduras. 3. Observar o que ocorre e anotar os resultados obtidos. 4. Repetir o procedimento com etanol ou álcool etílico (C2H5OH). 21 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Resultados: Testes de fusão, solubilidade e condutividade elétrica: Amostra Comportamento na fusão Solubilidade em água Solubilidade em etanol Condutividade elétrica da solução aquosa Cloreto de sódio Sacarose Ácido esteárico Testes de combustão: Amostra Comportamento no teste de combustão Etanol Benzeno Algumas questões: 1. Por que os compostos orgânicos fundem em temperaturas mais baixas do que os inorgânicos. Justifique. 2. Por que os compostos inorgânicos comportam-se de maneira diferente em relação aos compostos orgânicos? Justifique. 3. Explique as diferenças dos resultados do teste de solubilidade das amostras em meio aquoso e em meio etanólico e as diferenças observadas nos testes de condutividade. 4. Cite um exemplo do dia-a-dia onde as reações de combustão são empregadas. 5. Com base no teste de combustão, qual a diferença entre o etanol e o tolueno ou benzeno? 6. Liste alguns materiais orgânicos e inorgânicos encontrados em uma residência comum. 22 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 04 (Parte II) DETERMINAÇÃO DO TEOR DE UMIDADE NO SAL DE COZINHA Objetivos a serem atingidos: Geral: Determinar o teor de umidade no sal de cozinha Específicos: - utilizar balanças e estufas. - efetuar um balanço de massas. Introdução: O sal de cozinha, cloreto de sódio ou NaCl, é um composto higroscópico, ou seja, absorve umidade do ar. A umidade no sal pode ser avaliada por meio da pesagem de uma amostra, aquecimento da mesma até peso constante e pesagem final. Um cálculo simples irá apontar a porcentagem de umidade presente na amostra. Materiais e reagentes: 01 cápsula de porcelana 01 espátula 01 estufa 01 dessecador 01 bico de Bunsen 01 balança com legibilidade de pelo menos 0,01g Cloreto de Sódio (sal de cozinha) Procedimento: 1a. Parte: Determinação do teor de umidade no sal de cozinha. 1. Retire, com o auxílio de uma luva de amianto ou de uma tenaz, uma cápsula de porcelana limpa e seca da estufa. ATENÇÃO: Ao manusear objetos quentes há o risco de queimaduras, utilize o equipamento de proteção (luva de amianto). 2. Coloque a cápsula no interior de um dessecador. Coloque a tampa do dessecador sobre o mesmo e ajuste as duas peças, deixando a torneira de ar da tampa semiaberta. Deixe a cápsula esfriar dentro do dessecador. 3. Pese a cápsula, com a exatidão que a balança permitir. ATENÇÃO: Consulte o professor sobre a operação da balança. 4. Coloque cerca de 2 g de sal na cápsula e pese, novamente, a cápsula com exatidão. 5. Coloque a cápsula em uma estufa, com a temperatura previamente ajustada entre 103 e 120ºC, durante 60 minutos. 6. Retire a cápsula da estufa, deixe esfriar em um dessecador. Para tanto, repita as operações dos itens (1) e (2). 7. Após o resfriamento completo, pese novamente a cápsula de porcelana com o sal seco, com o mesmo procedimento do item (3). 8. Calcule, a partir dos valores de massa disponíveis, qual a porcentagem de umidade no sal. Enquanto você aguarda o tempo necessário para a secagem do sal: pense em uma maneira de calcular a umidade do cloreto de sódio, usando os dados que você vai obter nesta aula. Se você conseguir cumprir as etapas propostas, responda as questões abaixo, ainda no laboratório. Algumas questões: 1. Com a porcentagem de umidade no sal que você obteve, calcule quantos gramas de água há em 1 kg de sal. 2. Temos alguma garantia de que a umidade que determinamos é verdadeira. Qual seria a solução para comprovar a veracidade do valor encontrado? 3. Por que secamos a cápsula de porcelana previamente à determinação da umidade? 4. Quais são as fontes de erro envolvidas na determinação da umidade? 23 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA AULA 05 TABELA PERIÓDICA: ESTUDANDO O GRUPO II DETERMINAÇÃO DA MASSA ATÔMICA DO COBRE 1. Introdução teórica O arranjo de vários elementos de uma maneira sistemática, chamada de Tabela Periódica dos Elementos, é geralmente atribuída a Mendeleev. Embora a Tabela Periódica moderna apresente diferenças daquela originalmente proposta por Mendeleev, mantém ainda a idéia inicial de agrupamento de elementos químicos com propriedades similares em uma mesma coluna vertical, que são chamadas de famílias ou grupos. Os elementos magnésio, cálcio, estrôncio e bário pertencem ao grupo II da Tabela Periódica, apresentando configurações eletrônicas similares, o que resulta na semelhança de suas propriedades. Dentre as semelhanças dos elementos do grupo II, pode-se destacar o fato de que todos eles possuem os estados de oxidação 0 e +2. Algumas propriedades dos cátions do grupo II são a seguir apresentadas: Magnésio: Os íons magnésio apresentam-se incolores em soluções. O hidróxido de magnésio é um de seus compostos menos solúveis. A alta solubilidade de muitos compostos de magnésio é atribuída ao pequeno tamanho do íon Mg2+, o que favorece a sua hidratação. Cálcio: O Cálcio é o elemento mais abundante dos metais alcalinos terrosos. Seus compostos menos solúveis são aos carbonatos e oxalatos. Os sais de cálcio dão à chama do bico de Bunsen uma coloração vermelho-tijolo. Estrôncio: O estrôncio como pode se esperar de sua posição na tabela periódica, possui propriedades intermediárias entre o cálcio e o bário. Seus sais dão à chama do bico de Bunsen uma coloração vermelho-carmim. Bário: O bário forma compostos bastante insolúveis com cromato e sulfato. O sais de bário conferem uma coloração verde à chama do bico de Bunsen. Produtos de solubilidade de alguns sais dos elementos do grupo II são apresentados na Tabela 11.1, a seguir, (quanto menor for o valor do produto de solubilidade, menos solúvel será o sal) Existem reações químicas que não envolvem a transferência de elétrons e reações que envolvem tal transferência. Se há transferência de elétrons de um reagente para outro, a reação é denominada de reação de oxi-redução ou reação redox. Uma maneira para avaliar se houve transferência de elétrons consiste na comparação do número de oxidação dos elementos químicos reagentes com o número de oxidação desses mesmos elementos quando produtos. Se o número de oxidação de um elemento químico sofre aumento (p.ex., 0 2; 2 4; -1 0), tem-se um indicador conclusivo de que o elemento em questão perdeu elétrons e, portanto, sofreu oxidação. Como conseqüência, outro elemento deve ter recebido elétrons e teve o seu número de oxidação reduzido (p.ex., 2 0; 0 -1). Muitas reações são facilmente identificáveis como reações de oxi-redução pela presença de um reagente ou produto em sua forma elementar. Um elemento não pode reagir ou ser formado, a menos que elétrons sejam transferidos. Como forma de preparar-se para o experimento que será conduzido nesta aula, visando a determinação experimental da massa atômica do cobre, a partir da reação de 24 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA excesso de CuSO4.5H2O com uma quantidade perfeitamente conhecida de Zn, tente responder em casa ao seguinte questionamento: Zinco metálico reage com uma solução aquosa de íons Ni2+, resultando em íons Zn2+ e níquel metálico. Como você pode explicar tal evento utilizando uma tabela de potenciais padrão de redução? Utilizando a mesma tabela, explique a razão do uso de placas de magnésio com o objetivo de evitar a corrosão generalizada no casco de um navio construído predominantemente com ferro. 2. Materiais e Reagentes: 3. Procedimento Experimental. 3.1. Planejamento: - Antes de começar, leia atentamente todo o procedimento. - Após a leitura de todo o procedimento, construa uma tabela onde possa anotar todas as observações, mostrando o que foi misturado e qual o resultado obtido. 3.2. Execução: a. Utilizando sempre tubos de ensaio limpos, misture cerca de 20 gotas de cada solução de contendo íons do grupo II, com as soluções de ânions disponibilizadas. Anote em sua Tabela o que foi observado. b. Limpe o fio de Níquel-Cromo por meio de sucessivas inserções do mesmo na solução de HCl e exposição à chama. Os cloretos dos metais que podem estar contaminando o fio volatilizam-se na chama. Repita este procedimento quantas vezes for necessário até eliminar do fio, elementos que causam coloração na chama. c. Teste na chama, com auxílio do fio de Ni-Cr, os sais sólidos dos metais do grupo II. Anote as observações em sua Tabela. Limpe o fio após cada teste, seguindo o procedimento já descrito. d. Identifique a solução desconhecido que o professor irá lhe entregar. 3.3 Cobre 1. Pese cerca de 2,5 g de CuSO4.5H2O, triture num gral e transfira tudo para um béquer de 100 mL tarado. Confira a massa de sal de cobre transferida e adicione 10 mL de água destilada. Aqueça e agite até a dissolução completa. 2. Pese com exatidão cerca de 0,100 g de Zn em pó e anote. 25 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 3. Adicione quantitativamente o zinco ao béquer contendo a solução de sulfato de cobre(II). Aqueça com chama fraca, sob leve agitação, até que todo o zinco seja consumido. Antes de prosseguir, escreva a reação química envolvida. 4. Utilizando um papel qualitativo tarado, filtrar em funil de haste curta. Lave com água até que o filtrado fique incolor (não deve haver sólido ou cristais azuis no papel de filtro). Depois lave com álcool e éter etílico (cuidado! são inflamáveis), seque em estufa e pese o cobre metálico formado. 5. Certifique-se de que não existem mais bicos de Bunsen ligados no laboratório e que a válvula principal da tubulação de GLP que alimenta o laboratório foi fechada. 6. Repita todo o procedimento e calcule a média das massas. QUESTÕES 1. O que é um interferente químico? Cite um observado na aula de hoje. 2. Explique o significado dos produtos de solubilidade mostrados na Tabela 5.1. 3. Descreva um procedimento que permitiria determinar experimentalmente um produto de solubilidade. 4. Defina massa atômica. 5. Qual o padrão de referência para as massas atômicas? 6. Explique por que você observa na Tabela Periódica, elementos químicos com indicação de massa atômica fracionária. 7. Qual a função das lavagens efetuadas durante o experimento? 8. Calcule a massa atômica do Cobre. 9. Aponte as fontes de erro deste experimento. 26 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 06 PONTO DE FUSÃO E MÉTODOS CROMATOGRÁFICOS Objetivos: Identificar pontos de fusão usando tubos capilares e curvas de resfriamento, graficar fenômenos não lineares, identificar compostos e determinar suas purezas pelo ponto de fusão, princípios da cromatografia. PROCEDIMENTO: PARTE I A. MÉTODO DO TUBO CAPILAR PARA A DETERMINAÇÃO DO PONTO DE FUSÃO: Monte um aparato igual ao descrito na Figura 6.1, substituindo as argolas por um tripé. Figura 6.1: montagem para determinação de ponto de fusão. 1. Preencha o tubo capilar com a vanilina bruta. 2. Prenda o tubo capilar ao termômetro. 3. Introduza o conjunto em um béquer com glicerina, inicie o aquecimento e faça a determinação do ponto de fusão. 4. Repita o procedimento com a vanilina recristalizada, reduzindo a temperatura do banho de glicerina antes de introduzir a amostra. 5. Repita o procedimento com naftaleno. Valores teóricos: vanilina = 80-81oC, naftaleno = 80,2oC B. MÉTODO DA CURVA DE RESFRIAMENTO PARA A DETERMINAÇÃO DO PONTO DE FUSÃO: 27 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 1. Coloque em um tubo de ensaio uma quantidade tal de naftaleno que cubra o bulbo do termômetro. 2. Insira o termômetro no tubo, de forma a que seu bulbo fique inteiramente coberto. 3. Introduza o tubo contendo o naftaleno e o termômetro em um béquer com glicerina, suportado em um tripé com tela de amianto (ou conforme mostrado na Figura 6.2). 4. Aqueça o sistema até uma temperatura ~10oC acima do ponto de fusão do naftaleno. 5. Remova o tripé, a tela de amianto e o béquer, conforme mostra a Figura 6.2. 6. Anote a temperatura a cada 20 segundos. 7. Graficar temperatura x tempo. Figura 6.2: determinação do ponto de fusão. PARTE II C. CROMATOGRAFIA: Cromatografia em papel: Execute a montagem apresentada na Figura 6.3. 28 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Figura 6.3: cromatografia em papel. 1. Pegue 4 béqueres de 125 mL ou de 250 mL limpos e secos. Ao primeiro, adicione 20 mL de água destilada. Ao segundo, 20 mL de ácido acético 0,2 mol.L-1. Ao terceiro, 20 mL de hidróxido de amônio 0,2 mol.L-1. Ao quarto, 20 mL de etanol. Identifique todos os béqueres. 2. Pegue 4 tiras de papel de filtro com cerca de 3 cm de largura e, utilizando canetas de cores variadas, faça quatro bolinhas, uma de cada cor, em cada uma das tiras, de modo que as bolinhas fiquem cerca de 0,5 cm acima do nível do líquido quando as tiras forem postas nos béqueres. 3. Com o auxílio de uma linha presa na parte superior do béquer, mergulhe uma tira em cada solvente, evitando que se encoste à parede do béquer. 4. Assim que o líquido atingir aproximadamente 90% da altura do papel, retire-o e deixe-o secar. 5. Calcule os fatores de retenção. Cromatografia em coluna 1. Pegue uma bureta de 25 mL. Introduza um pequeno chumaço de algodão e acomodeo próximo à torneira da coluna. 2. Adicione uma suspensão de 2 g de sílica em 10 mL de etanol. Manter a coluna na vertical, presa por garra em suporte universal. 3. Mantenha um excesso de etanol acima do nível da sílica (cerca de 2 cm). Adicione cerca de 0,5 mL da amostra colorida fornecida pelo professor, composta por fluoresceína e azul de metileno. 4. Abra a torneira e mantenha a adição de solvente, de modo a evitar que a coluna de sílica fique seca. 5. Recolha em béquer a fase colorida resultante. Cromatografia em coluna com um giz 1. Pegue 1 béquer de 125 mL limpo e seco. Escolha o solvente (água destilada, ácido acético, hidróxido de amônio ou etanol) e a caneta colorida que forneceram os melhores resultados na cromatografia em papel. 2. Adicione o solvente selecionado ao béquer. 3. Com a caneta escolhida, faça um círculo em torno do giz, em uma altura que fique um pouco acima do nível do solvente dentro do béquer. 4. Posicionar o giz em pé dentro do béquer, de modo a permitir o contato com o solvente. 5. Assim que o líquido atingir aproximadamente 90% da altura do giz, retire-o e observe a separação de cores. 6. Calcule os fatores de retenção. QUESTÕES: 1. O que é ponto de fusão? 2. Comente o resultado experimental do ponto de fusão da vanilina. 3. Explique a razão da técnica cromatográfica de separação possuir este nome. 4. Quantos pigmentos você identificou em cada tinta utilizada. 5. Explique a diferença observada entre os cromatogramas gerados com água e com álcool etílico. 29 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 07 (Parte I) OCORRÊNCIA E CLASSIFICAÇÃO DE REAÇÕES QUÍMICAS E SUA DIFERENCIAÇÃO DE FENÔMENOS FÍSICOS Objetivos: após completar este experimento, os estudantes deverão diferenciar experimentalmente fenômenos físicos de fenômenos químicos e ter aprendido um esquema para classificar reações, a balancear reações químicas, a identificar indicadores de ocorrência de reações. Introdução: Os elementos químicos e as substâncias químicas são passíveis de vários tipos de transformações. Na natureza, por exemplo, muitas vezes participam de ciclos, como o ciclo hidrológico da água, um processo onde a água evapora da superfície do planeta, vai para a atmosfera na forma de vapor, onde se condensa e precipita-se novamente sobre a superfície, muitas vezes depois de um longo trajeto, caracterizando um processo de transporte atmosférico, em um processo puramente físico. Alguns elementos químicos como o nitrogênio, o fósforo, o carbono e os metais, possuem também seus ciclos, que são chamados de ciclos biogeoquímicos, onde interagem quimicamente com diferentes formas de vida em processos influenciados pela geografia e geologia da região. Os ciclos de transformações são ainda de extrema importância para os processos produtivos, onde a matéria prima é transformada em produto acabado. O entendimento de tais ciclos produtivos é de grande importância econômica e social, uma vez que envolvem a geração de produtos muitas vezes essenciais para a manutenção de nossa qualidade de vida e muitas vezes causam impactos ambientais pelo fato de consumirem energia e gerarem resíduos. O entendimento dos fenômenos químicos e físicos, é um pré-requisito para que possamos nos aproximar do modelo de produção ideal, que é o de produção sustentável, ou seja, a produção de bens e serviços associados à eliminação ou minimização dos impactos ambientais. Nesta aula serão executadas algumas reações que deverão ser classificadas em função de suas características, como reações de: combinação, decomposição, combustão, simples troca e, dupla troca. Combinação: Duas substâncias reagem para formar uma única: MgO(s) + H2O(l) Mg(OH)2(s) Decomposição: Uma substância se decompõe em duas ou mais substâncias: H2CO3(aq) H2O(l) + CO2 Combustão: É a reação rápida entre um composto e o oxigênio. Algumas reações de combustão são também reações de combinação e vice-versa: 2 CH4O(l) + 3 O2(g) 2 CO2(g) + 4 H2O(l) Simples troca: É a troca de um elemento em um composto, por outro elemento. Cu(s) + 2 AgNO3 (aq) Cu(NO3)2(aq) + 2 Ag(s) Dupla troca: Neste tipo de reação ocorre uma troca de íons entre dois compostos. Normalmente este tipo de reação envolve dois compostos iônicos em solução aquosa, apresentando como produto a formação de um composto insolúvel ou um gás ou ainda uma reação ácido base. 3 BaCl2(aq) + 2 Na3PO4(aq) Ba3(PO4)2(s) + 6 NaCl(aq) Além de anotar observações com base em reações químicas, é importante também escrever equações balanceadas referentes ao fenômeno observado. Todos os exemplos anteriormente apresentados estão balanceados. O primeiro passo para 30 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA balancear uma equação química, é escrever corretamente todas as fórmulas químicas dos reagentes e produtos envolvidos. Por exemplo, vejamos a reação: C3H8(g) + O2(g) CO2(g) + H2O(g) Imagine o coeficiente 1 em frente ao propano (C3H8) e balanceie os hidrogênios e os carbonos. 1 C3H8(g) + O2(g) 3 CO2(g) + 4 H2O(g) Observe que existem agora 10 átomos de oxigênio na direita e somente dois átomos de oxigênio, na molécula de oxigênio, situada no lado esquerdo. Divida o número de átomos necessário (10), pelo número de átomos por molécula (2), para encontrar o coeficiente correto (5). C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(g) Note que o coeficiente 1 não é escrito na equação final, embora se saiba que ele está ali. É uma técnica muito comum deixar o O2 (ou H2) para balancear por último quando estas moléculas estão presentes. O coeficiente para o O2 afeta apenas a quantidade de um elemento, enquanto que outros coeficientes mudam a quantidade de ao menos dois elementos. Para balancear reações de dupla troca, comece com o íon apresente o maior subíndice (numeral sub-escrito que denota o número de átomos de um elemento na molécula). Caso dois elementos tenham mesmo sub-índice o balanceamento deverá ser iniciado pelo que tem o maior número de oxidação. Para a reação: BaCl2(aq) + Na3PO4(aq) Ba3(PO4)2(aq) + NaCl(aq) tanto o Na+ quanto o Ba2+ têm sub-índice 3, porém o Ba2+ tem o maior número de oxidação. É importante esclarecer que o sub-índice 4 é parte íon poliatômico fosfato e não deve ser considerado neste critério para o início do balanceamento. Começando com o bário, tem-se: 3 BaCl2(aq) + Na3PO4(aq) Ba3(PO4)2(aq) + NaCl(aq) O coeficiente 3 em frente ao cloreto de bário, implica em 6 cloretos, logo são necessário um 6 em frente ao cloreto de sódio: 3 BaCl2(aq) + Na3PO4(aq) Ba3(PO4)2(aq) + 6 NaCl(aq) O coeficiente 6 em frente ao cloreto de sódio implica na necessidade de duas moléculas de fosfato de sódio, para que tenhamos um balanceamento do sódio. 3 BaCl2(aq) + 2 Na3PO4(aq) Ba3(PO4)2(aq) + 6 NaCl(aq) Finalmente, deve-se conferir o balanceamento. Materiais e reagentes: 06 tubos de ensaio tela de amianto, tripé e bico de Bunsen 01 béquer de 100 01 béquer de 200 mL 01 vidro de relógio 02 pipetas graduadas e pêra de borracha 01 bagueta de vidro Solução de CaCl2 0,1 mol.L-1 Cu(OH)2 (s) Solução de Na2CO3 1,0 mol.L-1 MnO2 ( s) gelo Solução de NaOH 3,0 mol.L-1 Solução de NaNO3 0,1 mol.L-1 Iodo sólido Parafina sólida (aparas) Zinco ou magnésio (aparas) Solução de ácido clorídrico 1:1 Solução de hidróxido de sódio 1:5 Solução de cloreto férrico 0,1 mol.L-1 Solução de KSCN 0,1 mol.L-1 Solução de Na3PO4 0,1 mol.L-1 Solução de HCl 3,0 mol.L-1 Solução de H2O2 3% Solução de H2SO4 3,0 mol.L-1 Solução de HCl 6,0 mol.L-1 Solução de CaCl2 0,1 mol.L-1 Procedimento Experimental 1. Colocar alguns cristais de iodo em um béquer de 100 mL e cubra com um vidro de relógio, com a parte côncava para cima. Colocar o conjunto sobre uma tela de amianto apoiada no tripé de ferro e aqueça com a chama do bico de Bunsen regulada para pouca intensidade. Observe a liberação de vapores no interior do béquer. Desligar o bico de 31 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Bunsen e colocar um pouco de gelo sobre o vidro de relógio. Descrever e explicar as suas observações. Classificar os fenômenos observados. 2. Colocar em um tubo de ensaio seco, uma porção de aparas de parafina. Usando uma pinça de madeira, aquecer diretamente na chama do bico de Bunsen até a fusão. Virar o conteúdo do tubo, rapidamente e com muito cuidado, sobre uma superfície fria. Descrever e explicar as suas observações. Classificar os fenômenos observados. 3. Colocar em um tubo de ensaio seco, aproximadamente 0,1 g de zinco ou magnésio em aparas. Usando uma pipeta graduada e pêra, adicionar 3 mL de ácido clorídrico 1:1 ao tubo de ensaio. Descrever e explicar as suas observações. Classificar os fenômenos observados. ATENÇÃO: o ácido clorídrico é corrosivo, pode causar queimaduras na pele e mucosas. Use óculos de segurança. 4. Usando a mesma pipeta graduada do item anterior e a pêra, colocar 1 mL de uma solução de ácido clorídrico 1:1 em um tubo de ensaio. Adicionar então, cuidadosamente, com outra pipeta graduada e a pêra, 1 mL de uma solução de hidróxido de sódio 1:5. Agitar cuidadosamente. Verificar se ocorre uma variação perceptível de temperatura. 5. Colocar em um tubo de ensaio, com o auxílio de uma pipeta graduada e uma pêra, 2 mL de uma solução de cloreto férrico. Adicionar, com um conta-gotas, algumas gotas de uma solução de tiocianato de potássio. Descrever e explicar as suas observações. Classificar os fenômenos observados. 32 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 07 (Parte II) OCORRÊNCIA E CLASSIFICAÇÃO DE REAÇÕES QUÍMICAS E SUA DIFERENCIAÇÃO DE FENÔMENOS FÍSICOS (CONTINUAÇÃO) Realize as reações propostas a seguir e anote todas as suas observações referentes à formação de precipitados, evolução de gases, liberação de calor, ou mudança de cor. Classifique as reações de acordo com as informações fornecidas neste roteiro e outras bibliografias consultadas. Para concluir que uma reação não tenha ocorrido, espere pelo menos 5 minutos e, observe atentamente durante este tempo. Finalmente escreva e faça o balanceamento de todas as reações. 1. Misture 2 mL de CaCl2 0,1 mol.L-1 com 2 mL de Na3PO4. 2. Aqueça um tubo de ensaio contendo cerca de 0,5 g de Cu(OH)2 com um Bico de Bunsen 3. A um tubo de ensaio contendo 3 mL de HCl 3 mol.L-1, adicione um pequeno pedaço de zinco metálico. Após ter início o desprendimento de gás, cuidadosamente aproxime da boca do tubo um palito de fósforo aceso. 4. Misture 2 mL de HCl 3 mol.L-1 com 2 mL de Na2CO3 1 mol.L-1. Note que neste caso ocorrem duas reações. 5. A um tubo de ensaio contendo 3 mL de H2O2 3%, adicione 0,1 g de MnO2 (o dióxido de manganês irá agir apenas como catalisador). 6. Misture 2 mL de H2SO4 3,0 mol.L-1 com 4 mL de NaOH 3,0 mol.L-1. 7. Misture 2 mL de CaCl2 0,1 mol.L-1 com 2 mL de NaNO3 0,1 mol.L-1. 8. Misture 2 mL de HCl 3,0 mol.L-1 com 4 mL de KOH 3,0 mol.L-1. Questões: 1. O que caracteriza um fenômeno como puramente físico? E fenômeno químico? 2. Escreva as reações químicas observadas nesta aula. 3. O uso de metais pesados nesse experimento foi minimizado. Discuta a importância dos procedimentos de eliminação e/ou minimização do uso de resíduos, em relação aos procedimentos de tratamento. 33 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 08 DIÓXIDO DE CARBONO INSVESTIGANDO A PRODUÇÃO DA CHUVA ÁCIDA Objetivos: Após completar este experimento, os estudantes deverão ter aprendido o mecanismo de produção de CO2 a partir de reações ácido-base envolvendo carbonatos e bicarbonatos, algumas propriedades do CO2 e seu mecanismo enquanto agente extintor, a identificar compostos de uma mistura, a refletir a respeito do papel do CO2 no meio ambiente. Também deverão ter avaliado as condições que propiciam a formação de chuvas ácidas, bem como a sua influência na degradação de materiais a elas expostos. Introdução: O CO2 é um gás que existe na atmosfera em uma concentração de aproximadamente 360 partes por milhão. É um gás muito importante dentro do ciclo do carbono, uma vez que é a partir dele que se dá o fenômeno conhecido como produção primária, ou seja, a transformação do CO2 em matéria orgânica. Essa reação ocorre na presença de luz e de água. É assim que a reação de fotossíntese permite que as plantas cresçam. Do mesmo modo, alguns microrganismos se desenvolvem no ambiente aquático, dando origem a cadeia alimentar. O CO2 atmosférico é proveniente das mais diversas fontes, tais como mecanismos de respiração dos organismos, decomposição da matéria orgânica, incineradores, processos de queima em geral e, principalmente queima de combustíveis fósseis. Os combustíveis fósseis, como o carvão e o petróleo, são resultado da energia solar, que interagindo com o CO2 da atmosfera, resultou em matéria orgânica e esta, por uma série de processos, que levaram milhões de anos, em reservatórios de gás natural, carvão e petróleo, dentre outros materiais que hoje são usados como fonte de energia. Como a demanda por energia intensificou-se muito após a revolução industrial, uma larga extensão destes combustíveis tem sido queimada em anos recentes, o que implicou em um aumento significativo da concentração do CO2 atmosférico, bem como de poluentes gerados no processo de combustão. A conseqüência de maior impacto ambiental relacionada a emissão de CO2 é o efeito estufa, uma vez que o dióxido de carbono tem a capacidade de absorver parte da radiação solar incidente e dissipá-la na atmosfera na forma de calor. Normalmente essa radiação, em condições de menor concentração de CO2 seria refletida para fora da atmosfera sem maiores conseqüências. A absorção da radiação implica em aumento da temperatura global, descongelamento de parte da calota polar e elevação do nível d’água dos oceanos, aumento da umidade em algumas áreas, implicando em secas em outras, bem como interferência nas estações do ano. Na aula de hoje iremos estudar um pouco do comportamento químico do CO2, uma espécie que como se viu, está ligada a um dos impactos ambientais de maior importância que se vivência atualmente e que está classificado no rol das mudanças globais. Procedimento Experimental: PARTE I GERAÇÃO DE CO2: 1. Prepare um frasco gerador de CO2, conforme a Figura 8.1 34 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA FIGURA 8.1 Montagem de um sistema para geração de CO2 a partir de pó de mármore (ou carbonato de cálcio). 2. Adapte uma mangueira de borracha ao frasco gerador. Abra a torneira do funil, deixando o HCl entrar em contato com o mármore. Feche a torneira e borbulhe o CO2 em um tubo de ensaio preenchido até a sua metade com água destilada. Adicione algumas gotas de uma solução de metilorange e conclua se o CO2 é um óxido ácido ou básico. 3. Em outro tubo de ensaio contendo “água de cal” (solução de Ca(OH)2), borbulhe o CO2 gerado. Explique o que ocorre. 4. Em um béquer de 100 mL, coloque “água de cal” até mais ou menos 1/3 de sua capacidade. Usando uma pipeta, assopre na solução. Qual a relação entre o que ocorre agora, com o que você observou no item 3. ESTUDANDO O PRINCÍPIO DE UM EXTINTOR DE INCÊNDIOS DE CO 2: 1. Em um erlenmeyer de 250 mL coloque uma solução de NaHCO3 20% m/v, até uma altura de 2 cm. Com auxílio de uma pinça e cuidadosamente, introduza no interior do erlenmeyer, um pequeno frasco contento H2SO4 10% v/v. Cuidado para que as duas soluções não se misturem durante a montagem. A solução de bicarbonato de sódio deverá ficar abaixo da boca do frasco contendo ácido sulfúrico. Finalmente feche o erlenmeyer com uma rolha, contendo um tubo dobrado em ângulo reto. A Figura 8.2 mostra um esquema da montagem. 35 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA FIGURA 8.2 Montagem de um sistema para geração de CO2 a partir de pó de NaHCO3. 2. Em uma cápsula de porcelana, queime 1 mL de álcool. Vire o erlenmeyer com cuidado, de modo a que as duas soluções entrem em contato e aproxime da chama de álcool em combustão, a extremidade do frasco por onde sai o CO2 liberado. Descreva o que ocorre com a chama. É correto afirmar que o CO2 é combustível? É correto afirmar que o CO2 é comburente? Explique. PARTE II Escreva as reações. - Chuva ácida produzida pelo SO2: 1. Coloque um pouco de água destilada em um vidro de relógio e adicione um papel azul de tornassol. Observe se há mudança na cor do papel. 2. Em um vidro de relógio limpo, coloque uma pequena porção de enxofre com um pouco de água destilada. Ponha um papel de tornassol sobre o enxofre umedecido. Observe a cor do papel. 3. Repita o ensaio anterior, usando uma pétala de flor colorida como indicador, em lugar do tornassol. Observe a cor da pétala. 4. Em um frasco de boca larga com tampa (tipo de café instantâneo), prenda na parte interna, um fio de cobre com um papel de tornassol umedecido em água destilada e uma pétala de flor colorida. 5. Em um cadinho, aqueça uma pequena porção de enxofre e quando este começar a fundir, introduza o cadinho no interior do frasco, usando uma pinça metálica (tenaz). 6. Cubra o frasco com um vidro de relógio ou com uma placa de Petri. Aguarde de 10 minutos e observe as alterações no papel de tornassol e na pétala. A Figura 8.3 ilustra a montagem do sistema. FIGURA 8.3 – Representação esquemática do sistema para simulação de chuva ácida. 7. Retire todo o material de dentro do frasco e rapidamente adicione 20 mL de água destilada. Feche o frasco e agite-o, de modo a que a atmosfera interna do frasco tenha contato com a água. 8. Sobre um azulejo branco, coloque um fragmento de mármore, um fragmento de magnésio e um papel de tornassol azul. Com um conta-gotas, retire uma amostra do interior do frasco e pingue sobre os 3 objetos. Explique as suas observações. - Chuva ácida provocada pelo NO2: 1. Use, novamente, o frasco de boca larga, prendendo o fio de cobre e nele o papel tornassol e a pétala. 36 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 2. Introduza um cadinho, no interior do frasco, contendo um fragmento de cobre. Com uma pipeta, adicione sobre o cobre algumas gotas de HNO3 concentrado. Observe a evolução de um gás castanho avermelhado, que é o NO2 3. Retire todo o material de dentro do frasco e rapidamente adicione 20 mL de água destilada. Feche o frasco e agite-o, de modo a que a atmosfera interna do frasco tenha contato com a água. Espere até desaparecer completamente a cor castanhoavermelhada. 4. Sobre um azulejo coloque mármore, magnésio e papel tornassol azul. Sobre esses materiais adicione algumas gotas do conteúdo do frasco. Explique as suas observações. QUESTÕES: 1. Discuta a relação que existe entre a pétala de flor e o papel tornassol usados como indicadores. 2. Observando o que ocorreu com o mármore, com o magnésio e com a pétala de flor, o que você deduz sobre as conseqüências das chuvas ácidas. 3. Escreva as reações que podem produzir chuva ácida a partir de óxidos de nitrogênio e óxidos de enxofre. 4. Por que as regiões onde existem usinas termoelétricas para geração de energia podem apresentar chuvas ácidas. 5. Discuta a importância da existência de programas de monitoração ambiental com técnicas bastante sensíveis a mudanças de pH das chuvas. 37 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 09 (Parte I) ÁGUA POTÁVEL Objetivos: Após completar este experimento, os estudantes deverão ter aprendido reproduzir, no laboratório, algumas das fases do processo de tratamento da água, visando torná-la potável, conceituar água dura, verificando algumas de suas propriedades, aplicar algumas técnicas básicas de separação, como filtração, decantação, dissolução e floculação. Introdução: A água consumida pela população das cidades, normalmente é proveniente de rios, lagos, poços comuns e artesianos ou nascentes. Em geral, estas águas contem partículas em suspensão e microrganismos que podem ou não ser patogênicos. Por isto, antes de ser distribuída para o consumo, à água deve ser submetida a um processo de tratamento. Numa estação de tratamento de águas (ETA), geralmente desenvolvem-se as seguintes etapas: (1) aeração, (2) coagulação, (3) sedimentação, (4) filtração e (5) desinfecção. Em algumas etapas ocorre ainda, correção do valor do pH, de modo a otimizar o processo de tratamento. Em alguns locais a água potável é obtida a partir da água do mar, por falta da água doce; o processo usado nestes casos é a dessalinização, normalmente por processo osmótico. Materiais e reagentes. 04 béqueres de 250 mL funil para filtração papel de filtro sulfato de alumínio Carbonato de sódio pipeta volumétrica de 50 mL cápsula de porcelana com capacidade de 100 mL garrafas de PET (tipo refrigerante) balança analítica com legibilidade de 0,0001g espátula de metal Procedimento Experimental: 1. Floculação. a) Em um béquer de 250 mL, colocar cerca de 150 mL de água de torneira. Adicionar um pouco de terra e agitar com um bastão de vidro. Deixar em repouso até que o material sólido sedimente e o líquido sobrenadante fique apenas turvo. b) Numerar 4 béqueres de 100 mL, de 1 a 4. c) Transferir cerca de 80 mL de água do béquer de 250 mL para o de no1, observar e anotar a aparência do líquido. d) Filtrar aproximadamente 30 mL da água do béquer número 1 para o no2 e observar se neste último houve alguma alteração em relação ao béquer no1. e) Adicionar ao conteúdo do béquer no1, cerca de 10 mg de Na2CO3 (alguns cristais na ponta da espátula) e dissolver agitando muito lentamente. Em seguida, acrescentar cerca de 10 mg de sulfato de alumínio – Al2(SO4)3 e agitar novamente. Deixar em repouso por 20 minutos. f) Observar se houve a formação de flocos e se a água ficou mais clara. Decantar e separar o sobrenadante do béquer no 1 para o no 3. g) Filtrar o conteúdo do béquer no3 para o no4 e comparar o conteúdo deste último com o béquer de 250 mL (que sofreu apenas decantação). 38 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA AUMENTANDO A ESCALA DO TRATAMENTO DE ÁGUAS 1. Discussão teórica. É fácil imaginar que em uma estação de tratamento de águas, a operação se dá em uma escala muito maior do que a de bancada. Em média cada habitante de uma cidade consome de 200 a 250 litros de água por dia, o que faz com que uma cidade das proporções de Campinas, com aproximadamente 1 milhão de habitantes, consuma entre 200.000.000 e 250.000.000 de litros de água por dia. No procedimento experimental que se segue, seremos mais realistas, com relação ao tratamento de água, utilizando filtros de areia e brita e, iremos aumentar a escala do nosso experimento. 2. Reagentes e Materiais. 5 litros de água "suja" (ou adicionar 2 copos e meio de terra a 5 litros de água de torneira). Um frasco plástico de 1 litro de capacidade (frasco de refrigerante, p. ex.), com tampa, denominado frasco A. Dois frascos plásticos de 1 litro de capacidade, um deles com o topo removido (frasco B) e o outro com o fundo removido (frasco C). Um frasco plástico com capacidade para 1½ litro, com a parte superior removida (frasco D). 2 gramas de sulfato de alumínio. 2 gramas de carbonato de sódio 1 copo grande. 1 filtro de café, de papel. Uma tira elástica. Um relógio ou cronômetro. Areia fina (cerca de 400 mL, em volume); Areia grossa (cerca de 400 mL, em volume); Brita fina ou pedras de aquário, lavadas. 3. Procedimento Experimental. 1. Adicionar cerca de 750 mL da água "suja" no frasco A, com tampa. Descrever a aparência e o cheiro da água. 2. Aeração: consiste na adição de ar a água. Este processo permite que alguns gases voláteis presentes na água escapem e permite, igualmente, a adição de oxigênio à água. Tampar cuidadosamente o frasco e agite-o vigorosamente por cerca de 30 segundos. Despejar a água no frasco B e coloque-a novamente de volta para o frasco A. Repetir este procedimento por pelo menos 10 vezes. Descrever qualquer alteração que eventualmente tenha sido observada. 3. Coagulação: é o processo através do qual a sujeira e outras substâncias sólidas presentes na água se aglomeram em flocos, para que possam ser removidas da água. Adicionar cerca de 2 g de carbonato de sódio à água aerada. Adicionar, em seguida, o sulfato de alumínio à mistura. Agitar lentamente a mistura por cerca de 5 minutos. 4. Sedimentação: processo que ocorre quando os flocos formados no item 3 decantam, pela ação da gravidade, para o fundo do frasco. Permitir que a água permaneça em repouso por cerca de 20 minutos. Observar o que ocorre, a cada intervalo de 5 minutos, com a água contida no frasco. 5. Construir um filtro com o frasco C, conforme mostra a figura a seguir: a. Com o auxílio de uma tira elástica ou de um pedaço de barbante, amarrar o filtro de papel do lado externo da boca do frasco C. Colocar o frasco de cabeça para baixo e adicionar uma camada de brita ou pedras de aquário ao interior do frasco. O filtro deve impedir que a brita caia fora do frasco. b. Adicionar uma camada da areia grossa ao topo da camada existente de brita. c. Sobre esta camada de areia grossa, despejar uma camada de areia fina. 39 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA d. Finalmente, limpar o conteúdo da garrafa, passando pelo sistema, água da torneira. Esta lavagem deve ser realizada cuidadosamente para se evitar a mistura das areias fina e grossa. A Figura 9.1 mostra como deve ser realizada esta montagem. FIGURA 9.1 – Montagem para filtração de água. 6. Filtração: etapa onde ocorre a remoção da maior parte das impurezas remanescentes na água, após terem ocorrido à coagulação e a sedimentação. Depois que uma grande quantidade de material sólido (sedimentos) tenha se decantado no fundo do frasco B, despejar cuidadosamente cerca de três quartos do conteúdo deste frasco para o sistema de filtração. Coletar a água filtrada num copo. Comparar a água filtrada com aquela inicialmente utilizada na realização do experimento, principalmente com relação à aparência e cheiro. 7. Observação importante: A etapa final do processo de tratamento da água destinada ao abastecimento público envolve uma etapa de desinfecção, ou seja, de remoção ou inativação dos microrganismos presentes. Como os agentes desinfetantes normalmente utilizados são cáusticos e corrosivos, eles devem ser manipulados com extremo cuidado e, portanto não são empregados neste experimento. A água resultante não deve, conseqüentemente, ser consumida, pois pode causar efeitos adversos à saúde. QUESTÕES 1. Como transformar a água captada em um manancial em água potável? 2. Qual a diferença entre água potável e água destilada? 3. Qual a diferença entre água destilada e água deionizada? 4. Para que são usados o Al2(SO4)3 e o Na2CO3 no tratamento da água? 5. Por que é necessária a correção do pH no tratamento da água? 6. Qual a função da floculação? 40 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 09 (Parte II) ASPECTOS DE INTERESSE NA AVALIAÇÃO DA QUALIDADE DA ÁGUA. Água Dura: Água dura é uma água natural relativamente rica em sais de cálcio (Ca2+) e magnésio (Mg2+), na forma de bicarbonatos (HCO3-), nitratos (NO3-), cloretos (Cl-) e sulfatos (SO42-). Ela não produz espuma com os sabões (sais orgânicos de sódio – Na+), pois estes reagem com os sais de cálcio – Ca2+ (da água dura), formando sais insolúveis de cálcio. Em razão disto, esta água causa prejuízos, como por exemplo, maior consumo de sabão nas lavagens e a formação de uma crosta branca (compostos de cálcio) nas caldeiras, podendo provocar a sua explosão. Por este motivo, é extremamente importante à verificação periódica da dureza da água usada nas caldeiras e nos processos industriais como a fabricação de cervejas e refrigerantes, indústria farmacêutica, têxtil e outras. Isto é feito através da volumetria de complexação, titulando-se a água com EDTA, numa amostra tamponada, usando-se como indicador o negro de Eriocromo T. Se a dureza estiver elevada, o abrandamento (remoção da dureza ou ainda, amolecimento), pode ser efetuado por fervura ou pela adição de substâncias amolecedoras, como: NaOH, Na2CO3 e Na3PO4. Contudo, o problema da água dura é meramente operacional, não sendo prejudicial à saúde humana. A água dura, em termos de saúde pública, é benéfica aos processos de calcificação de dentes e ossos. As águas que apresentam pequena porcentagem de sais de cálcio recebem o nome de “água mole” ou “água branda”. A dureza da água é normalmente expressa em ppm (partes por milhão) de carbonato de cálcio (CaCO3). Procedimento Experimental 1. Colocar 3 mL de “água dura” em um tubo de ensaio. Aquecer até a ebulição. Deixe esfriar, filtre e compare com a “água dura” colocada em outro tubo. Anotar o que você observou. 2. Colocar em um tubo de ensaio “água dura” e em outro tubo água destilada. Adicionar a ambos 3 mL de água contendo Ba(OH)2. Observar e anotar. 3. Em 2 tubos de ensaio, adicionar a um deles “água dura” e ao outro tubo água destilada. Adicionar a ambos, gota a gota, uma solução de detergente líquido, agitar os tubos após cada adição. Observar o número de gotas necessárias para produzir a espuma permanente nos dois tubos. Anotar e tirar as suas conclusões. 4. Colocar em dois tubos “água dura” e água destilada. Acrescentar a ambos 2 ou 3 gotas de fenolftaleína. Observar e concluir. pH: O pH é um termo utilizado universalmente para expressar a intensidade da condição ácida ou alcalina de uma solução, mais precisamente, é um modo de se expressar a “concentração hidrogêno-iônica”. O valor do pH, que é um reflexo da concentração de íons H+, tem influência sobre várias reações químicas e metabólicas nos organismos vivos, influenciando por exemplo à eficiência dos reatores biológicos de tratamento de esgotos. Além disso o pH pode aumentar a velocidade de corrosão de metais. O valor do pH pode ser verificado de modo instrumental, ou por meio de indicadores colorimétricos. Consulte o professor para saber como fazer essa avaliação. Cor: A cor na água se deve a ocorrência de sais metálicos, como sais de ferro e manganês e ainda a presença de matérias húmicas, algas, plantas aquáticas, protozoários e ainda resíduos de origem sanitária e/ou industrial. No caso de abastecimento público, um alto valor na cor certamente resultará na rejeição da água pela população, mesmo que seja uma água isenta de microrganismos patogênicos e compostos tóxicos. Águas com cor podem ainda provocar o aparecimento de manchas em roupas durante o processo de lavagem e também comprometer 41 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA processos industriais. Do ponto de vista ambiental, em mananciais que apresentam cor a entrada de luz é atenuada, o que pode comprometer os processos de fotossíntese na coluna d’água. Consulte o professor para saber como avaliar a cor de uma amostra de água. Turbidez: A turbidez de uma água é causada pela presença de partículas em suspensão e coloidais, tais como argila, matéria orgânica, plâncton, colônias de microrganismos, carbonato de cálcio, etc. Tais partículas podem ter origem em processos de erosão, lixiviação do solo, despejos industriais e sanitários. A água sem turbidez é importante não só pelo aspecto estético, como também para o consumo humano e usos industriais, onde a sua presença pode ser deletéria a processos de fabricação de bebidas, papel e tecidos. A sua presença pode ainda significar um comprometimento da eficiência dos processos de desinfecção da água. QUESTÕES. 1. 2. 3. 4. 5. 6. 7. 8. O que é água dura e água mole? O que causa a dureza da água? Como a água dura pode ser abrandada? Mostre utilizando equações químicas, o que ocorre quando a dureza da água é reduzida utilizando fervura. Escreva as reações químicas entre a água com dureza temporária (contendo cálcio e/ou magnésio na forma de bicarbonato) e os amolecedores NaOH e Na3PO4. Considere uma água dura de dureza permanente (contendo cálcio e/ou magnésio na forma de cloreto, nitrato e sulfato). Escreva a reação química que ocorre entre o sulfato de magnésio e os abrandadores carbonato de sódio e fosfato de sódio. Por que a água dura não é adequada para processos de lavagem? Por que a água dura pode provocar a explosão de uma caldeira ou de um aquecedor a gás? Como isto pode ser evitado? 42 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 10 SÍNTESE E PROPRIEDADES DE SÓLIDOS INORGÂNICOS Objetivos: sintetizar e observar as propriedades de um “plástico inorgânico de enxofre” e comparar as propriedades de peças de cerâmica antes e após a queima, avaliando a resistência mecânica, a resistividade térmica, a impermeabilidade e a densidade do material. Introdução Teórica: “Plástico Inorgânico” Estamos acostumados a pensar nas substâncias “plásticas” como constituídas sempre por compostos inorgânicos, mais especificamente polímeros como o poli(cloreto de vinila), PVC, e o poli(etilenotereftalato), PET. Nesse experimento, prepararemos um plástico inorgânico a partir do enxofre sólido. O enxofre em pó, amarelo é constituído por moléculas com fórmula S8, ou seja, unidades constituídas por oito átomos de enxofre. Quando o enxofre funde, essas unidades S8 se rompem, e novas unidades com 16 átomos se formam. Acima de 160ºC, essas unidades também se rompem formando cadeias ainda maiores. O súbito resfriamento do enxofre fundido determina a permanência dessas cadeias maiores (se o resfriamento fosse lento, voltar-se-ia ao ponto de partida: unidades de S8). Uma vez que essas longas cadeias não possuem o ordenamento estrutural nem a força de coesão exibida pelas unidades S8, o material obtido é elástico com uma consistência de plástico. Óxidos metálicos e suas propriedades: magnetita A magnetita (Fe3O4) contém Fe(II) e Fe(III) na proporção 1:2 (Fe2+Fe3+2O4) e apresenta propriedades magnéticas (atração por um campo magnético) que a nomeiam. Ela pode ser encontrada na natureza na forma do minério que leva este mesmo nome e assim como a hematita e o sulfeto de ferro, são matérias primas para obtenção de Fe para a indústria do aço, por exemplo. A obtenção da magnetita é feita em meio básico, utilizando-se uma solução contendo os íons Fe2+ e Fe3+. Cerâmicas e suas propriedades A argila foi o primeiro material usado pelos humanos, e ainda continua a ser útil nos tempos modernos. A argila usada na fabricação de cerâmicas de uso doméstico é composta principalmente de sílica hidratada (SiO2.xH2O) e alumina (Al2O3). Pequenas quantidades de outros minerais, como os óxidos de ferro (Fe2O3) e de magnésio (MgO) costumam estar presentes na argila. Enquanto está úmida, a argila possui uma propriedade quase única, a sua plasticidade que permite a moldagem do material em temperatura ambiente. Esta plasticidade depende da quantidade de água, da forma e do tamanho das partículas dos minerais que fazem parte da sua composição, da quantidade de íons presentes e da temperatura. Existem duas etapas importantes na transformação de uma peça úmida de cerâmica em um produto acabado: a secagem e a queima. Os objetos de cerâmica devem ser secos antes da queima, de modo que a maior parte da água dos poros seja eliminada. A água residual dos poros do material é eliminada durante o estágio inicial da queima a cerca de 100oC. A retirada da água dos poros do material garante que a peça possa ser aquecida até a temperatura de queima se trincar e quebrar. A queima, e a sinterização que ocorre durante a queima, alteram significativamente as propriedades do material. A cerca de 350oC, até a água de 43 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA hidratação será eliminada. À medida que a temperatura aumenta, no estágio de sinterização, a porosidade do material é reduzida, formando-se uma estrutura fechada, e objeto encolhe ligeiramente. Isto causa um aumento na densidade e na resistência mecânica do material. A cerâmica após a queima é dura, densa, mais durável, impermeável a líquidos e quebradiça. PARTE A – SÍNTESE DE UM “PLÁSTICO INORGÂNICO”: ENXOFRE Materiais e reagentes: Um tubo de ensaio Pinça de madeira Bico de Bunsen Enxofre sólido Béquer de 250 mL Procedimento a) b) Preencher um tubo de ensaio com aproximadamente 1/3 de seu volume com enxofre em pó. aquecer lentamente até sua fusão, e então despejar lentamente o líquido em água fria. Atenção! Logo após fundir, o enxofre tem uma coloração laranja. O aquecimento deve prosseguir até que uma coloração vermelho-escura (como um caramelo) seja observada. c) Retirar o “plástico” formado e observar suas propriedades. Cor, odor, flexibilidade. PARTE B – SÍNTESE DE UM ÓXIDO INORGÂNICO: MAGNETITA Materiais e Reagente: Tubo de ensaio pinça de madeira Banho-maria (~80ºC) Imã Papel de filtro, funil, béquer Fe(NH4)(SO4)2 0,1 mol/L (recém preparada) FeSO4 0,1 mol/L NH4OH 1,0 mol/L etanol Procedimento: a) b) c) d) e) f) Em um tubo de ensaio, adicionar 2 mL de Fe(NH4)(SO4)2 0,1 mol/L e 2 mL de solução de FeSO4 0,1 mol/L. Adicionar rapidamente 10 mL de solução NH4OH 1,0 mol/L. Com o auxilio de uma pinça de madeira, aquecer o tubo em banho-maria por 5 minutos. Aproximar um imã da lateral do tubo e verificar o comportamento das partículas formadas. Decantar o precipitado com a ajuda do imã e descartar o sobrenadante. Adicionar cerca de 5 mL de água, agitar e filtrar rapidamente. Lavar o resíduo com 10 mL de etanol e secar em estufa a 110ºC. Verificar as propriedades magnéticas do material seco. PARTE C – PROPRIEDADES DAS CERÂMICAS Materiais e reagentes: Argila Placas de vidro Filme fino de PVC (Magipack) Moldes Suporte universal Argola pequena e garra 01 Vela Fósforos 44 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Balança de precisão Estufa (200oC) Mufla (1200oC) 01 béquer de 50 mL Bico de Bunsen 04 Pregos de aço carbono Areia Procedimento: Preparação dos corpos de prova a) Colocar uma placa de vidro sobre a bancada, cobrir cuidadosamente a placa com um filme fino de PVC (Magipack). O filme plástico deverá ficar perfeitamente esticado sobre o vidro. b) Colocar uma quantidade de argila úmida sobre a placa e, usando as mãos e uma bagueta de vidro, obter uma placa com espessura uniforme de 0,5 cm. Usando uma régua e uma espátula metálica cortar 04 corpos de prova. Cada corpo de prova deverá ter as seguintes dimensões: largura = 2,5 cm, comprimento = 12 cm e espessura = 0,5 cm. Retirar e devolver ao recipiente com argila, o excesso de argila que sobrar entre os corpos de prova. c) Com um prego ou um palito de madeira, identificar os corpos de prova do seu grupo. Para tanto, identificar os corpos de prova. Exemplo: Corpos de prova , AA1, AA2, AA3, AA4, AA5 ou 4A, 4B, 4C e 4D. Registrar a identificação dos seus corpos de prova em suas anotações sobre a aula. d) Usando a balança de precisão, pesar um corpo de prova úmido. e) Deixar os quatro corpos de prova secando ao ar por três dias. f) Separar dois corpos de prova de cada grupo e secar estufa a 200oC por duas horas antes da queima. Queimar os corpos de prova na mufla. A etapa de queima corresponde: (a) colocar os corpos de prova na mufla a 300oC, (b) regular a temperatura da mufla para 1200oC, (c) após a estabilização da temperatura, manter os corpos de prova a 1200oC por cerca de 4 horas, (d) desligar a mufla (sem retirar os corpos de prova de seu interior) e permitir que ela esfrie lentamente, (e) retirar os corpos de prova do interior da mufla. OBSERVAÇÃO IMPORTANTE: as etapas (5) e (6) serão realizadas pela Técnica do laboratório. Testes dos corpos de prova a. Recuperar os corpos de prova preparados pelo seu grupo, observar e registrar as diferenças entre os corpos de prova secos ao ar (dois deles) e os corpos de prova queimados (dois deles). b. Determinação da densidade dos corpos de prova: Usando a balança de precisão, pesar cada um dos corpos de prova. Dos quatro corpos de prova, dois foram secos ao ar e dois foram queimados. Usando uma régua, medir a altura, a largura e o comprimento de cada um dos corpos de prova após a secagem e após a queima. Calcular a densidade de cada corpo de prova. c. Teste das propriedades térmicas do corpo de prova: (a) usando cera de vela derretida, prender quatro pregos da lateral de um corpo de prova queimado. Distribuir os pregos em distâncias iguais, a partir de uma das extremidades do corpo de prova e ao longo do comprimento do corpo de prova. Medir a distancia de cada prego até a outra extremidade do corpo de prova (ver figura abaixo); (b) colocar o corpo de prova sobre uma argola pequena presa no suporte universal. Ajustar a altura da argola e a posição de modo que um bico de Bunsen possa ser colocado sob uma das extremidades do corpo de prova (ver figura abaixo); 45 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA (c) acender o bico de Bunsen, regular a intensidade da chama (chama fraca) e posicionar o bico de Bunsen sob a extremidade do corpo de prova; (d) registrar o tempo de aquecimento necessário para que cada um dos pregos caia do corpo de prova; (e) observar o teste com um dos corpos de prova secos na estufa, que será realizado pelo professor. Figura 10.1 – Montagem para determinação das propriedades térmicas. 3. Teste das propriedades mecânicas do corpo de prova: (a) colocar um suporte universal sobre duas folhas grandes de jornal; (b) prender um corpo de prova seco na estufa por uma de suas extremidades, usando uma garra e o suporte universal (ver figura abaixo); (c) colocar um frasco plástico de 500 mL tarado sobre a extremidade livre do corpo de prova (ver figura abaixo); (d) adicionar areia ao frasco plástico até que ocorra a ruptura (quebra) do corpo de prova; (e) recolher a areia utilizada e pesar em balança de precisão; (f) repetir o teste com um dos corpos de prova queimados. Figura 10.2 – Montagem para determinação da resistência mecânica. 4. Molhabilidade da cerâmica: (a) colocar cerca de 20 mL de água com corante em um copo de béquer de 50 mL; (b) mergulhar parcialmente um pedaço de cerâmica seca em estufa na água e observar e registrar o comportamento do material; (c) repetir a etapa (b) usando um pedaço de cerâmica queimada e registrando as diferenças observadas. Resultados: 46 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA Questões: 1. Faça um resumo das diferenças em densidade, resistência mecânica, resistividade térmica e molhabilidade da cerâmica seca ao ar e da cerâmica queimada. 2. Quais são os fenômenos que ocorrem durante a secagem e durante a queima da cerâmica? 3. O que pode acontecer se uma cerâmica é queimada antes da secagem? 4. Quais as influências destes fenômenos nas propriedades da cerâmica? 5. Qual a diferença entre resistência mecânica e dureza? 6. Em que ocasiões são utilizados materiais cerâmicos nos laboratórios de química? 47 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA EXPERIMENTO 11 FÓRMULA EMPÍRICA DE UM HIDRATO PRINCÍPIOS DO PROCESSO FOTOGRÁFICO Objetivos: após completar este experimento, os estudantes deverão ter aprendido um método para identificar sais inorgânicos, a determinar a porcentagem de água e a fórmula empírica de sais inorgânicos, a fazer testes de chama. Também deverão ter aprendido, identificar a luz como causadora da mudança de coloração do AgCl, AgI e AgBr, descrever a reação que produz as imagens nas emulsões fotográficas (preto e branco), caracterizar a reação do AgNO3 como uma reação de dupla troca. Introdução: Muitos compostos sofrem decomposição quando são aquecidos, mesmo antes de atingirem o seu ponto de fusão. A decomposição de um composto resulta na formação de duas ou mais substâncias distintas. Uma das classes de compostos passíveis de decomposição são os sais inorgânicos, que contém águas de hidratação na estrutura. Nestes compostos, chamados de hidratos, a água é fracamente ligada ao sal e normalmente pode ser removida com aquecimento moderado. Para se escrever a fórmula de um hidrato, escreve-se primeiro a fórmula do sal anidro, depois um ponto, um coeficiente que denota o número de águas de hidratação e finalmente a fórmula H2O. Desse modo a fórmula do sulfato cúprico pentahidratado é escrita: CuSO4.H2O. Neste experimento você irá explorar algumas das propriedades dos hidratos, determinar a porcentagem de água e fórmula empírica de tais compostos. Compostos que absorvem água do ar e que por isso podem, em alguns casos, ser usados como agentes dessecantes, são chamados de higroscópicos ou deliqüescentes. Em alguns hidratos, a água de hidratação é ligada tão fracamente, que tende a escapar para a atmosfera, mesmo a temperatura ambiente. Estes compostos são chamados de eflorescentes. Na primeira e na segunda parte deste experimento, será estudado o comportamento dos hidratos com relação às águas de hidratação. Na terceira parte do experimento, o professor irá fornecer um hidrato desconhecido que deverá ser identificado. Por meio da remoção quantitativa das águas de hidratação, será possível calcular a massa de água no hidrato. Finalmente, conhecendo a identidade do sal, será possível determinar o número de águas de hidratação. Certamente você já teve a oportunidade de admirar a beleza de uma fotografia, mas o talvez o que não tenha feito ainda foi tentar descobrir o mecanismo que faz aparecer no papel aquela cena registrada pela câmara fotográfica. Como realmente ocorre isto? Vamos refletir sobre o fenômeno em duas partes: a primeira reúne aspectos físicos relacionados com a ótica: lentes produzem a “imagem” sobre um filme. A segunda reúne os fenômenos químicos associados à produção ou reprodução da imagem. É esta parte, ou melhor, apenas uma das reações dela, que nos interessa particularmente aqui. De qualquer forma, as reações químicas associadas com a reprodução da imagem poderiam ser assim resumidas: Na exposição do filme à luz durante um fração de segundo, a imagem é gravada no filme. No processo de revelação, esta imagem, que é denominada de “imagem latente”, se transforma no “negativo”. Na fase de revelação é que atuam os reveladores, que são substâncias que fornecem elétrons para os haletos de prata que receberam luz, levando à formação de prata metálica, que tem cor preta. Na fixação, a imagem revelada é tornada permanente através de substâncias denominadas de fixadores, que na verdade removem do negativo todos os sais de prata 48 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA que não receberam luz, impedindo assim que o negativo escureça completamente quando receber luz durante o seu manuseio, uma vez que estes sais são fotossensíveis. A lavagem consiste na remoção total das substâncias dos tratamentos anteriores, para então obter-se o negativo, que após um processo de secagem é levado para um ampliador, para dar origem as fotografias em papel. Nesta abordagem não serão percorridos todos os passos do processo fotográfico. O foco do trabalho estará centrado na primeira etapa do processo e, deverão ser feitas observações e reflexões que permitam responder a questões como: Que substâncias estão sobre o filme fotográfico e são responsáveis pela formação da imagem? Quais as reações que ocorrem com estas substâncias? O que forma as regiões escuras da imagem? Procedimento Experimental A. DELIQUESCÊNCIA E EFLORESCÊNCIA: Coloque alguns cristais de sulfato de sódio decahidratado em um vidro de relógio. Ocasionalmente observe sua aparência e anote o que acontece por pelo menos uma hora. Em outro vidro de relógio, coloque alguns cristais de acetato de sódio. Observe ao longo do tempo e anote. B. SULFATO DE COBRE PENTAHIDRATADO: Coloque 1g de CuSO4.5H2O em um tubo de ensaio. Execute então uma montagem conforme a que é mostrada na Figura 11.1. Alternativamente, o tubo pode ser aquecido com a boca para cima e o vapor, recolhido em um vidro de relógio invertido sobre o tubo. Aqueça o tubo até que a cor azul se dissipe; enquanto isso o vapor deverá começar a condensar-se no vidro de relógio. Reduza o aquecimento caso ocorra algum sinal de escurecimento do tubo. Ao final do aquecimento o sólido deverá estar branco e várias gotas de um líquido deverão estar no vidro de relógio. Remova o resíduo com um bastão de vidro e divida-o em dois vidros de relógio. No primeiro pingue gotas do líquido recolhido no vidro de relógio e no segundo gotas de água. Escreva as equações para todas as mudanças observadas. Escreva as equações para todas as mudanças observadas. FIGURA 11.1 – Montagem para secagem do sulfato cúprico pentahidratado (inverter a posição do tubo). 49 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA C. IDENTIFICAÇÃO DE UM HIDRATO DESCONHECIDO E DETERMINAÇÃO DO SEU TEOR DE ÁGUA: 1. O hidrato desconhecido pode ser cloreto de estrôncio, sulfato de magnésio ou sulfato de zinco. Dissolva cerca de 0,1 g do hidrato em um tubo de ensaio, usando aproximadamente 5 mL de água. Esta solução será usada neste item e no próximo. Limpe um fio de Ni-Cr por sucessivas imersões em HCl e exposição a chama do Bico de Bunsen até que nenhuma cor seja observada. Execute testes com soluções conhecidas de ZnSO4, MgSO4 e SrCl2. Execute então um teste com a solução desconhecida. Este teste deverá possibilitar a determinação da presença de estrôncio ou então eliminar esta possibilidade. 2. Caso a solução desconhecida não seja cloreto de estrôncio, insira no tubo um pequeno pedaço de fita de magnésio recém polida. Espere 30 segundos para que a reação ocorra. O indicativo da ocorrência da reação é o será o aparecimento de uma opacidade na fita (sulfato de zinco), conforme mostra a reação: Mg(s) + ZnSO4(aq) MgSO4(aq) + Zn(s) Caso a fita continue com brilho, estará evidenciada a ausência do sal de zinco. Pequenas bolhas de gás poderão se desprender da fita devido à formação de hidrogênio, conforme mostra a reação: Mg(s) + H2O(l) Mg(OH)2(s) + H2(g) 3. Pese um cadinho e adicione a ele cerca de 4g do hidrato desconhecido. Tenha certeza de determinar exatamente as massas. Monte um sistema conforme o que é mostrado na Figura 11.2. Aqueça moderadamente por 8 minutos e então intensamente por mais 8 minutos. Deixe o cadinho esfriar e pese-o. Aqueça novamente e intensamente por mais 5 minutos, deixe-o esfriar e pese novamente. Mantenha este procedimento até a obtenção de peso constante (variações menores do que 0,02g). FIGURA 11.2 – Montagem para determinação do número de águas de hidratação. ` D. Princípios do processo fotográfico 1. Pipete em um béquer, 10 mL de uma solução de ácido clorídrico 0,5 mol.L-1 (alguns grupos podem usar brometo de sódio ou iodeto de sódio). 50 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 2. Adicione ao béquer, usando outra pipeta, 10 mL de AgNO3 2% m/V. 3. Filtre o precipitado resultante. 4. Enquanto a filtração se processa, recorte um pequeno círculo, de aproximadamente 2 cm de diâmetro, no inteiro de um pedaço de cartolina. 5. Completada a filtração, retire o papel do funil, abra-o e estenda-o sobre outro papelfiltro ou sobre uma folha de caderno. 6. Espalhe a massa do precipitado obtido, com o auxílio de uma espátula ou bastão de vidro, conforme ilustra a Figura 11.3. 7. Coloque o retângulo de cartolina furado sobre o precipitado espalhado e exponha todo o conjunto à luz intensa. 8. Após a ocorrência de mudanças visíveis, retire a cartolina. FIGURA 11.3 – Preparação do papel fotográfico. QUESTÕES: 1. Complete e faça o balanceamento da reação: CaCl2.2H2O 2. Qual a porcentagem de água no sal da reação anterior? 3. Uma amostra de 4,00 g de brometo de níquel(II) perdeu 0,793g de água quando foi 4. aquecida. Determine a porcentagem de água e a fórmula do hidrato. 5. Identifique o hidrato desconhecido, analisado em C1 e C2. 6. Calcule a sua fórmula do hidrato analisado em C3, inclusive com as águas de hidratação. 7. Escreva a reação que ocorre quando se mistura o nitrato de prata com o ácido clorídrico. 8. Qual reação ocorre, quando se usa iodeto ou brometo de sódio, em lugar do ácido clorídrico. 9. O que há de comum entre os íons Cl-, I-, Br-? 10. Classifique as reações anteriores, conforme os critérios do experimento 6. 11. O que você conclui, com base nas diferenças observadas para as áreas do precipitado expostas e não expostas à luz? 12. Explique a razão de em uma fotografia existirem áreas escuras e áreas claras. 51 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA AULA 12 PONTO DE EBULIÇÃO E DESTILAÇÃO Objetivos: Exemplificar o uso de destilação simples na separação de líquidos voláteis com diferentes pontos de ebulição. Introdução: A destilação é o mais importante método para purificação de líquidos. Há dois tipos de purificação que se pode realizar por destilação: separação de um líquido volátil de substâncias não voláteis e separação de um líquido volátil de outros líquidos voláteis. Neste segundo caso, é essencial que haja diferença entre os pontos de ebulição para que a separação ocorra de maneira satisfatória (salvo os casos de formação de misturas azeotrópicas). Quando a diferença é grande, pode-se empregar a destilação simples; caso contrário, faz-se necessário o uso de destilação fracionada. Procedimento Experimental: PARTE I Ponto de ebulição Determinar a temperatura de ebulição do solvente orgânico, conforme Figura 12.1, utilizando tubo de Thiele ou béquer. Figura 12.1: Aparelhagem para determinação do ponto de ebulição. 52 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA PARTE II Destilação Montar aparelhagem conforme Figura 12.2. Figura 12.2: equipamento para destilação simples. Faça a destilação de uma mistura contendo 70 mL de água e 70 mL de solvente orgânico, coletando o destilado em uma proveta. Anote a temperatura do vapor logo após ser recolhida a primeira gota e, depois, a cada 10 mL de destilado. Sempre mantenha um pequeno resíduo no balão de destilação, para evitar superaquecimento e quebra da vidraria. Bibliografia: Constantino, M.G., Silva, G.V.J., Donate, P.M., Fundamentos de Química Experimental, EDUSP, 2004. 53 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA ANEXO 1 MODELO DE RELATÓRIO DAS ATIVIDADES PRÁTICAS As atividades experimentais executadas e os resultados obtidos por cada equipe, nas aulas práticas da disciplina de Química Geral, deverão ser apresentadas sob a forma de um relatório científico do grupo. A cada grupo de experimentos realizados, definidos pelos docentes, deverá ser elaborado um relatório científico, conforme o modelo. O prazo para elaboração e entrega do relatório é de uma semana, a partir da data da execução do último experimento. Os relatórios entregues em data posterior a estabelecida, serão corrigidos no seu conteúdo, porém não será atribuída nenhuma nota de avaliação. Logo, é muito importante a entrega pontual dos relatórios. Nas páginas seguintes é apresentado o modelo de relatório de atividades práticas, elaborado pela Profa. Dra. Elizabeth Fátima de Souza do Curso de Bacharelado em Química Tecnológica do Faculdade de Química – PUC-Campinas. Tal modelo deve ser seguido por todos. 54 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 55 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 56 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 57 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 58 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 59 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 60 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA ANEXO 2 EQUIPAMENTOS BÁSICOS DE LABORATÓRIO. Neste tópico é apresentada uma breve descrição dos materiais comumente usados nos trabalhos de laboratório e suas principais utilizações. Os itens estão numerados de acordo com a ilustração apresentada nas páginas seguintes. 1. Tubo de ensaio: em reações químicas, principalmente testes de reação. 2. Béquer: Para aquecimento de líquidos, reações de precipitação, etc. 3. Erlenmeyer: Para titulações e aquecimentos de líquidos. 4. Balão de Fundo Chato: Para aquecimentos e armazenamento de líquidos. 5. Balão de Fundo Redondo: Para aquecimentos de líquidos e reações com desprendimento de gases. 6. Balão de Destilação: Em destilações, possuí saída lateral para condensação dos vapores. 7. Proveta ou Cilindro Graduado: Para medidas aproximadas de volumes de líquidos. 8. Pipeta Volumétrica: Para medir volumes fixos de líquidos. 9. Pipeta Cilíndrica ou Graduada: Para medidas de volumes variáveis de líquidos. 10. Funil de Vidro: Para transferências de líquidos e em filtrações em laboratório. O funil de colo longo e estrias é chamado de funil analítico. 11. Frasco de Reagentes: Para armazenamento de soluções. 12. Bico de Bunsen: Em aquecimentos de laboratório. 13. Tripé de Ferro: Para sustentar a tela de amianto. 14. Tela de amianto: Para distribuir uniformemente o calor em aquecimentos de laboratório. 15. Cadinho de Porcelana: Para aquecimentos à seco (calcinações) no Bico de Bunsen e Mufla. 16. Triângulo de Porcelana: Para sustentar cadinhos de porcelana em aquecimentos diretos no Bico de Bunsen. 17. Estante para Tubos de Ensaio: Suporte de tubos de ensaios. 18 – 19. Funis de Decantação: Para separação de líquidos imiscíveis. 20. Pinça de Madeira: Para segurar tubos de ensaio durante aquecimentos diretos no Bico de Bunsen. 21. Almofariz e Pistilo: Para triturar e pulverizar sólidos. 22. Cuba de Vidro: Para banhos de gelo e fins diversos. 23. Vidro de Relógio: Para cobrir béqueres em evaporações, pesagens e fins diversos. 24. Cápsula de Porcelana: Para evaporar líquidos em soluções. 25. Placas de Petri: Para fins diversos. 26. Dessecador: Para resfriar substâncias em ausência de umidade. 27. Pesa-Filtros: Para pesagens de sólidos. 28. Lima Triangular: Para cortes de vidros. 29. Bureta: Para medidas precisas de líquidos. Usada em análises volumétricas. 30. Frasco Lavador: Para lavagens, remoção de precipitados e outros fins. 31. Pisseta: Para lavagens, remoção de precipitados e outros fins. 32. Balão Volumétrico: Para preparar e diluir soluções. 33. Picnômetro: Para determinar a densidade de líquidos. 34. Suporte Universal; 35. Anel para Funil; 36: Mufa; 37. Garra Metálica: Em filtrações e na sustentação de peças, tais como condensador, funil de decantação e outros fins. 38 – 39. Kitassato e Funil de Buchner: Em conjunto para filtrações a vácuo. 40. Trompa de Vácuo: Usado em conjunto com o kitassato e funil de buchner. 41. Termômetro: Para medidas de temperaturas. 42. Vara de vidro. Para montagens de aparelhos, interligações e outros fins. 43. Bagueta ou Bastão de Vidro: Para agitar soluções, transporte de líquidos nas filtrações e outros fins. 61 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 44. Furador de rolhas: Para furagem de rolhas. 45. Kipp: Para produção de gases, tais como H2S, CO2, etc. 46. Tubo em U: Usado, geralmente, em eletrólise. 47. Pinça Metálica Castelo: Para transporte de cadinhos e outros fins. 48. Escovas de Limpeza: Para limpeza de tubos de ensaios e outros materiais. 49 – 50. Pinça de Mohr e Pinça de Hoffman: Para impedir ou diminuir o fluxo de gases ou líquidos em mangueiras. 51. Garra para Condensador: Para sustentar condensadores na destilação. 52 – 53 – 54: Condensadores: Para condensar gases ou vapores na destilação. 55 – 56. Espátulas: Para transferências de substâncias sólidas. 57. Estufa: Para secagem de materiais (até 200o C). 58. Mufla: Para calcinações (até 1500o C). 62 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 63 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 64 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 65 QUÍMICA GERAL – CURSO DE BACHARELADO EM QUÍMICA TECNOLÓGICA 66
Download