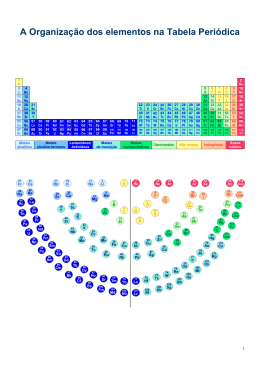
Tabela periódica Base da organização dos elementos • A tabela periódica ou classificação periódica os elementos é uma arranjo que permite não só verificar as características dos elementos , mas também fazer previsões. Dimitri Ivanovich Mendeleev foi criador da tabela periódica. Percebeu que determinadas propriedades se repetiam em função do da massa de seus átomos. Mendeleev organizou os elementos com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica. Professor Mendeleev da Universidade de San Petersburgo (Rússia) Monseley verificou que as propriedades de cada elemento eram determinadas pelo número de prótons, ou seja pelo número atômico (Z). Sabendo que num átomo o número de prótons = número de elétrons, ao fazermos a distribuições eletrônicas dos elementos verificamos que a sua semelhança de suas propriedades está relacionada com o número de elétrons de sua camada de valência. 3Li 11Na K L 2 2 1 8 M 4Be 1 12Mg K L 2 2 2 8 M 10Ne 2 18Ar K L M 2 2 8 8 8 Elementos pertencentes a uma mesma família tem o mesmo número de elétrons de valência. Elementos de mesmo período possuem o mesmo número de camadas. Classificação dos elementos químicos Uma maneiras mais usadas atualmente para classificar os elementos, é de acordo com suas propriedades físicas e químicas. Podemos dividi-los em: metais, ametais ou não metais, hidrogênio e gases nobres. Fonte: Usberco & Savador, Química Volume Único Propriedades dos elementos Metais Características: •Sólidos em temperaturas ambientes •Maleáveis •Elevadas temperatura de fusão •Bons condutores de corrente elétrica e calor; •Brilho metálico •Som característico •Densos •Dúcteis •Ferro, cobalto e níquel são atraídos por imãs; Observações: 1.Os metais alcalinos são macios (moles) e têm baixas temperaturas de fusão e ebulição. 2. O mercúrio é um líquido em temperatura ambiente. Ametais ou não-metais Características: •Baixa temperatura de fusão; •Maus condutores de eletricidade e calor; •Quando sólidos, se fragmentam; •opacos Observações: O carbono, na forma grafite, é bom condutor de corrente elétrica. Tanto na forma grafite ou diamante, apresenta elevadas temperaturas de fusão e de ebulição. Hidrogênio É um elemento atípico, pois possui a propriedade de se combinar com metais, ametais e semimetatais. Nas condições ambientes, é um gás extremamente inflamável. Gases Nobres Como o próprio nome sugere, esses elementos apresentam-se em estado gasoso nas condições ambientes. Sua principal característica química é a grande estabilidade. Elementos representativos Localizam-se nas famílias 1,2 e 13, 18. De maneira simplificada, podem ser definidos com aqueles que têm a última camada incompleta. Os elementos da família 18, os gases nobres, embora sejam considerados elementos representativos, apresentam a última camada completa. As famílias dos elementos representativos recebem nomes característicos: Visão Geral dos Elementos Grupo 1 A: Metais Alcalinos : Li, Na, K, Rb, Cs, Fr •São todos reativos, por isso são encontrados na natureza na forma de composto ( ex: NaCl) e não como substância simples. Grupo 2 A: Metais Alcalinos Terrosos : Be, Mg, Ca, Sr, Ba, Ra •Ocorrem naturalmente em compostos com exceção do Berílio (Be) •O magnésio e o cálcio (Ca) são o sétimo e o quinto elemento mais abundante da crosta terrestre. •O rádio (Ra) é radiativo e usado no tratamento de câncer por radiação. Sódio (Na) Berílio(Be) Fonte: http://canalescolar.lactogal.pt/ Grupo 4A: Família do Boro: B, Al, Ga, In, Tl •Al, Ga, In e Tl são metais. •B é um metalóide. •O boro é usado como anti-séptico e agente de limpeza; Grupo 4A: C,Si, Ge, Sn, Pb •Carbono (C)é um não-metal; •Silicio (Si) e Germânio (Ge) um metalóide ou semi metal. •Estanho (Sn) e Chumbo (Pb) são metais. Alótropos do Carbono Fonte: Usberco & Savador, Química Volume Único Grupo 5A: N, P, As, As, Sb, Bi •O nitrogênio (N), compõem aproximadamente 75% da atmosfera na forma de N2 e também faz parte de substâncias importantes como a clorofila e o DNA. •O fósforo (P) é um componente importante dos ossos e os dentes. •Possui várias formas alotrópicas, sendo os mais importantes os fósforo vermelho e branco. Fonte: Usberco & Savador, Química Volume Único Grupo 6A: O, S, Se, Te, Po •Oxigênio (O) compõe aproximadamente 20% da atmosfera na forma de O2. •Enxofre (S), Selenio (Se) e Telúrio (Te) são chamados de calcogênios, e seus compostos podem ser malcheirosos e venenoso, apesar de S e Se serem essenciais a dieta humana. •O polônio (Po), é um elemento radioativo. Grupo 7A: F, Cl, Br, I, At •Flúor (F), Cloro (Cl), Bromo (Br) e Iodo (I) existem como substâncias elementares na forma de F2, Cl2, Br2 e I2. •Reagem violentamente com outros metais formando sais. •Os Astato (At) é o elemento mais raro do mundo e não tem uma aplicação prática. Grupo 8A: He, Ne, Ar, Kr, Xe, Rn •Todos são gases e nenhum deles é abundante na Terra. • Pouco reativos. Elementos de Transição •Praticamente todos elementos de transição têm uso comerciais. ex: materiais estruturais (ferro, cromo, cobre), tintas (titânio, cromo) •A maioria ocorre naturalmente combinado com outros elementos, mas alguns como prata (Ag) e ouro (Au) podem ser encontrados como substâncias simples. Posição Elemento Abundância (ppm =g por 1000kg) 4 Ferro (Fe) 41.000 9 Titânio (Ti) 5.600 12 Manganês (Mn) 950 18 Zircônio (Zr) 190 19 Vanâdio (Vn) 160 21 Cromo (Cr) 100 23 Níquel (Ni) 80 24 Zinco (Zn) 75 25 Cério (Ce) 68 26 Cobre (Cu) 50 * fonte: Kotz , J.C., Química Geral 1 e Reações Químicas, p. 59 Lantanídeos Actinídeos •As duas fileiras na parte inferior da Tabela acomodam os Lantanídeos (série de elementos entre os elementos lantânio Z=57 e háfnio Z=72) e os Actnídeos (série de elementos entre os elementos actínio Z=89 e rutherfórdio Z=104) . •Alguns compostos de lantanídeos são usados em tubos de televisores coloridas; o urânio é usado em usinas nucleares; o amerício em detectores de fumaça. Lantanídeos Actinídeos Quantidades Relativas de Elementos Essenciais no Corpo Humano Elementos % massa Oxigênio 65 Carbono 18 Hidrogênio 10 Nitrogênio 3 Cálcio 1,5 Fósforo 1,2 Potássio, enxofre, cloro 0,2 Sódio 0,1 Magnésio 0,05 Ferro, cobalto, cobre, zinco, iodo <0,05 Selênio, flúor <0,01 * fonte: Kotz , J.C., Química Geral 1 e Reações Químicas, p. 61 Cálcio Zinco, cobre Estudar •Capítulo 2 do livro Química Geral 1 e Reações Químicas Jonh C.Kotz & Paul M. Treichel Jr.
Baixar