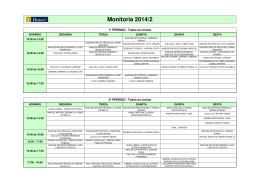
PONTO 5/3 pags. ENSINO SECUNOARIO 12. 0 ANO DE ESCOLARIDADE - VIA DE ENSINO (1. 0 e 5. 0 CURSOS) a 2. FASE Dura<;ao da prova: Ih e 30min I 1994 PROVA ESCRITA DE QUIMICA Nos exerCICIOS que envo)vam caJcu)os numericos e obrigatoria a sua apresenta~ao. DADOS QUE PODERAO SER NECESSA.RIOS Numeros atomicos: Constante de Avogadro: NA = 6,0221 10 23 mol- 1 X Velocidade da luz no vacuo: c = 2,9979 X 10 8 m s -I Constante de ionizaftio do amoniaco em agua, a 25°C: Produto ionico da agua, a 25°C: K w = 1' 00 X 10- 14 Potenciais normais de redUf;iio: EO (NO; / NO) = 0,96 V EO (Zn 2 + / Zn) =- 0,76 V V.S.F.F. 5/1 1. A energia de ligayao de ~~ K e 3,219 9 x 10 13 J I mol. correspondente variayao de massa por atomo. 2. Considere as especies quimicas Mg, CH3 CH2 CHBr CH2 CHO e SF6 AI, Calcule a C2, 2.1. Classifique as afirmayoes seguintes em verdadeiras ou/a/sas e justifique: 2.1.1. A primeira energia de ionizayao do magnesio e maior do que a do aluminio. 2.1.2. A segunda energia de ionizayao do magnesio e menor do que a terceira energia de ionizayao do aluminio. 2.2. Em relayao as especies qui micas C2 e C2 + : 2.2.1. Calcule a ordem de ligayao. 2.2.2. Compare a estabilidade das duas especies 2.2.3. lndique a especie paramagnetica e justifique. 2.3. Atenda ao composto CH3 CH2 CHBr CH2 CHO. lndique: 2.3.1. 0 nome de urn isomero de posiyao; 2.3.2. a formula de estrutura e 0 nome de urn isomero de cadeia; 2.3.3. a tormula de estrutura eo nome de urn isomero de funyao. 2.4. Em relayao a especie SF6, refira-se: 2.4.1. a geometria da molecula; 2.4.2. aos angulos das ligayoes; 2.4.3. 5/2 a natureza das foryas intermoleculares com a respectiva justifica~ao 3. Numa solw;ao aquosa de hidraxido de sadio, NaOR de massa volumica 1,180 g/mL a fracc;:ao molar de NaOH e 0,081. AI ( H20) = 18,0 g fmol Iv! ( NaOH) = 40,0 g fmol 3.1. Calcule a percentagem em massa do soluto na soluc;:ao aquosa referida. 3.2. Indique a concentrac;:ao do soluto na soluc;:ao, expressa em mol f L. 4. Num recipiente vazio. introduziu-se hidrogenocarbonato de sadio. NaHCO, (s) . e. a temperatura de 100°C, atingiu-se 0 equillbrio •1 2 NaHCO 3 ( s) ~ Na"CO, (s) -'- + CO, (g) + H,O ( g) .J it pressao total de 0,96 atm. 4.1. Calcule 0 valor de Kp (com pressoes em atm ). 4.2. A temperatura referida. reduziu-se 0 volume do recipiente a metade. Re1ativamente aos dois estados de equilibrio, compare, apresentando a respectiva justifica~ao: 4.2.1. as quantidades de C02 ( g) e de H20 ( g ); 4.2.2. as pressoes parciais de C02 ( g) e de H20 ( g). 5. A 25°C. uma soluc;:ao aquosa de cloreto de amanio, NH4C1, tern pH = 5,13. 5.1. Calcule a concentrac;:ao do sal (considere-o completamente dissociado ). 5.2. Indique 6. ° 0 valor da concentrac;:ao de OH- na soluc;:ao. <icido nitrico, HN03, reage com 0 ZInCO libertando NO. 6.1. Escreva a respectiva equac;:ao quimica. 6.2. Calcule a variac;:ao do numero de oxidac;:ao da especie que e reduzida. 6.3. Indique 0 agente redutor e justifique. V.S.F.F. 5/3 PONTO 5 -) PONTO 5/C/2 pags. ENSINO SECUNOARIO 12. 0 ANO DE ESCOLARIDADE - VIA DE ENSINO 0 0 (1. e 5. CURSOS) z." FASE Duracao da prova: Ih e 30min 1994 PROVA ESCRITA DE QUIMICA CRITERJOS DE CORRECCAO / COTACOES NOTA 1 : Por cada questao nao descontar mais do que urn ponto por unidades erradas ou omitidas. NOTA 2: Nao deverao ser penalizados os erros de calculo, uma vez que e permitido 0 uso de maquina de calcular. NOTA 3: Devera ser atribuida a cotacao total a qualquer processo de resolucao desde que correcto. NOTA 4: As cotacoes parcelares so deverao ser tomadas em consideracao, quando a resposta nao estiver totalmente correcta. NOTA 5: Sempre que 0 aluno utilize resultados errados obtidos em exercicios anteriores, nao devera ser, por esse facto, novamente penalizado. 1. 12 pontos Reducao da energia a J Expressao de ~E Calculo de /sm = 5.9493 x 10- .:'xkg 3 pontos 3 pontos 6 pontos 2. 2.1. 2.1.1. 2.1.2. 2.2. 2.2.1. Distribuicao electronica Ordem de ligacao 2.2.2. 2.2.3. 2.3. 2.3.1. 2.3.2. 2.3.3. 68 pontos 11 pontos ( 1 +3 ) ( 1+ 6 ) 4 pontos 7 pontos 21 pontos 11 pontos 8 pontos 3 pontos (2 t 4 ) 4 pontos 6 pontos 21 pontos (4 + 4 ) (4 +5) 4 pontos 8 pontos 9 pontos V.S.F.F. 5/C/1 2.4. 2.4.1. 2.4.2. 2.4.3. 15 pontos 4 pontos 4 pontos 7 pontos (2 + 5 ) 3. 3.1. 33 pontos 20 pontos Quantidades do soluto e do solvente Calculo de: massas do soluto e do solvente percentagem do soluto ( 16,4 0,,10 ) 6 pontos 4 pontos 10 pontos 3.2. 13 pontos Calculo de: volume de solucao concentracao do soluto [ NaOH] = 4,83 mol / L 8 pontos 5 pontos 4. 4.1. 33 pontos 11 pontos Calculo das pressoes parciais Expressao de Kp Calculo de Kp = 0,23 4.2. 4.2.1. 4.2.2. 6 pontos 3 pontos 2 pontos 22 pontos (3+10) (3+6) 13 pontos 9 pontos 5. 5.1. 32 pontos 27 pontos Equacao de dissociacao do sal Reaccao de NH4+ com H2O Expressao de Ka Calculo de Ka Calculo de: [H3 0+ ] [ NH4+ ] [ N~Cl] = 9,8 x 10-2 mol / L 5.2. [OH-] 5 pontos 10 pontos 2 pontos 5 pontos = 1,35 x 10-9 mol / L 6. 6.1. 6.2. 6.3. COTACAO TOTAL 5/C/2 2 pontos 3 pontos 2 pontos 3 pontos 22 pontos (2+4) 10 pontos 6 pontos 6 pontos 200 pontos
Download