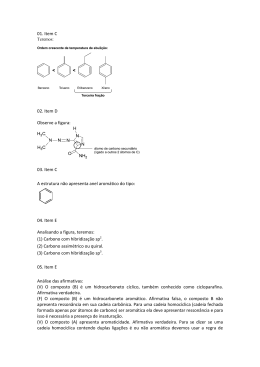
Professor: o 3 ano ARILSON Aula 2 - Introdução a química orgânica Classificação das cadeias carbônicas 1)Quanto ao fechamento da cadeia N Abertas ou acíclicas ou alifáticas CH3 Os carbonos das extremidades não estão ligados. Não apresentam ciclos (anéis). Normais ou retas sou lineares São aquelas que apresentam somente duas extremidades de carbono quando abertas ou nenhuma quando são fechadas. Existe uma única sequência de carbonos na cadeia. Fechadas ou cíclicas ou cicloalifáticas ou alicíclicas Os carbonos das extremidades estão ligados formando ciclos (anéis). 3)Quanto aos tipos de ligação Saturadas Apresentam somente ligações simples entre os átomos de carbono. O OH Observação: Cadeias fechadas ramificadas podem ser classificadas como mistas. Apresentam ligações duplas ou triplas entre os átomos de carbono. 2)Quanto à disposição dos átomos Insaturadas Observação: Ramificadas Todo composto que possui ligações π é um composto insaturado, no entanto, a sua cadeia pode ser saturada. É São aquelas que apresentam no mínimo três extremidades importante não confundir o critério de classificação de “cadeia” e de carbono quando são abertas ou no mínimo uma extremidade de “composto” quanto aos tipos de ligação. carbono fora do ciclo quando são fechadas. A presença de pelo menos um carbono terciário e/ou quaternário também torna a cadeia ramificada. O N Cadeia saturada não possui ligação entre carbonos Composto insaturado possui ligação 1 4)Quanto à natureza dos átomos Homogêneas Não possuem nenhum átomo diferente de carbono entre carbonos. Núcleos condensados Resumo de classificação de cadeias Heterogêneas Possuem pelo menos um átomo diferente de carbono entre carbonos que é denominado de heteroátomo. Observação: As cadeias fechadas homogêneas podem ser classificadas como homocíclicas e as fechadas heterogêneas como heterocíclicas. Cl Homocíclica O Heterocíclica Classificação das cadeias carbônicas aromáticas Os critérios de classificação de cadeias aromáticas são os seguintes: Classificação de compostos orgânicos 1)Quanto ao número de núcleos benzênicos Com base no tipo de cadeia carbônica os compostos orgânicos podem ser classificados em três grandes grupos: Mononuclear Possui um único núcleo benzênico Heterocíclicos Possuem cadeia carbônica heterocíclica. O S Polinuclear Possui mais de um núcleo benzênico que podem estar isolados (separados) ou condensados (juntos). Aromáticos Possuem núcleo benzênico. Núcleos isolados 2 Alifáticos Todo composto que não é aromático ou heterocíclico é alifático, ou seja, são os demais. H3C CH CH3 N OH H O Observação: Devemos ter muito cuidado com o termo alifático. Em classificação de “cadeias” alifático é sinônimo de cadeia aberta e em classificação de “compostos” alifático é um composto que não é aromático ou heterocíclico.Observe o exemplo a seguir: O círculo representa o movimento contínuo e deslocalizado dos elétrons pi dos átomos de carbono. Ressonância “É uma mistura de estruturas com o mesmo arranjo de átomos, mas com arranjo de elétrons diferente. Isto diminui a energia da molécula e aumenta a sua estabilidade”. Classificação da cadeia Cadeia fechada Classificação do composto Composto alifático Regra de Hückel Compostos aromáticos Em 1931, o físico Erich Hückel criou uma equação matemática tendo como base a mecânica quântica, que permite avaliar se um composto é aromático ou não. Para ser aromático, o composto deve ser cíclico, planar, e deve possuir uma nuvem contínua de elétrons pi deslocalizados. São compostos que possuem núcleo benzênico ou obedecem a regra de Hückel. O benzeno é o principal representante da classe dos aromáticos. 4n + 2 = no de elétrons pi Para ser aromático, o composto deve ser cíclico, planar, e deve possuir uma nuvem contínua de elétrons pi deslocalizados. Quando n = 0, 1, 2, 3 ..., o sistema será aromático, caso contrário não o será.Observe a aplicação da equação de Hückel nos compostos a seguir: Histórico do benzeno 4n + 2 = 10 n=2 Descoberto por Michael Faraday em 1825. Sua fórmula molecular (C6H6) foi estabelecida nove anos depois. Sua fórmula estrutural só foi estabelecida em 1865 por Kekulé, segundo o que sabe, após um sonho. Kekulé usou uma simbologia dos alquimistas o ouroboros, para representar o seu sonho. Aromático 4n + 2 = 18 n= 4 Aromático Estruturas canônicas O benzeno possui duas estruturas canônicas. 4n + 2 = 8 n = 1,5 não é aromático No benzeno, verifica-se que todas as ligações têm o mesmo comprimento (1,4Å) indicando, portanto, que nenhuma das duas estruturas canônicas é a estrutura real. As ligações do benzeno possuem comprimentos intermediários entre a simples (1,54Å) e a dupla(1,34Å) devido à ressonância dos elétrons pi. A estrutura real é um híbrido de ressonância das estruturas canônicas. Ligação Ordem C─C C=C C≡C 1 2 3 Comprimento (pm) 154 134 121 Piridina 4n + 2 = 6 3
Baixar