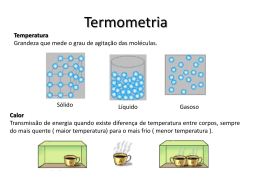
1 Ficha de Identificação da Produção Didático-Pedagógica Titulo: PRODUÇÃO DE MATERIAL DIDÁTICO EM FÍSICA, VISANDO A UMA MELHOR APREENSÃO DOS CONCEITOS. Autor: Alois Fudal Disciplina/Área: Física Escola de Implementação do Colégio Estadual São Cristóvão Projeto: Município da Escola: União da Vitória Núcleo Regional de União da Vitória Educação: Professor Orientador: Antônio José Camargo Instituição de Ensino Universidade Estadual de Ponta Grossa - UEPG Superior: Relação Interdisciplinar: Matemática e Química Resumo O Ensino de Física, na maioria das escolas ainda acontece de maneira descontextualizada. Percebem-se professores mais preocupados em repassarem grandes quantidades de conteúdos que enfatizam a Resolução de Problemas em situações matemáticas. Esta Unidade Didática propõe desenvolver atividades experimentais de Física na 2ª Série do Ensino Médio do Colégio Estadual São Cristóvão, no município de União da Vitória no interior do estado do Paraná. Com a intenção de mudar as práticas pedagógicas desenvolvidas em sala de aula, e melhorar a aprendizagem dos conteúdos de termodinâmica, serão construídos experimentos com os discentes, utilizando materiais de baixo custo, que poderão ser confeccionados na sala de aula, em grupos de quatro estudantes e com o apoio do professor da disciplina de Física. Para tanto a produção de materiais didáticos, explorará ao máximo a física presente, que poderá proporcionar uma aprendizagem significativa do conhecimento e a visualização de um universo que até então era desconhecido. Ao final deste projeto espera-se que os alunos tenham aprendido a Física de uma maneira prática, fácil e aplicável ao cotidiano. Palavras-chave: Ensino de Física; Atividade Experimental; Material Didático de Física; Aprendizagem Formato do Material Didático: Público-Alvo: Unidade Didática Alunos da 2ª série do Ensino Médio 2 SUMÁRIO LISTA DE FIGURAS ................................................................................................... 3 1. DADOS DE IDENTIFICAÇÃO ................................................................................ 4 2. TEMA DE ESTUDO ................................................................................................ 4 3. TÍTULO ................................................................................................................... 4 4. APRESENTAÇÃO ................................................................................................... 5 5. HISTÓRICO ............................................................................................................ 7 6. ORIENTAÇÕES METODOLÓGICAS ................................................................... 13 7. MATERIAL DIDÁTICO .......................................................................................... 14 7.1 TERMODINÂMICA.......................................................................................................... 14 7.2 ESCALAS TERMOMÉTRICAS ..................................................................................... 18 7.3 TRANSMISSÕES DE CALOR..............................................................................21 7.3.1 CONDUÇÃO DO CALOR ........................................................................................... 21 7.3.2 CONVECÇÃO DO CALOR ........................................................................................ 24 7.3.3 IRRADIAÇÃO DO CALOR ......................................................................................... 26 7.4 TROCAS DE CALOR ................................................................................................... 29 7.5 PRINCÍPOS DA TERMODINÂMICA...................................................................35 8. TESTE....................................................................................................................41 9. REFERÊNCIAS ..................................................................................................... 43 3 LISTA DE FIGURAS Figura 1 - Termômetros ............................................................................................. 15 Figura 2 - Kit experimental 1 ..................................................................................... 15 Figura 3 - Experimento 1 ........................................................................................... 16 Figura 4 - Escalas termométricas .............................................................................. 19 Figura 5 - Relações entre escalas ............................................................................. 19 Figura 6 - Kit experimental 2 ..................................................................................... 22 Figura 7 - Kit experimental 2 ..................................................................................... 22 Figura 8 - Atividade experimental .............................................................................. 23 Figura 9 - Atividade experimental .............................................................................. 23 Figura 10 - Material do do kit experimental 3 ............................................................ 25 Figura 11 - Kit experimental 3 .................................................................................... 26 Figura 12 - Material do kit experimental 4 ................................................................. 27 Figura 13 - Kit experimental 4 ................................................................................... 27 Figura 14 - Atividade experimental ............................................................................ 28 Figura 15 - Material do kit experimental 5 ................................................................. 31 Figura 16 - Kit experimental 5 ................................................................................... 32 Figura 17 - Material da atividade experimental .......................................................... 33 Figura 18 - Ciclo de Carnot ....................................................................................... 37 Figura 19 - Material do kit experimental 6 ................................................................. 38 Figura 20 - Kit experimental 6 ................................................................................... 39 4 1. DADOS DE IDENTIFICAÇÃO Professor PDE: Alois Fudal Área: Física NRE: União da Vitória Professor Orientador IES: Prof. Ms. Antônio José Camargo IES vinculada: UEPG Escola de Implementação: Colégio Estadual São Cristóvão Público objeto da intervenção: 2ª Série do Ensino Médio 2. TEMA DE ESTUDO: Termodinâmica 3. TÍTULO: Produção de material didático em Física, visando a uma melhor apreensão dos conceitos 5 4. APRESENTAÇÃO O Ensino de Física na maioria das escolas brasileiras, do ponto de vista histórico durante muitos anos acontece, sob a orientação de livros didáticos, prevalecendo muito o formalismo científico, com ênfase em problemas e cálculos. A Física, por natureza é uma Ciência experimental, onde o conhecimento científico pode ser comprovado com experimentos. Na maioria dos livros didáticos, as atividades práticas estão colocadas no final dos capítulos de forma que não é dada muita importância a sua realização, totalmente desvinculada do conteúdo. Também os laboratórios de Ciências das escolas encontram-se abandonados, sem manutenção, devido a pouca vontade política em nosso país, em fornecer para as escolas, materiais de laboratório de boa qualidade e capacitação para os professores. Outro fator que contribui para a pouca frequência de atividades experimentais é a falta de empenho dos docentes em apoiar a aprendizagem de conceitos, na execução de atividades experimentais. Desta forma, uma prática pedagógica com a utilização de experimentos dificilmente acontece no decorrer das aulas. Isto posto surge a seguinte questão: a confecção e utilização de experimentos pelos discentes em sala de aula, melhora a compreensão dos conceitos da Física? Com o intuito de responder essa indagação, pretendemos com este material, propiciar aos alunos da 2ª Série do Ensino Médio, atividades experimentais e confecção de kits experimentais visando à melhoria do Ensino de Física. Os alunos chegam à escola, trazendo conceitos e compreensões do ambiente em que vivem, pois suas mentes já construíram conhecimentos sobre os diversos fenômenos físicos, do meio em que está inserido, assim este conjunto de informações trazidas por eles, devem ser trabalhadas, de forma que venham a ser organizadas para tornar a aprendizagem significativa. Desta maneira todo o conhecimento construído de forma intuitiva deve ser comprovado experimentalmente, visando uma aproximação com o conhecimento produzido pela comunidade científica. Sabemos de antemão que os aprendizes nutrem relevante interesse por atividades experimentais, fator esse que colabora significativamente com nossa tarefa. Ao enfatizar o tema calor, partimos do problema a ser estudado levantando hipóteses e 6 testando-as com a construção de experimentos. Ao comprovarmos um conceito contribuímos para a apreensão deste dentro do paradigma que abrange. A não comprovação, ou seja, a contra prova, implica em explorarmos novos caminhos que visem uma explicação galgada numa forma diferenciada de ver o mundo, um novo paradigma. Novas explicações, novos modelos enfim a substituição de teorias é um acontecimento mais frequente do que imaginamos. A Ciência não esta pronta e sim em permanente construção, abarcando novas interpretações. Os experimentos realizados deverão normalmente comprovar uma teoria científica aceita pela comunidade científica contemporânea, ou suscitar novos questionamentos, atividade essencial para a construção do conhecimento. 7 5. HISTÓRICO Uma teoria sobre a origem da vida na Terra, afirma que a cerca de 4 bilhões de anos, um relâmpago atingiu uma quantidade de água contendo uma rica mistura de elementos químicos, formando aminoácidos, que são elementos formadores da vida no planeta. Com essa quantidade de calor começou a vida e até hoje para o nascimento e a permanência da vida precisamos um mínimo de calor. Com a descoberta do fogo pelo homem das cavernas, a utilização do calor serviu, para mantê-lo aquecido nos períodos frios do ano. A mulher pré-histórica, talvez fosse quem fez as primeiras aplicações do calor, ao aquecer alimentos tornando-os mais fáceis de ingestão. As sensações de quente e frio são inatas do homem, bem como de outros seres vivos e muitas vezes são enganosas aos nossos sentidos, pois podemos ser queimados por um ferro em brasa ou por um pedaço de gelo seco, sendo as sensações fisiológicas as mesmas, reportando-se a Baeyer: Seja lá como for, o aquecimento é exigido não apenas pelo embrião desde o momento da concepção, mas, em uma escala mais ampla, pela própria vida. Todos os animais necessitam de calor para sobreviver, embora em alguns casos não precisem de muito. (BAEYER,1994, p.163) Em nível microscópico, a matéria é constituída por átomos e moléculas que são partículas que estão em movimento constante, dependendo do estado de agregação. O movimento das partículas é devido à energia cinética, e a soma da energia de uma porção dessas partículas da matéria é denominada energia térmica. Toda a matéria é constituída de moléculas que representam a menor parte da matéria, capazes de manter características dessa substância, diferenciando assim uma substância de outra substância. Essas moléculas possuem determinada energia cinética, que produzem nelas um movimento contínuo. A distância entre essas moléculas é na ordem de 10-6 cm, e estão sob a ação de forças intermoleculares (forças elétricas), que variam de substância para substância e até na mesma substância, de acordo com estado físico (sólido, líquido, gasoso,...). O número de moléculas de uma substância é muito grande e as velocidades dessas moléculas são diferentes entre si, então para determinar a energia interna de um corpo fazemos uma média da energia cinética de todas as moléculas. O calor e a temperatura são denominações que damos em nosso cotidiano, 8 quando sentimos essas variações em relação à sensação térmica do nosso tato com o ambiente em que nos encontramos. A época do ano, determinado período do dia, quando bebemos um copo de água, percebemos muitos acontecimentos que provocam essas sensações, e são controladas pelo próprio homem, como o aquecimento ou resfriamento de alimentos, o funcionamento de máquinas, o atrito entre as mãos, o movimento do próprio homem. Fenômenos naturais como as tempestades, o granizo, a geada, a chuva, a temperatura do nosso corpo, o calor do Sol, são manifestações de processos térmicos. A compreensão de conceitos de calor e temperatura são fundamentais e necessários para o entendimento dos processos térmicos que sentimos em nosso cotidiano, através do sentido do tato. Assim sendo, a nível macroscópico a temperatura indica o estado de quente ou de frio de um sistema. Quando verificamos a temperatura de um corpo, a nível estrutural da matéria, ela está associada à sua energia interna, conforme Delizoicow e Angoti (1992, p. 108) “do resultado do trabalho caótico das partículas, e a sua propagação depende de um desnível térmico”. A temperatura não depende do número de moléculas em movimento, mas da velocidade média destas que com essa observação permitem definir também o caráter macroscópico dessa grandeza. O primeiro dispositivo para verificar a temperaturas dos corpos foi inventado por Galileu Galilei em 1592, denominado termoscópio. Ele usou um frasco de vidro com um bulbo e um gargalo estreito. Este frasco era preenchido com água colorida até a metade e colocado de boca para baixo em uma bacia contendo água colorida. No bulbo desse frasco formava um espaço com ar, que em contato com outro corpo pode sofrer variação da temperatura, e o ar pode expandir ou contrair, e a coluna de água colorida no tubo também se movimentava para baixo ou para cima. As medidas de temperaturas feitas com termoscópios eram por comparar a temperatura de dois objetos, por meio da dilatação do ar contido no bulbo. A marcação da temperatura entre os corpos e a falta de uma graduação padrão ficava confusa na comparação de resultados. Mais tarde em 1635, o Duque Fernando de Toscana, construiu um dispositivo que era feito de um tubo de vidro, preenchido com álcool e fechado para não ocorrer evaporação, chamando o dispositivo de termômetro, mais tarde ainda sendo aperfeiçoado com o uso do mercúrio, sendo o termômetro moderno que conhecemos hoje. Para fazer a medida da temperatura de um corpo usamos aparelhos denominados termômetros. O conjunto de números que o termômetro é 9 graduado dá-se o nome de escala termométrica e as escalas mais utilizadas são a escala Celsius, a escala Fahrenheit e a escala Kelvin. Para criar uma escala termométrica, é necessário escolher temperaturas de referência, e fixas, que sempre se repetem, permitam intervalos de temperaturas entre fenômenos e que sempre se reproduzam em mesmas condições. Muitas temperaturas de referência foram testadas, como a temperatura do inverno, do verão, da neve e do corpo de vários animais. Mas foi no séc. XVIII que o francês René de Réaumur (1683 – 1757) ao utilizar várias substâncias diferentes como o álcool, água e mercúrio, propôs a utilização de pontos fixos, a fusão do gelo e a ebulição da água, permanecendo estes pontos até hoje. No ano de 1730 René de Réaumur propôs para o seu termômetro, 80 ºR para a fusão do gelo e 0 ºR para a ebulição da água. O astrônomo e físico sueco Anders Celsius em 1742 em seu termômetro, usou os mesmos fenômenos para os pontos fixos e adotou 0 ºC para a ebulição da água e 100 ºC para a fusão do gelo, chamando a escala de centígrada. A escala criada por Celsius foi aperfeiçoada oito anos mais tarde por Märten Strömer, que inverteu os valores dos pontos fixos e sendo assim conhecida até os dias atuais. O estudioso de Química e Física Daniel Gabriel Fahrenheit (1686–1736), nasceu em Danzig, hoje Gdansk, na Polônia. Na escala criada por ele era adotado para ponto de referência inferior uma mistura de sal, amônia e gelo. Para ponto superior a temperatura do corpo humano, ficando o intervalo entre 0 ºF e 100 ºF. Mais tarde fixou valores de 32 ºF para o gelo e 212 ºF para a ebulição da água. O cientista inglês Willian Thompson (1824 – 1907), mais conhecido por seu título de nobreza Lord Kelvin foi o primeiro cientista a afirmar teoricamente a existência de uma temperatura mínima, em que as partículas elementares cessariam todo o movimento, e não teriam energia cinética. Então a escala proposta por Kelvin foi chamada de escala absoluta, ele atribuiu a esse estado da matéria o zero Kelvins (0 K), conhecido por zero absoluto e por convenção não se usa a denominação grau, pronunciando quelvins. A escala Kelvin e centesimal e nela atribui-se o valor de 273 K para a fusão gelo e 373 K para o ponto de ebulição da água. O calor é como a água da chuva que observamos em um dia chuvoso. Se houver um desnível no terreno a água fluirá espontaneamente do nível mais alto para o nível mais baixo até ocorrer o equilíbrio, isto é, até toda a água ficar no mesmo nível. Como a água da chuva sempre flui para o menor nível, o calor fluirá 10 espontaneamente do corpo de maior temperatura para o corpo de menor temperatura, até ocorrer o equilíbrio térmico. Uma pequena parte da radiação emitida pelo Sol atinge a Terra. Essa forma de propagação do calor é denominada irradiação, que ao interagir com os gases da atmosfera provoca o aquecimento da massa de ar, da parte líquida e da parte sólida do planeta, provocando os movimentos das massas de ar e também ocorrendo o ciclo da água, como cita Delizoicow e Angotti (1992, p. 102) ”O Sol emite uma variedade de frequências, sendo só uma pequena faixa visível, com a composição branca devido à mistura das cores. Uma faixa importante, responsável pela transmissão do calor, é a do infravermelho (frequências variam de 10 10 a 1014 Hz).” Na atmosfera terrestre também ocorre o efeito estufa, que cria uma barreira natural aos raios infravermelhos e impede que a radiação solar após incidir na Terra retorne ao espaço. É devido a esse efeito que a temperatura em torno da Terra se mantém, possibilitando a existência da grande quantidade de espécies vivas. O nível macroscópico pode definir calor, como sendo a energia térmica em movimento, que se transfere espontaneamente do corpo de maior temperatura para o corpo de menor temperatura. O primeiro estudo sobre o calor, como uma entidade física definida, e que pode ser medida foi feita pelo médico escocês chamado James Black (1728 – 1799). Ele misturou um galão de água em ebulição, com um galão de água gelada e observou que a temperatura resultante da mistura estabilizou entre as temperaturas inicias das duas quantidades de água. Ele definiu a unidade de calor como a quantidade de energia necessária para elevar a temperatura de uma librapeso de água em 1 °F. No sistema atual falamos de caloria, que é a quantidade de calor necessária para elevar em 1 °C a temperatura de um grama de água. Black denominou o calor como sendo um fluido capaz de interpenetrar todos os corpos materiais, fazendo aumentar sua temperatura. Este modelo propunha que todos os corpos possuíam, em seu interior uma substância invisível com massa desprezível denominada calórico. Esta teoria foi válida por muitos anos, mas foi Benjamim Thompson conhecido como conde Rumford que trabalhando em uma fábrica de armas, em Munique observou que as peças metálicas ao serem perfuradas ficavam mais aquecidas quando a broca estava cega. O aquecimento da broca cega era devido ao atrito entre as peças, isto fez a teoria do calórico tornar-se inconsistente, surgindo a ideia que o calor é energia e não substância. Anos mais tarde James P. Joule (1818 – 1880) usando o equipamento 11 equivalente mecânico do calor, estabeleceu definitivamente que o calor é uma forma de energia ao demonstrar a relação entre caloria (unidade de calórico) e Joule (unidade de energia: 1 cal – 4,18 J). Em nosso cotidiano, deparamo-nos com situações, nas quais podemos perceber que o aquecimento de objetos é devido ao atrito entre as superfícies de contato. A energia mecânica é convertida integralmente em energia interna e, em seguida, em calor. Também podemos observar que o calor produz movimento, que são aplicados em sistemas que estão a serviço do homem, como nas termoelétricas, nos motores de explosão dos automóveis, nas turbinas a vapor, etc. A humanidade no séc. XVII fez a revolução industrial, com a descoberta da máquina a vapor, ao ser empregada na geração de energia mecânica, para o movimento de máquinas. Com a equivalência entre calor e energia mecânica estabelecida por Sadi Carnot, foi determinada a primeira lei da termodinâmica. Sabendo que o calor flui do corpo mais quente para o mais frio, e nunca em direção oposta, assim a primeira Lei da Termodinâmica mostra que a quantidade de energia(Q) recebida por um sistema pode realizar um trabalho (Ƭ), expandindo-se ou contraindo-se, e provocando uma variação (ΔU) da energia do sistema. Q = Ƭ +ΔU A eficiência de uma máquina térmica sempre gerou preocupação e foi objeto de pesquisa, pois sempre se procura produzir mais trabalho com menos consumo de energia, buscando ter 100 % de rendimento, como cita GAMOW: A declaração de que é impossível transformar calor em energia mecânica sem que mais calor “dessa” de um lugar mais frio é conhecida como “segunda lei da termodinâmica”. É equivalente à declaração de que calor não fluiria por si de um lugar mais frio para um mais quente. Na verdade, se pudéssemos persuadir o calor a fluir por si do resfriador para a caldeira, teríamos um círculo calórico vicioso e as máquinas a vapor operariam sem combustível. Um dispositivo semelhante seria o da água escoando por si morro acima e depois caindo sobre a roda do moinho. (GAMOW, 1963, p.111) O calor é uma forma de energia, sendo possível transformá-la em energia mecânica. As máquinas térmicas são dispositivos que através da realização de trabalho a partir do calor, podem transforma-lo em movimento. Foi o grego Heron no séc. 1 d.C., na cidade de Alexandria, que inventou a 12 máquina térmica sem fins práticos. No séc. XVIII foram construídos os primeiros modelos de máquinas térmicas, mas com baixo rendimento. O escocês James Watt desenvolveu um modelo de máquina térmica com melhor desempenho, sendo usada nas minas de carvão, para acionar bombas de água, locomotivas e na indústria. Já no séc. XX surgiram outros modelos de máquinas térmicas, como os motores de explosão usados nos automóveis. 13 6. ORIENTAÇÕES METODOLÓGICAS Para auxiliar na coleta de informações, iniciaremos aplicando um teste com questões de múltipla escolha e descritivas, relacionadas ao cotidiano das pessoas e com conteúdos de Termodinâmica. Ao finalizar o projeto, o mesmo teste será aplicado, com o objetivo de ao analisar os resultados dos dois testes auxiliarem na elaboração do artigo final, da Implementação desta produção didático-pedagógica. Esta produção reúne algumas experiências que podem ser confeccionadas em sala de aula, em grupos de quatro alunos, com material de baixo custo que podem ser encontrados no comércio de qualquer cidade. É necessário que o professor oriente os grupos de alunos na confecção dos kits experimentais, sempre partindo de um problema, lançando questões para serem discutidas nos grupos, testadas com a atividade experimental e retomadas numa discussão com todo o grupo para a formação dos conceitos a partir do problema estudado. Durante o período da aplicação da produção, serão feitas avaliações qualitativas incorporadas às avaliações formais da escola, permitindo a promoção do aluno. 14 7. MATERIAL DIDÁTICO 7.1 TERMODINÂMICA As sensações de quente ou de frio são percebidas pelo ser humano e a maioria dos animais através do tato. As variações da temperatura que nós sentimos, ocorre devido ao calor, que é uma forma de energia, que se transfere do corpo com maior temperatura para o corpo com menor temperatura, geralmente ocorrendo o equilíbrio térmico. Para melhorarmos ou diminuirmos essa troca de energia térmica em trânsito, é necessário utilizar mecanismos de controle e de avaliação de temperatura. Na natureza, os animais e os vegetais fazem o controle natural de temperatura com mecanismos reguladores, pois uma leve variação da temperatura do nosso corpo já é um alerta de que a nossa saúde não está boa. No decorrer de sua evolução o homem desenvolveu formas de controle de temperatura. Algumas formas empíricas e eficientes outras mais técnicas e eficientes comtemplando a utilização de termômetros. O controle natural de temperatura, só ocorre em organismos vivos. Já nos sistemas construídos pelo homem são utilizados reguladores de temperatura. - Todos nós percebemos que em dias muito quentes, nós produzimos suor que ao evaporar, resfria o nosso corpo. Por que isso ocorre? - Você já pensou qual a função térmica dos pelos em muitos animais, das penas nas aves e do vestuário em nosso corpo? - Qual o valor da temperatura de ebulição da água em nossa cidade? - Qual é a temperatura, que nos não sentimos o calor e nem o frio? - Em dias frios o nosso organismo acelera a queima de energia disponível em nosso corpo, se comparada com a mesma atividade realizada em um dia quente. Por quê? - Por que a água cozinha o pastel e o óleo frita o pastel? - Como os nossos antepassados avaliavam a temperatura de um doente e como é feita a essa avaliação hoje? - Explique por que os alimentos são cozidos antes em uma panela de pressão do que numa panela comum? - Qual é a temperatura normal do nosso corpo? 15 A avaliação da temperatura de um sistema feito através do nosso tato nos dá apenas uma ideia aproximada da temperatura, um valor qualitativo. Para fazermos uma avaliação quantitativa da temperatura de um sistema a nível microscópico precisamos utilizar um aparelho chamado termômetro. No mercado encontramos uma vasta quantidade de tipos de termômetros, desde o mais rudimentar, como o termômetro clínico aos mais modernos a lazer, como podemos ver na figura 1. Figura 1 - Termômetros Fonte: Fudal, 2012 A seguir com alguns materiais, vamos confeccionar um termômetro rudimentar, que ajudará você a compreender o funcionamento de um termômetro clínico como mostra a figura 2. KIT EXPERIMENTAL 1 Objetivo Confeccionar um termômetro rudimentar. Materiais 1 tubo de pequeno diâmetro 1 vidro de remédio com tampa de borracha Figura 2 - Material do kit experimental 1 Fonte: Fudal, 2012 16 Procedimento Faça um pequeno furo na tampa de borracha do vidro, com diâmetro igual ao do tubo. Coloque o tubo de pequeno diâmetro no orifício da tampa e feche o vidro. Está pronto o seu kit experimental 1, para ser utilizado na atividade a seguir. ATIVIDADE EXPERIMENTAL Objetivo Verificar e entender o funcionamento de um termômetro. Material - água colorida - kit experimental 1 - 1 termômetro Procedimento Pegue o frasco de vidro e encha com água colorida e tampe, segure o vidro envolvendo-o com a mão, por alguns minutos e observe o comportamento da coluna de líquido no interior do tubo como mostra a figura 3. Se você fosse graduar o maior nível indicado na coluna de líquido em equilíbrio registrado, quando o frasco de vidro estiver envolvido com as mãos, que valor você marcaria? Para melhor compreender o funcionamento do termômetro mergulhe o frasco de vidro em água quente, em água fria e em água morna. Agora você poderá fazer o mesmo processo, utilizando um termômetro para comparar com os valores registrados e também poderá criar sua própria escala termométrica. Figura 3 - Experimento 1 Fonte: Fudal, 2012 17 Questões 1- Como você faria para graduar um termômetro sem ter conhecimento de outra escala? 2- As escalas mais usadas são a escala Celsius, a escala Fahrenheit e a escala Kelvin. Qual o valor nessas escalas termométricas que corresponde a temperatura de fusão do gelo e da ebulição da água sob pressão normal? 3- Como você explica o funcionamento de um termômetro de mercúrio? 4- São várias as substâncias termométricas, entre elas o mercúrio, uma mistura de álcool, corante e querosene. Por que a água não é considerada uma boa substância termométrica? 5- Para medir a temperatura de um corpo, o termômetro deve permanecer algum tempo em contato com o corpo. Em que momento o termômetro indicará a temperatura do corpo? ATIVIDADE EXPERIMENTAL 2 Objetivo Calcular a dilatação volumétrica aparente do líquido Material 1 régua 1 kit experimental 1 Procedimento Encha o frasco de vidro com 10 cm3 de água da torneira, verifique e anote a temperatura que deve ser em torno de 20 ºC. Ajuste a coluna líquida na menor posição no capilar, em relação à tampa de borracha do frasco, isto você faz retirando ou introduzindo o capilar no frasco de vidro. Aqueça o conjunto em uma chama e observe o aumento do líquido no capilar, retire a tampa do frasco e rapidamente coloque o bulbo do termômetro dentro do líquido e marque a temperatura final que poderá ser 50 ºC. Agora poderemos calcular aumento aparente do líquido no capilar, com a diferença entre dilatação real do líquido e a dilatação do vidro. ∆Vaparente=∆Vreal-∆Vvidro → v0.αaparente.∆t=v0.αreal.∆t-v0.αvidro.∆t → αaparente=αreal-αvidro αvidro=3.10-5 /ºC αágua=1,3.10-4 /ºC 18 αaparente=αreal-αvidro αaparente=1,3.10-4 - 3.10-5 αaparente=10.10-5/°C αaparente=1.10-4/ºC ∆Vaparente= v0.αaparente.∆t ∆Vaparente=10. 1.10-4.30 ∆Vaparente=10. 1.10-4.30 ∆Vaparente =300.10-4cm3 ∆Vaparente=3.10-2cm3 ∆Vaparente= 0,03 cm3 7.2 ESCALAS TERMOMÉTRICAS As escalas mais utilizadas são a escala Celsius, a Fahrenheit e a Kelvin. A escala proposta por Kelvin foi chamada de escala absoluta, por afirmar a existência teórica de uma temperatura mínima, e atribuiu a este estado o zero Kelvin (0 K), conhecido por zero absoluto e por convenção não se usa a denominação grau, somente pronunciando quelvins. Observem na figura 4 os valores do zero absoluto nas três escalas. A escala Kelvin é centesimal e nela atribui-se o valor de 273 K para a fusão gelo e 373 K para o ponto de ebulição da água. A escala Celsius é a mais usada, ela foi construída por Anders Celsius, e adota para o ponto de gelo 0 ºC e para a ebulição da água 100 ºC, ao nível do mar. A escala construída por Daniel Gabriel Farenheit, usada nos países de língua inglesa, adota para a fusão do gelo 32 ºF e para a ebulição da água 212 ºF. 19 Figura 4 - Escalas termométricas Fonte:http://educacao.uol.com.br/fisica/temperatura-escalas-termometricas.jhtm em 09/11/2012. Fazendo a relação entre as escalas, de acordo com a figura 5, podemos escrever equações para relacionar valor de temperaturas entre elas e variação das temperaturas num determinado período. Figura 5 - Relações entre escalas Fonte:http://www.fisicapaidegua.com/conteudo/conteudo.php?id_top=020101 em 05/11/2012. C F 32 K 273 5 9 5 20 Para concluir esta atividade vamos comentar as respostas das questões sugeridas, e com as informações obtidas na realização da atividade prática realizada anteriormente, que servirão de base para a introdução de conceitos: - Controle de temperatura - Variação de temperatura - Escalas termométricas - Tipos de termômetros - Funcionamento dos termômetros - Pontos fixos e graduação de um termômetro - Principais escalas termométricas, relações entre elas e equações. Questões 1- Explique o funcionamento de um termômetro clínico. 2- Em seu cotidiano como você faz o controle de temperatura? Problemas 1- No verão do ano passado, a maior temperatura registrada em nossa cidade foi de 42 °C. Qual o valor dessa temperatura nas escalas Fahrenheit e Kelvin? 2- Uma variação de 5 graus na escala Celsius, corresponde a quantos graus nas escalas Fahrenheit e Kelvin? 3- No período do inverno no hemisfério norte, em uma cidade Inglesa foi registrada a temperatura de 20 ºF. Calcule o valor dessa temperatura nas escalas Celsius e Kelvin. 4- Das temperaturas a seguir, qual delas é a mais alta? a) 300 K b) 90 ºF c) 40 ºC 5- Em um deserto, durante a noite a temperatura mínima registrada foi de -10 ºC e durante o dia a temperatura máxima registrada foi de 50 ºC. Calcule essa variação de temperatura nas escalas Celsius, Fahrenheit e Kelvin. 21 7.3 TRANSMISSÕES DO CALOR O calor é uma forma de energia em movimento que se transfere do corpo com maior temperatura, para o corpo de menor temperatura, assim, como a água se movimenta em um dia chuvoso até que ocorra o equilíbrio. Em nosso cotidiano encontramos materiais bons condutores de calor e materiais bons isolantes. Nesta unidade de trabalho teremos grande discussão sobre as formas de transmissão de calor que são: por condução, por convecção e por irradiação. - Por que, ao tocarmos com a mão na parte metálica da carteira temos a sensação de frio em relação à parte de madeira? - Por que os radiadores dos automóveis e das geladeiras são pintados na cor preta? - Por que os painéis solares, utilizados para o aquecimento de água são pintados na cor preta e são cobertos com acrílico ou vidro transparentes? A transmissão do calor nas suas diversas formas é desconhecida pela maioria das pessoas, bem como as suas aplicações. Com este trabalho esperamos despertar o interesse e a importância da utilização correta no cotidiano desta forma de propagação do calor. 7.3.1 CONDUÇÃO DO CALOR A propagação do calor por condução, sempre ocorre por um processo natural e espontâneo, passando de molécula para molécula, da região do sistema ou corpo de maior temperatura para o de menor temperatura, até ocorrer o equilíbrio térmico. KIT EXPERIMENTAL 2 Objetivo Montar um experimento, com fios metálicos de diferentes ligas. Material - 9 pedaços de fio metálico desencapados: 3 pedaços de fio cobre, 3 pedaços de fio alumínio e 3 pedaços de fio de ferro, com 30 cm cada. 22 Procedimento Pegue dois fios metálicos um de cobre, outro de alumínio e enrole os dois fios juntos por 3 cm. Faça o mesmo, com os fios de cobre e ferro e também com o fio de alumínio e ferro. Assim, você montou três conjuntos que formam esse kit experimental, conforme figura 6. Outro Kit experimental poderá ser montado, pegando os três fios metálicos de diferentes ligas e enrolando a parte central dos três fios, onde já poderá ser feito com o próprio fio, a base de suporte, como mostra a figura 7. Figura 6 – kit experimental 2 Fonte: Fudal, 2012 Figura 7 – kit experimental 2 Fonte: Fudal, 2012 ATIVIDADE EXPERIMENTAL Objetivo Verificar a condução do calor em diferentes materiais. Material - kit experimental 2 23 - 1 vela - missangas de varias cores Procedimento Utilizando o kit experimental 2, coloque quatro pingos de parafina derretida em quatro posições diferentes de cada fio e fixe missangas nos pingos de vela, veja a figura 8 e figura 9. Coloque para aquecer na chama a parte enrolada dos fios dos kits experimentais e observe as missangas caírem. Figura 8 – Atividade experimental Fonte: Fudal, 2012 Figura 9 – Atividade experimental Fonte: Fudal, 2012 - Através dos três condutores, como ocorreu a transmissão do calor? - Qual dos três fios condutores perdeu às missangas primeiro? - Então, qual dos três fios é o melhor condutor de calor? - Quando usamos uma colher com cabo metálico para mexer o alimento, que está sendo cozido dentro de uma panela, logo sentimos o calor do cabo da colher na mão. Qual é a forma de propagação do calor nessa situação? 24 - Então, é melhor assar o churrasco com espeto de madeira ou com espeto metálico? Por quê? A condutividade térmica dos materiais é devida as forças intermoleculares. Um campo atrativo maior entre as moléculas torna as colisões entre elas mais intensas e a condutividade térmica maior. CONCLUSÃO Após a realização desta atividade, os resultados obtidos e as conclusões feitas servirão para discussão nos pequenos grupos das questões sugeridas na introdução, formando o conceito de condução do calor. 7.3.2 CONVECÇÃO DO CALOR A transmissão do calor por convecção ocorre quando as moléculas do meio material se deslocam. Este processo de propagação do calor ocorre nas substâncias líquidas ou gases, isto é, nos fluídos. Quando a molécula do fluído recebe energia térmica ela fica maior, diminui a densidade, sofre um empuxo e sobe, então, as moléculas mais frias por gravidade dessem, formando as correntes de convecção. - Como ocorre o resfriamento de alimentos dentro do refrigerador? - Por que o congelador da geladeira está localizado na parte superior? - Por que as chaminés das indústrias, dos fogões a lenha das casas são altos? - Como ocorre o aquecimento da água nos aquecedores solares, nas serpentinas de fogões a lenha? - Em um país, onde o frio predomina durante o ano todo, para obter um bom aproveitamento do calor gerado pelo ar condicionado em um cômodo da casa, ele deve ser instalado na parte superior ou inferior da parede da casa? Por quê? KIT EXPERIMENTAL 3 (Abajur giratório) Objetivo Confeccionar um abajur giratório Material 25 1 garrafa pet incolor 1 bocal de plástico para fixar 1 lâmpada incandescente de 40 W 30 cm de arrame nº 16 Papel celofane de várias cores 1 pedaço de cartolina preta 16 cm x 40 cm 1,5 m de fio 2 x 1,5 1 plug 1 pedaço de papel ceda 20 cm x 40 cm 1 ampola de água destilada 2 parafusos de fenda curtos Figura 10 - Material do kit experimental 3 Fonte: Fudal, 2012 Procedimento Após, reunido o material como mostra a figura 10, coloque a lâmpada no bocal e conecte ao fio e ao plug. Recorte um cilindro de 20 cm da garrafa transparente e fixe no bocal com cola ou parafusos. Na cartolina preta faça recortes de figuras, como peixes, plantas e cole nos orifícios papel celofane colorido. Faça um cilindro com a cartolina, de forma que ao ser colocado dentro do cilindro de plástico possa girar sobre um suporte fixo na lâmpada. Recorte um círculo da mesma cartolina, para fazer um fundo para o cilindro de cartolina e nesse fundo deve ser feito quatro cortes para o ar quente sair e girar o cilindro. Na parte central do circulo fixe uma ponta de ampola de água destilada. Com o arrame dê duas voltas em torno da lâmpada e enrole o arrame deixando 2 cm de sobra que servira de suporte para o cilindro girar, ligue a uma tomada e observe a montagem como na 26 figura 11. Para o experimento funcionar deverão ser feitos ajustes, principalmente para encontrar o equilíbrio do cilindro de cartolina. Figura 11 – kit experimental 3 Fonte: Fudal, 2012 CONCLUSÃO Esta atividade deve auxiliar a responder as questões sugeridas e ajudar os grupos para o debate do grande grupo, para o entendimento do conceito de convecção. 7.3.3 IRRADIAÇÃO DO CALOR O tempo gasto pela luz solar para chegar até a Terra é em torno de 500s. Esta distância que a luz percorre, é em uma região do espaço vazio, denominado vácuo. A luz solar, chamada luz infravermelha ou radiação térmica, que transporta o calor até nós. Mesmo em dias nublados as ondas eletromagnéticas de menor comprimento e faixa situada entre a violeta e a vermelha nos aquecem. Se fizermos a decomposição dessas cores e para cada cor colocássemos um termômetro observaríamos que para cada cor a temperatura registrada é diferente. Os corpos negros são radiadores e irradiadores de energia. KIT EXPERIMENTAL 4 Objetivo Confeccionar um experimento para verificar a propagação do calor por irradiação. Material 27 2 termômetros 2 latas iguais e de pequeno tamanho, uma na cor preta e outra na cor branca 1 vela Figura 12 - Material do kit experimental 4 Fonte: Fudal, 2012 Procedimento Os termômetros da figura 12 podem ser substituídos por outros tipos de termômetros. Perfure as duas tampas das latas, de maneira que no orifício possa ser introduzido um termômetro. Coloque a parte inferior dos termômetros na lata preta e a na lata branca e posicione o kit conforme a figura 13. Figura 13 – kit experimental 4 Fonte: Fudal, 2012 ATIVIDADE EXPERIMENTAL Objetivo Verificar a propagação do calor por irradiação. Material - kit experimental 4 - fósforos 28 Procedimento Antes de acender a vela, faça a leitura da temperatura nos dois termômetros e anote os valores das temperaturas. Acenda a vela e deixe as latas a uma mesma distância, conforme a figura 14, evitando também correntes de ar para não direcionar a chama. Observe a temperatura registrada em cada termômetro variar, para depois fazer a discussão dos resultados da atividade. Após, passados 10 min faça nova leitura e anote os valores registrados nos termômetros. Figura 14 – Atividade experimental Fonte: Fudal, 2012 - Qual foi à variação da temperatura em cada termômetro? - Agora apague a vela e observa qual das latas esfria mais rapidamente? - Qual das latas absorveu maior quantidade de calor? - Qual das latas ao resfriar, perdeu maior quantidade de calor? - A cor das latas influenciou na variação da temperatura? - Todos os corpos com temperatura superior ao ambiente, emitem radiações infravermelhas para o meio exterior? Justifique. - As coberturas com telhas transparentes permitem a entrada da luz, e dificultam a saída da radiação térmica, causando grande aquecimento no ambiente. Por quê? Questões 1- Qual é a melhor colher para mexer o alimento em cozimento em uma panela, a colher com cabo de madeira ou com cabo de ferro? Por quê? 2- Em cima de um fogão ligado, estão duas chaleiras com a mesma quantidade de água cada, uma é pintada na cor preta e a outra na cor do alumínio polido. Qual das duas aquece a água antes? 3- Como ocorre o resfriamento dos alimentos no interior de uma geladeira? 29 4- Qual a função do cobertor de lã que usamos nas noites frias? 5- Por que a chama de uma vela é sempre vertical para cima? 6- Qual é a cor de telha ideal para fazer a cobertura das casas? Por quê? CONCLUSÃO As análises dos resultados das atividades práticas e das questões sugeridas devem servir de base para as discussões nos grupos. O entendimento das várias formas de propagação do calor. A formação dos conceitos da propagação do calor acontecerá quando discutidas as questões no grande grupo. 7.4 TROCAS DE CALOR A transferência de calor entre os corpos que nos rodeiam são sempre fenômenos naturais, na maioria das vezes não sendo percebido pelos nossos sentidos. Quando um corpo é aquecido ou resfriado, podemos afirmar que houve troca de calor, devido à mudança de temperatura, e que isto pode ocorrer com maior ou menor rapidez. Podemos fazer a seguinte investigação, substâncias diferentes, de mesma massa e recebendo mesmas quantidades de calor, poderão sofrer a mesma variação de temperatura? Cada substância possui características próprias devido a capacidade de poder ganhar ou perder energia interna com maior facilidade, que são grandezas físicas denominadas capacidade térmica e calor específico. O calor específico de uma substância representa a quantidade de calor que um grama dessa substância pode ganhar ou perder para que sua temperatura sofrer uma variação de um grau Celsius. A água é uma substância com grande calor específico, sendo esse um dos fatores importantes para a temperatura do planeta não sofrer grandes variações, mantendo assim todos os tipos de vida. Os metais são as substâncias com menor calor específico, e ao receberem pequenas quantidades de calor sofrem grandes variações de temperatura. O calor específico é uma característica de cada material e tem a explicação a nível molecular, pois para uma mesma massa o número de moléculas varia de substância para substância. Em 50 g de água encontramos maior número de moléculas do que em 50 g de óleo. 30 Calor específico de algumas substâncias: Água .......... c = 1 cal/g.ºC Gelo ............ c = 0,5 cal/g.ºC Óleo de oliva.....c = 0,400 cal/g.ºC Alumínio ..........c =0,21 cal/g.ºC Concreto.......... c = 0,20 cal/g.ºC Ferro .......... c = 0,11 cal/g.ºC Cobre ...........c = 0,092 cal/g.ºC Prata ...........c = 0,056 cal/g.ºC Chumbo ...........c = 0,031 cal/g.ºC Ouro ............... c = 0,031 cal/g.ºC Fonte: http://www.infoescola.com/fisica/calorimetria/ em 29/11/2012. A capacidade térmica de um corpo é o produto da massa pelo calor específico (C = m.c), então a capacidade térmica da água é maior do que a do óleo. A expressão matemática que representa a quantidade de calor recebida ou cedida por um corpo, devido a uma variação da temperatura é calculada por: Durante a mudança de estado físico, uma substância absorve ou cede grande quantidade de calor sem sofrer variação na temperatura. Essa quantidade de calor necessária para mudar de estado físico de uma massa (m) de 1g é chamado de calor específico latente (L) da substância. Para a água, os valores de calor específico latente (L) são: - calor latente de fusão do gelo: Lf= 80 cal/g - calor latente de vaporização: Lv= 540 cal/g - calor latente de solidificação: Ls= -80 cal/g - calor latente de condensação: Lc = -540 cal/g Esta atividade é proposta para verificarmos trocas de calor, que ocorrem quando colocamos várias massas de substâncias e temperaturas diferentes, ocorrendo trocas de calor entre elas e o meio, até acontecer o equilíbrio térmico. 31 Como a quantidade de calor recebida ou cedida pelo meio é difícil de saber, então vamos confeccionar um recipiente termicamente isolado, que é denominado Calorímetro. O calorímetro é utilizado para calcular a quantidade de calor trocada entre as substâncias. A figura 15 mostra os materiais que usaremos na confecção do calorímetro. KIT EXPERIMENTAL 5 Objetivo Confeccionar um recipiente termicamente isolado denominado calorímetro Material 1 termômetro 2 porta garrafa de isopor 1 caneco de alumínio com diâmetro da garrafa 1 estilete 1 vela cola de silicone Figura 15 - Material do kit experimental 5 Fonte: Fudal, 2012 Procedimento Faça a medida da massa do caneco de alumínio com uma balança, pois nos cálculos poderá ser necessário saber o valor da massa do caneco. Coloque o caneco de alumínio dentro da porta garrafa de isopor e recorte a parte do isopor que estiver com sobra, fazendo uma boa colagem, e sempre procurando manter o bom 32 encaixe existente nas partes do isopor, para ter uma boa vedação. Para facilitar o corte no isopor, aqueça o estilete na chama e assim o corte fica mais uniforme. Para a tampa ter boa vedação e bom funcionamento, recorte 2 cm da tampa do suporte da garrafa de isopor e junte com o fundo já recortado de outro suporte de garrafa e cole conforme a montagem do equipamento na figura 16. Na parte central de tampa do seu calorímetro faça um orifício da grossura do termômetro que você ira utilizar e está pronto o seu calorímetro. Figura 16 – kit experimental 5 Fonte: Fudal, 2012 ATIVIDADE EXPERIMENTAL 1 Com o auxilio do calorímetro construído na atividade anterior e do princípio da conservação da quantidade de calor, esta atividade servirá para determinar experimentalmente o calor específico de outros materiais. Na figura 17 você observa o conjunto de materiais para a realização da atividade. Objetivo Determinar o calor específico do ferro Material 1 balança 1 calorímetro construído na atividade anterior 100 g de ferro (6 porcas de 1/2’’) 1 fonte térmica ( ebulidor elétrico ou bico de gás) 1 pedaço de barbante fino 33 100 g de água Figura 17 - Material da atividade experimental 1 Fonte: Fudal, 2012 Procedimento Coloque dentro do calorímetro 100 g de água da torneira. A essa massa de água chamaremos de m1 e com o termômetro faça a medida da temperatura da água dentro do calorímetro, sendo t1 a temperatura inicial da água e t2 a temperatura inicial do calorímetro. Agora meça a massa das porcas chamando de m3, prenda as porcas a um barbante e coloque em um béquer com água para ferver. Quando a água começar a ferver conte mais três minutos para que a temperatura das porcas fique igual a temperatura da água, com o termômetro meça a temperatura da água que será a temperatura inicial t3 do metal. Retire pelo barbante as porcas da água em ebulição e rapidamente coloque dentro do calorímetro, tampando-o imediatamente. Acompanhe no termômetro a temperatura no interior do calorímetro durante quatro minutos, verificando a temperatura do equilíbrio térmico. Marque as informações obtidas na tabela a seguir e usando o princípio das trocas de calor Q1+Q2+Q3=0, calcule o calor específico do metal e compare o valor encontrado com os valores de tabelas construídas pela comunidade científica. material Calor Temperatura Temperatura Variação de Massa Trocas específico inicial (ºC) final (ºC) temperatura de calor (cal/g.ºC) ferro 0,11 cal/g.°C água 1 cal/g.ºC Cuba(Al) 0,21 cal/g.°C (g) (ºC) Δt PROBLEMAS 1)Um calorímetro de alumínio com massa de 40 g, contém inicialmente 80 g de água 34 à temperatura de 25 °C. Colocamos então dentro do calorímetro 100 g de ferro, a temperatura inicial de 90 °C e calor específico c = 0,11 cal/g.°C. Sabendo que o calor específico da água e c = 1 cal/g.°C calcule a temperatura final do sistema. material Calor Temperatura Temperatura Variação de Massa Trocas específico inicial (ºC) final (ºC) de calor temperatura (g) (ºC) Δt (cal/g.ºC) ferro água Cuba(Al) 2)Um calorímetro com massa de 40 g, contém 80 g de água a 20 ºC. Uma peça de ferro a uma temperatura de 80 ºc é colocada no interior do calorímetro. Sabendo que o calor específico do ferro é 0,11 cal/g.ºC e a temperatura do equilíbrio térmico é 40 ºC. Calcule a massa de ferro. material Calor Temperatura Temperatura Variação de Massa Trocas específico inicial (ºC) final (ºC) de calor temperatura (g) (ºC) Δt (cal/g.ºC) ferro água Cuba(Al) 3)No interior do calorímetro de alumínio de massa 40 g, que contém 60 g de água a 23 ºC são colocadas 100 g de ferro a 100 ºC, ocorrendo o equilíbrio térmico a 27 ºC. Calcule o calor específico do ferro e compare com o valor da tabela construída pela comunidade científica. material Calor Temperatura Temperatura Variação de Massa Trocas específico inicial (ºC) final (ºC) temperatura de calor (cal/g.ºC) (g) (ºC) Δt ferro água Cuba(Al) 4) Colocam-se 40 g de gelo a 0ºC e 80 g de água dentro de um calorímetro. Após ocorrer o equilíbrio térmico observa-se 20 g de gelo boiando. Admitindo que não 35 ocorra troca de calor com o meio externo, e o valor do calor específico da água é 1 cal/g.ºC e o valor do calor latente de fusão do gelo é 80 cal/g. a) Qual a temperatura final da mistura? b) Qual a temperatura inicial da água? material Calor Temperatura Temperatura Variação de Massa Trocas específico inicial (ºC) final (ºC) temperatura de calor (cal/g.ºC) (g) (ºC) Δt ferro água Cuba(Al) CONCLUSÃO Após a execução destas atividades, as observações levantadas durante o desenvolvimento devem ser respondidas nos grupos, para servirem de base para o entendimento dos seguintes tópicos: - trocas de calor - capacidade térmica - calor específico - calor latente 7.5 PRINCÍPIOS DA TERMODINÂMICA Em nossos estudos até aqui, verificamos que quando um objeto está em movimento, ocorre o seu aquecimento devido ao atrito entre as superfícies de contato com o meio. Quando arrastamos um corpo sobre uma superfície, ao friccionarmos as mãos, o atrito de um corpo com o ar, pode-se perceber a energia mecânica sendo transformada em energia interna e posteriormente em calor. Agora vamos analisar situações em que o calor poderá ser convertido em energia mecânica. A partir do séc. XVll vem sendo feito estudos, para transformar o calor em energia mecânica, com a queima de combustíveis. Com a invenção da máquina a vapor, ocorreu uma grande revolução nos estudos da Termodinâmica, visando 36 melhorar o rendimento das máquinas térmicas. Até hoje a preocupação é produzir máquinas que tenham uma grande eficiência com um menor consumo de combustível e bom rendimento. Sabendo que o calor flui do corpo mais quente para o mais frio, e nunca em direção oposta, assim a primeira Lei da Termodinâmica mostra que a quantidade de energia (Q) recebida por um sistema pode realizar um trabalho (Ƭ), expandindo-se ou contraindo-se, e provocando uma variação (ΔU) da energia do sistema. A transformação do calor em qualquer outra forma de energia é chamada de máquina térmica. A primeira máquina térmica foi inventada pelo grego Heron no séc. l d. C. na cidade de Alexandria. Esta máquina não tinha a capacidade de produzir grande quantidade de movimento. A partir do séc. XVII surgem os primeiros modelos de máquinas térmicas, porém com baixo rendimento. O rendimento de uma máquina térmica (η) é definido como sendo a razão entre o trabalho realizado (Ƭ) e a quantidade de calor recebida (Q). Com estudos realizados no séc. XVIII por James Watt, surgiram máquinas térmicas com melhor rendimento e enorme vantagem sobre as que já existiam. Essas máquinas térmicas inicialmente foram utilizadas para retirar água das minas de carvão, nas locomotivas, em barcos a vapor e na indústria, causando uma grande revolução, conhecida como Revolução Industrial. No séc. XIX com estudos realizados por Sady Carnot, que veio fundamentar o funcionamento das máquinas térmicas e prever limitações para o seu funcionamento, ao transformar o calor em trabalho mecânico e o seu rendimento. Para entender o princípio do funcionamento da máquina térmica, precisamos entender o comportamento das variáveis dos gases (p,V,T), e veremos que a variação da temperatura provoca variações no volume e na pressão do gás. O princípio que rege o funcionamento das máquinas térmicas é denominado princípio de Carnot, desenvolvendo transformações gasosas, com representação do ciclo na figura 18 é assim definido: - Absorção Isotérmica. O sistema recebe uma quantidade de calor e realiza trabalho, ao variar o volume do gás, e a temperatura permanece constante. - A expansão Adiabática reduz a temperatura final, não ocorrendo troca de calor com 37 a vizinhança, mas o sistema continua a se expandir, realizando trabalho. - A liberação Isotérmica do calor para a fonte fria. O sistema cede calor através do trabalho realizado ao diminuir o volume e a temperatura permanece constante. - Na compressão adiabática, a temperatura aumenta, sem ocorrer troca de calor com a vizinhança, diminuindo o volume e aumentando a pressão. Figura 18 - Ciclo de Carnot Fonte:http://nretoledo1.wikispaces.com/file/view/Maquinas_termicas_Segunda_lei_Termodinamica_PRO F.pdf em 10/11/2012 Na máquina de Carnot, a quantidade de calor que é fornecida pela fonte de aquecimento e a quantidade cedida à fonte de resfriamento são proporcionais às suas temperaturas absolutas, assim: O trabalho realizado pela máquina térmica é igual a diferença entre o calor recebido e o calor rejeitado. Assim, o rendimento de uma máquina de Carnot é: Logo: η = Ƭ/Q1 38 Sendo: = temperatura absoluta da fonte de resfriamento = temperatura absoluta da fonte de aquecimento Se a máquina térmica operar ao contrário, temos o refrigerador, que retira o calor da fonte fria e o transfere para a fonte quente. Esta transferência de calor só é possível mediante a realização de trabalho sobre o sistema. Para representar a transformação do calor em trabalho, com o material representado na figura 19 confeccionaremos um kit experimental. KIT EXPERIMENTAL 6 Objetivo Confeccionar um dispositivo que represente uma máquina térmica Material - 1 lata pequena com tampa e vazia - 1 agulha grossa de injeção de uso veterinário - 1 pedaço de tábua de 20 cm x 25 cm - 1 m de arame no 16 - 1 pedaço de placa de isopor circular com 10 cm de diâmetro. - 1 cola epoxi - 1 lamparina ou três velas Figura 19 - Material do kit experimental 6 Fonte: Fudal, 2012 39 Procedimento Faça um pequeno furo na borda da tampa da lata e fixe a agulha com a cola epoxi. Com o arame faça um suporte, para colocar a ventoinha de isopor e para suspender a lata, fixe três pregos no pedaço de madeira sobre a chama da lamparina ou velas. Com o isopor confeccione uma ventoinha, coloque-a em um eixo feito com 8 cm de arame que deve ficar um pouco acima da ponta da agulha, de modo que ela gire com a saída da pressão do vapor. Coloque meia lata de água, acenda a lamparina, deixe a água ferver e observe a ventoinha girar. A figura 20 representa o kit montado, que depois de colocado em funcionamento ajudará a responder algumas questões sobre as transformações do calor. Figura 20 – kit experimental 6 Fonte: Fudal, 2012 CONCLUSÃO Esta atividade deve auxiliar a responder nos pequenos grupos, as questões sugeridas a seguir, para serem comentadas no grande grupo. QUESTÕES 1- Quais os efeitos produzidos pela chama ao sistema? 2- Ocorrem perdas de calor no sistema? Como? 3- Como você explica o movimento da ventoinha? 4- O calor liberado pela chama é totalmente aproveitado para a produção de 40 movimento? 5- O que poderia ser feito para melhorar o funcionamento desta máquina térmica? PROBLEMAS 1) Uma máquina térmica obtém trabalho à custa de um gás realizando ciclos de transformações. Em cada ciclo o gás recebe da fonte quente uma quantidade de calor Q=800J e envia para a fonte fria uma quantidade de calor Qf = 600J. Suponha que cada ciclo ocorra num intervalo de tempo de Δt = 0,20 s . a)Calcule o trabalho realizado pela máquina em cada ciclo. b)Calcule o rendimento da máquina. c)Calcule a potência útil da máquina. 2) Uma máquina de Carnot funciona entre duas fontes de calor a temperaturas Tf=400 K e Tq= 500 K, de modo que, em cada ciclo, recebe da fonte quente uma quantidade de calor Qq= 1200J. a)Calcule o rendimento dessa máquina. b)Calcule o trabalho realizado em cada ciclo. c)Calcule o calor rejeitado para a fonte fria em cada ciclo. 3) Calcule o rendimento de uma máquina térmica que retira de uma fonte quente 500 cal e passa para uma fonte fria 80 cal? 4) Certa máquina térmica recebe 700 cal de uma fonte quente e perde 500 cal para uma fonte fria em 2 s. Determine a potência útil da máquina. 1 cal = 4,2 J 41 8. TESTE 1) Qual a função térmica dos pelos, das penas nas aves e do vestuário em nosso corpo? 2) Para medir a temperatura de um corpo, o termômetro deve permanecer algum tempo em contato com o corpo. Em que momento o termômetro indicará a temperatura do corpo? 3) Qual o valor da temperatura de ebulição da água em nossa cidade? 4) Por que, ao tocarmos com a mão na parte metálica da cadeira, temos a sensação de frio em relação à parte de madeira? 5) Por que a chama de uma vela é sempre vertical para cima? 6) No verão do ano passado, a maior temperatura registrada em nossa cidade foi 35 °C. Qual o valor dessa temperatura nas escalas Fahrenheit e Kelvin? 7) Como você faria para medir a temperatura de um lápis, de uma carteira e da porta da sala de aula? 42 8) A garrafa térmica é feita de vidro fino e espelhado para: a) evitar a perda de calor por convecção. b) facilitar a condução do calor para o seu interior, aumentando a temperatura. c) evitar a fuga de vapor de água. d) refletir a radiação infravermelha. e) permitir o rápido equilíbrio térmico com o meio exterior. 9) Para avaliar a temperatura de um corpo podemos utilizar várias grandezas, assinale a opção correta: a) a variação do comprimento de uma barra de ferro. b) a variação do volume de um líquido. c) a variação da pressão de um gás. d) a variação da resistência elétrica de um condutor. e) todas as respostas anteriores estão corretas 10) Assinale a opção em que estão ordenadas estão em ordem crescente, de acordo com suas temperaturas: 1) da chama do gás de cozinha 2) do corpo humano 3) do óleo em que batatas estão sendo fritas 4) da água fervendo 5) da água de um oceano a) 2 5 3 4 1 b) 5 2 4 3 1 c) 5 2 4 1 3 d) 2 5 3 1 4 e) 2 5 1 4 3 11) Quando se coloca uma colher de metal numa sopa quente, logo toda a colher também estará quente. A transmissão de calor através da colher é chamada: a) agitação; b) condução; c) irradiação; d) convecção. 12) A blusa de lã é um bom isolante térmico por que: a) é muito espessa; b) retém bastante ar no seu interior; c) impede a passagem da corrente de ar pelo corpo; d) impede a transpiração e a consequente diminuição de temperatura do corpo. 13) Nas geladeiras, a fonte fria (o congelador) deve ser colocada: a) na parte inferior, pois o ar quente é resfriado lá; b) na parte superior, pois o ar quente tende a se elevar; c) na parte inferior, pois o ar frio é mais denso e desce para o fundo; d) no meio do refrigerador. 14) O processo de transmissão de calor que só ocorre no vácuo (onde não tem ar) é denominado de: a) condução; b) convecção; c) absorção; d) irradiação. 43 9. REFERÊNCIAS ARRIBAS, S.D. Experiências de física ao alcance de todas as escolas. Rio de Janeiro: FAE. 1998. AXT, R. O papel da experimentação no ensino de Ciências. In: Tópicos em Ensino de Ciências. Moreira, M. A. Porto Alegre: Sagra. 1991. BAEYER, V.; CHRISTIAN, H. Arco-Íris, flocos de neve, quarks: a física e o mundo que nos rodeia. Tradução Luiz Euclides Trindade Frazão Filho. Rio de Janeiro: Campus, 1994. BONADIMAN, H.; ZANON, L. B.; MALDANER, O. A. CIÊNCIAS: Proposta alternativa de ensino. Ijuí: Unijuí. 1997. BRASIL. Parâmetros Curriculares Nacionais Ensino Médio: Orientações Educacionais Complementares aos Parâmetros Curriculares Nacionais. Ciências da Natureza, Matemática e suas Tecnologias. Brasília: 1999. CARVALHO, A. M. P.; PÉREZ, D.G. Formação de professores de ciências, tendências e inovações. 2.ed. São Paulo: Cortez. 1995. DELIZOICOV, D; ANGOTTI, J.A. Física. 2.ed. São Paulo: Cortez. 1992. DELIZOICOV, D; ANGOTTI, J.A. Metodologia do ensino de ciências. São Paulo: Cortez. 2000. Delizoicov, D; Angotti, J.A.,Pernambuco, M.M. Ensino de Ciências: fundamentos e métodos. 3.ed. São Paulo: Cortez. 2009. Freire, P. Pedagogia do oprimido. Rio de Janeiro: Paz e Terra S.A.. 1963. GAMOW, G. Biografia da Física. Rio de Janeiro: Livrarias Editoras Reunidas. 1963. KUHN, T.S. A estrutura das revoluções científicas. 10.ed. São Paulo: Perspectiva.1962. NARDI, R. Pesquisas no ensino de física. São Paulo: Escrituras. 1998. 44 PARANÁ, Secretaria de Estado da Educação. Diretrizes Curriculares da Educação Básica de Física. Curitiba: SEED. 2008. PIETROCOLA, M. Ensino de Física: conteúdo, metodologia e epistemologia numa concepção integradora. Florianópolis: Ed. Da UFSC. 2001. QUIRINI, W. G.; LAVARDA, F.C. Experimentos de Física para o Ensino Médio. Disponível em: <http://www2.fc.unesp.br/experimentosdefisica/rbef 1pp.htm>. Acesso em 20 de março de 2012. TORRES, C. M. A.; ERRARO, N. G.; SOARES, P. A. T. Física – Ciência e tecnologia: volume 2: 2 ed. São Paulo: Moderna. 2010.
Download