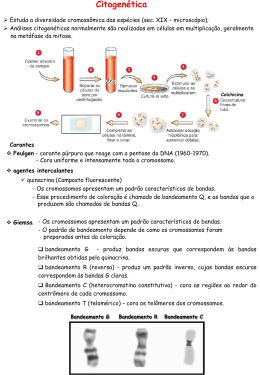
SILVA, B.R.; GOMES, H.S.; SILVA, B.M.P.; GOMES, R.L.F.; LOPES, A.C.A.; FEITOZA, L.L. Análise citomolecular em acessos de Allium sativum L. . In: II Simpósio da Rede de Recursos Genéticos Vegetais do Nordeste, 2015, Fortaleza. Anais do II Simpósio da RGV Nordeste. Fortaleza, Embrapa Agroindústria Tropical, 2015 (R 245). Análise citomolecular em acessos de Allium sativum L. Bruna Rodrigues da Silva1; Helenice Silva Gomes1; Bruna Maria Prado da Silva1; Regina Lucia Ferreira Gomes2; Angela Celis de Almeida Lopes2; Lidiane de Lima Feitoza3 1 Discente. Bacharelado em Ciências Biológicas. Universidade Federal do Piauí. Teresina, PI. [email protected], [email protected], [email protected]; ² Docente. Universidade 3 Federal do Piauí. Departamento de Fitotecnia. [email protected], [email protected]. Docente. Universidade Federal do Piauí-PI. Departamento de Biologia. [email protected] Palavras-chave: Giemsa, bandeamento C, anti-H4K5ac, cromossomos, cromatina. Introdução O gênero Allium reúne uma variedade de espécies difundidas mundialmente devido à sua importância medicinal e econômica. A espécie Allium sativum, o alho, constitui uma dessas espécies de reconhecida importância, principalmente devido ao seu sabor e aroma característicos, sendo um dos principais condimentos utilizados na gastronomia. Apresenta número cromossômico básico n=x=8, e, embora apresente tantas características atrativas ao mercado consumidor, ainda há poucos estudos citogenéticos realizados na espécie, sendo estes muitas vezes limitados a técnicas de colorações convencionais por Giemsa ou Feulgen resultando nas poucas informações existentes até então a respeito de sua diversidade citológica, principalmente nas espécies presentes nos bancos de Germoplasma. Diante disso, o objetivo do trabalho foi analisar o genoma de alguns acessos de Allium sativum L. através das técnicas de coloração com Giemsa, bandeamento C e imunocoloração de histonas, utilizando o anticorpo anti-H4K5ac como forma de identificar possíveis regiões potencialmente ativas e de fundamental importância para o entendimento da estrutura e dinâmica da cromatina. Material e Métodos Foram utilizados seis acessos de A. sativum de diferentes proveniências: Cateto Mineiro 01, Cateto Mineiro 02 e Cateto Roxo (Banco Germoplasma UFPI), Cultivar BRS HOZAN (Embrapa Meio Norte), Cebolinha Branquinha e Cebolinha Mulatinha (Araras-Paraíba). Para a técnica de coloração convencional, seguiu-se o protocolo proposto por Guerra e Souza (2002). O procedimento para bandeamento C baseouse em Schwarzacher et al. (1980) e para imunocoloração adotou-se o protocolo de Feitoza e Guerra (2011). A morfometria foi determinada por meio do programa Micromeasure v3.3 e a fotodocumentação por câmera acoplada ao microscópio óptico. Resultados e Discussão A coloração convencional com Giemsa revelou um conjunto diploide com 2n=16 cromossomos grandes, constituído de seis pares metacêntricos e 2 pares submetacêntricos e Fórmula Cariotípica 6M + 2 SM para os diferentes acessos de A. sativum. Os cromossomos apresentaram tamanhos variando de 5,75 µm a 15,70 µm, com padrão de condensação uniforme e núcleo interfásico do tipo reticulado. Figuras 1 e 2. Núcleos interfásicos, prometáfases e metáfases de acessos de A. sativum corados com Giemsa 2%. Insertos mostram cromossomos com RONs não distendidas. Na figura b’’’, no sentido centrômero-telômero, observe a contrição secundária (RON) logo após a constrição primária (centrômero). Barra equivale a 10um. II Simpósio da Rede de Recursos Genéticos Vegetais do Nordeste Fortaleza, 10-13 de novembro de 2015 Valorização e Uso das Plantas da Caatinga A técnica de bandeamento C, realizada com sucesso apenas no acesso Cateto Roxo/ PI, evidenciou a distribuição de pequenos blocos heterocromáticos nas regiões intersticiais, provavelmente ricos em GC e correspondentes às RONs. A marcação com anti-H4K5ac ocorreu, por sua vez, uniformemente em todos os cromossomos, exceto nos centrômeros, sugerindo um padrão de distribuição intercalar de seqüências ativas similar ao observado em plantas com cromossomos grandes e com pouca heterocromatina, como em Allium cepa. Figura 3. Bandeamento C. a-c núcleo interfásico, prófase e prometáfase do acesso Cateto Roxo/Piauí. Setas indicam “pequenos” blocos heterocromáticos provavelmente correspondentes à RON. Figura 4. Imunodetecção de histonas usando anticorpo anti-H4K5ac em metáfases e núcleos interfásicos de três acessos de A. sativum. DAPI pseudocorado em vermelho e anti-H4K5ac em verde. Barra = 10 µm Conclusão Os resultados obtidos com uso das técnicas de coloração convencional e de bandeamento C foram úteis para a caracterização citológica dos acessos analisados, permitindo observar pequenos polimorfismos em relação à morfometria cromossômica e quanto ao número de bandas heterocromáticas, respectivamente, sugerindo forte estabilidade cariotípica para estas duas características. Na técnica de imunocoloração, foi possível observar um padrão de marcação de anti-H4K5ac uniforme ao longo de todos os cromossomos, sugerindo que o genoma da espécie seja formado por regiões potencialmente ativas com distribuição dispersa e intercalar, como ocorre em outras plantas com cromossomos grandes. Acreditamos que, estes dados, aliados a trabalhos citogenéticos futuros, permitirão entender melhor a diversidade citológica desse grupo e poderão auxiliar na conservação e manutenção dos recursos genéticos da espécie. Agradecimentos CNPq, CAPES, LASO (Laboratório de Análises do Solo- UFPI) e Universidade Federal Rural de Pernambuco (UFRPE). Referências ASSOCIAÇÃO NACIONAL DE PRODUTORES DE ALHO – ANAPA. Emprego na produção de alho é passado, desemprego na produção de alho no Brasil é realidade. 2ª ed. Revista Nosso Alho: Distribuição gratuita da ANAPA, p.22-29, 2009. C BARCELAR, A. A. P. Caracterização Citogenética em acessos de Allium sativum L. Dissertação de Mestrado - Teresina: Universidade Federal do Piauí, 59p. 2014. BONTEMPO, M. Alho: sabor e saúde. São Paulo: Alaúde Editorial, 147p. 2007. CUNHA, C. P. RESENDE, F. V.; PINHEIRO, J. B. Caracterização molecular de bancos de germoplasma de alho e implicações no melhoramento genético. Nosso alho, n. 13, 2012. GUERRA, M.; SOUZA, M. J. Como observar cromossomos – Um guia de técnicas em citogenética vegetal, animal e humana. Editora FUPEC. Ribeirão Preto, 131p. 2002. II Simpósio da Rede de Recursos Genéticos Vegetais do Nordeste Fortaleza, 10-13 de novembro de 2015
Baixar