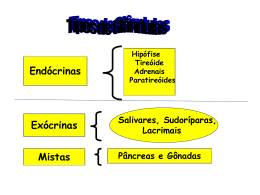
2011 SUMÁRIO 1. A Organização Funcional do sistema endócrino ............................................. 3 2.A Tireóide ...................................................................................................... 8 3.As Paratireóides ........................................................................................ 13 4.O Pâncreas endócrino................................................................................ 16 Diabete Mellitus ................................................................................. 22 5. As Adrenais.............................................................................................. 25 Bibliografia ................................................................................................. 29 Prof. Ms. Amarildo Grendene Fisioterapeuta, fisiologista e acupunturista Professor de Fisiologia (Kroton/Iuni) Professor de Acupuntura (ABA) Mestre em Ciências da Saúde (Unic) “Não falar do caminho a um homem susceptível de compreender, é desperdiçar um homem. Falar do caminho a um homem incapaz de compreender, é desperdiçar palavras.” (Confúcio) 2 A Organização Funcional do Sistema Endócrino O sistema nervoso autônomo (SNA) e o sistema endócrino atuam em conjunto, regulando as atividades metabólicas dos diferentes órgãos e tecidos do corpo, a fim de manter a homeostase. O SNA utiliza impulsos nervosos e libera neurotransmissores nos terminais nervosos para obter uma resposta rápida, direta e localizada. O sistema endócrino tem uma resposta mais lenta e difusa pela síntese e liberação de hormônios na circulação sangüínea, mas seu efeito é mais duradouro do que o estímulo nervoso. A estrutura específica sobre a qual age um hormônio chama-se órgão-alvo. O Sistema Endócrino é formado pelo conjunto de glândulas endócrinas, ou mesmo estruturas não endócrinas, as quais são responsáveis pela secreção de substâncias denominadas hormônios, que são lançados na corrente sangüínea por onde eles atingem todas as células do organismo, controlando ou auxiliando o controle de sua função. Glândula • Endócrina = Não possuem ductos – Somente as glândulas endócrinas secretam hormônios • Exócrina = Possuem ductos (controlados pelo sistema nervoso) – As exócrinas secretam substâncias que não podem ser consideradas hormônios por não atuarem em células específicas Os múltiplos sistemas hormonais do organismo desempenham pepel-chave na regulação de quase todas as funções orgânicas como: Metabolismo, crescimento, desenvolvimento, equilíbrio hidricoeletrolítico, reprodução ou comportamento. 1. Constituição dos órgãos do sistema endócrino Os tecidos epiteliais de secreção ou epitélios glandulares formam as glândulas, que podem ser uni ou pluricelulares. As glândulas pluricelulares são órgãos definidos com arquitetura ordenada. Estão envolvidas por uma cápsula conjuntiva que emite septos, dividindo-as em lobos. Vasos sangüíneos e nervos penetram nas glândulas, fornecendo alimento e estímulo nervoso para as suas funções. Cada glândula tem funções específicas que ajudam a manter o organismo interno em condições normais e a promover a sobrevivência do organismo. Os hormônios influenciam praticamente todas as funções dos demais sistemas corporais. Constantemente o sistema endócrino interage com o sistema nervoso, formando mecanismos reguladores bastante precisos. O sistema nervoso pode fornecer ao endócrino a informação sobre o meio externo, ao passo que o sistema endócrino regula a resposta interna do organismo a esta informação. Dessa forma, o sistema endócrino, juntamente com o sistema nervoso, atuam na coordenação e regulação das funções corporais. O quadro abaixo resume a maioria das glândulas endócrinas e estruturas não endócrinas que liberam hormônios ou apresentam uma ação endócrina. O sistema endócrino difere de outros sistemas do organismo, já que várias estruturas não estão anatomicamente conectadas; todavia formam um sistema no sentido funcional. 3 ESTRUTURAS Hipotálamo HORMÔNIOS Hormônios de liberação (TRH – CRH – GHRH – GHIH – GnH) GH TSH ACTH FSH Hipófise anterior LH ADH Hipófise posterior Ocitocina FUNÇÃO -Estimular a liberação dos hormônios da adenohipófise -crescimento tecidual -síntese e liberação dos hormônios tireóideos -síntese e secreção dos hormônios adrenais -crescimento dos folículos -maturação dos espermatozóides -síntese de testosterona -ovulação e formação do corpo lúteo -síntese de estrogênio e progesterona -reabsorção de H2O nos rins, vasoconstrição e aumento da P.A. -ejeção de leite e contração uterina Tiróide Tiroxina (T4) e Triiodotironina (T3) Córtex adrenal Cortisol Aldosterona -metabolismo, antiinflamatório e estresse -reabsorção de sal e P.A. Medula adrenal Norepinefrina Epinefrina -similar ao simpático Pâncreas Insulina Glucagon -metabolismo dos carboidratos -síntese e liberação de glicose pelo fígado Paratireóide PTH -concentração séria de cálcio Testículos Testosterona Ovários Estrogênio -sistema reprodutor masculino e caracteres sexuais masculinos -sistema reprodutor feminino e caracteres sexuais femininos -secreção de “leite uterino” e desenvolvimento das mamas Progesterona Placenta HCG Somatomamot. Humana Estrogênio Protegesterona - Metabolismo corporal -crescimento do corpo lúteo -desenvolvimento das mamas -crescimento das mamas -excreção de leite Rins Renina Vit. D3 ativa Eritropoietina -conversão da Angiotensina -mineralização do osso -produção de eritrócitos Coração ANP -redução da P.A. Estômago Gastrina -secreção de HCl Intestino delgado Secretina Colecistocinina -Íons bicarbonato -Enzimas pancreáticas 4 Pineal Timo -Melatonina -Maturidade sexual? - Ritmos biológicos (sono)? -Timopoetina -Função dos linfócitos T -Tabela das estruturas endócrinas e seus respectivos hormônios. 2. Os Hormônios Substância química secretada para os líquidos corporais internos por uma célula ou grupo de células; exercendo um efeito fisiológico de CONTROLE sobre outras células do corpo. Há vários tipos de hormônios: Hormônios locais: têm efeitos locais específicos, atuam em locais restritos. Ex.: Acetilcolina liberada nas terminações parassimpáticas; Secretina – liberada pelo duodeno causa a secreção do pâncreas (só sist. digestivo); Colecistocinina, liberada no intestino delgado atua na vesícula biliar (só sist. digestivo). Os hormônios locais podem apresentar ação autócrina (agem na própria célula ou células que o secretaram) ou parácrina (agem em locais próximos ao local de secreção). Hormônios gerais: maiorias secretadas por glândulas específicas são transportados no sangue para todo o corpo – causam muitas reações diferentes. Ex.: Epinefrina, secretada pela supra-renal em resposta à estimulação simpática; Insulina, secretada pelo pâncreas atua em praticamente todas as células do organismo (exceto tecido nervoso) Os hormônios gerais têm ação endócrina (caem na corrente sanguínea e atuam longe do local de produção). A. Classes gerais de hormônios: Peptídicos e protéicos: se constituem na maioria dos hormônios. Variam de tamanho desde pequenos peptídeos (3 a.a.) até pequenas proteínas (algumas glicoproteínas). Hormônios secretados pela hipófise anterior e posterior, pelo pâncreas (insulina e glucagon), pelas glândulas paratireóides (hormônio paratireóideo) e outros (ver tabela) esteróides: o colesterol é o precursor de todos os hormônios esteróides, sintetizados parte pelas células produtoras do hormônio e a maioria fornecida pelo plasma. secretados pela córtex adrenal (cortisol e aldosterona), pelos ovários (estrogênio e progesterona), pelos testículo (testosterona) e pela placenta (estrogênio e progesterona) Aminados (aminas): são derivados do a.a. tirosina. Secretados pela tireóide (tiroxina e triiodotironina) e pela medula adrenal (epinefrina e norepinefrina) 5 B. Mecanismos de ação dos hormônios a nível celular: Os órgãos que têm sua função controlada e/ou regulada pelos hormônios são denominados órgãos-alvo ou células-alvo. A primeira etapa na ação de um hormônio é a sua ligação a receptores específicos na célula-alvo.As células que não tem receptores específicos para esses hormônios não respondem. Assim as glândulas endócrinas, através da secreção de seus hormônios, são responsáveis, pelo crescimento, desenvolvimento, reprodução e regulação de vários órgãos, bem como os processos metabólicos do organismo, incluindo a maioria das características morfológicas masculinas e femininas, atuando inclusive no comportamento dos indivíduos. Assim dizemos que os hormônios são os responsáveis pela manutenção da homeostase, isto é das condições ideais e adequadas do meio interno para as funções celulares e perfeito funcionamento do organismo. Os receptores de hormônios As células alvo de determinado hormônio possuem, na membrana ou no citoplasma, proteínas denominadas receptores hormonais, capazes de se combinar especificamente com as moléculas do hormônio. É apenas quando a combinação correta ocorre que as células-alvo exibem as respostas características da ação hormonal. O nosso organismo possui diversas glândulas endócrinas, algumas delas responsáveis pela produção de mais de um tipo de hormônio. a) Na superfície da membrana celular, ou sobre ela. Os receptores de membrana são específicos principalmente para os hormônios protéicos, peptídicos e catecolamínicos. b) No citoplasma celular. Os receptores dos diferentes hormônios esteróides são encontrados quase totalmente no citoplasma c) No núcleo da célula. Os receptores dos hormônios tireóideos são encontrados no núcleo, e acredita-se que estejam localizados em associação direta com um ou mais cromossomas. Modificação da permeabilidade da membrana: A ligação hormônio-receptor produz alteração na estrutura do receptor, abrindo ou fechando, um canal iônico. É o movimento dos íons, através de seus canais, que causa os efeitos subseqüentes sobre as células pós-sinápticas. Temos como exemplos hormônios como as aminas (adrenalina e noradrenalina). Ativação de enzimas intracelulares: A ligação hormônio-receptor promove na ativação (ou inibição) de uma enzima situada imediatamente no interior da membrana celular. Essa ligação produz mudança estrutural na própria molécula do receptor, fazendo com que a porção da molécula que faz protrusão para o interior da célula seja transformada em cinase ativada . Na seqüência, esta cinase promove a fosforilação de várias substancias diferentes no interior da célula. Temos como exemplo o efeito da insulina (e outros peptídeos). Ativação de genes celulares: Há hormônios que se ligam a receptores protéicos no interior da célula e não na membrana celular. O complexo hormônio-receptor ativado, se liga ou ativa porções específicas dos filamentos de DNA do núcleo da célula, que por sua vez, inicia a transcrição de genes para a formação de um segundo mensageiro (RNAm). Como conseqüência, dentro de minutos, horas ou dias, aparecem 6 proteínas recém-formadas, que passam a controlar funções novas da célula. Temos como exemplos os hormônios esteróides e hormônios tireóideos. 3. Mecanismos de controle da função endócrina: Para controlar as funções endócrinas, a secreção de cada hormônio deve ser regulada dentro de limites precisos. Este mecanismo de regulação é denominado de “feedback” ou “retroalimentação”. O organismo precisa detectar a cada momento a necessidade de uma maior ou menor quantidade de um determinado hormônio. O "feedback" é denominado "feedback negativo" quando a concentração do hormônio secretado por uma glândula atinge uma concentração acima do necessário ocorrendo interrupção da secreção deste hormônio e a conseqüente interrupção deste circuito de ação. O "feedback" é denominado "feedback positivo" quando a concentração de um hormônio é baixa e há necessidade de a glândula secretá-lo para que uma determinada atividade fisiológica possa ser desenvolvida. 7 A TIREÓIDE A tireóide é a maior glândula endócrina do corpo humano, sendo responsável pela produção dos hormônios tireoideanos (T3 e T4), envolvidos com diversos componentes da homeostase (função cerebral, cardiovascular, intestinal, metabolismo celular, produção de calor etc). O nome 'tireóide' é em razão do seu formato semelhante a um escudo (do grego: thyreos = escudo, eidos = forma). Na embriologia, a sua origem está no assoalho da faringe primitiva (endoderma), migrando a partir do forame cego, no assoalho da língua, formando em seu trajeto o dueto tireoglosso, e por fim atingindo a sua posição permanente: a região cervical. 1. Anatomohistologia A tireóide é uma pequena glândula que mede aproximadamente 5 cm de diâmetro localizada na base do pescoço, estando apoiada sobre as cartilagens da laringe e da traquéia. Mantém o metabolismo dos tecidos em nível ótimo para suas funções normais. A glândula tireóide é constituída por um grande número de folículos (espécie de cistos microscópicos com cerca de meio milímetro de diâmetro) formados por epitélio simples de células tireóideas foliculares, produtoras de hormônios tireoidianos (T3 e T4). Entre os folículos, no interstício, estão células C (claras) ou parafoliculares, produtoras de calcitonina. Existe também tecido conjuntivo intersticial que se vai tornando mais volumoso do interior para a periferia da glândula, até se fundir com a cápsula. Os folículos são delimitados por um epitélio cúbico simples de células foliculares. Estes secretam no interior do folículo os hormônios e outras substâncias que formam o colóide gelatinoso que se encontra no seu interior. Este colóide armazena os hormônios tireoidianos, que são absorvidos de novo pelas células foliculares e liberados no sangue de acordo com as necessidades do organismo. Julga-se que a arquitetura em folículos armazenadores deve-se à falta de regularidade de consumo de fontes de iodo de que sofriam os nossos antepassados. A tireóide tem um suprimento sanguíneo rico, proveniente da artéria tireóidea superior (ramo da carótida externa) e da artéria tireóidea inferior (ramo do tronco tireocervical da artéria subclávia). Ainda há uma pequena artéria tireóidea caudal, ramo da artéria inominada. A drenagem venosa se faz pelas veias tireóideas superior, lateral e inferior, conduzindo o sangue para as veias jugulares internas ou troncos bráquio-cefálicos. 8 2. Síntese dos hormônios tireoidianos As células do epitélio folicular possuem dois pólos e, portanto duas membranas: a membrana apical (voltada para o lúmen folicular ou 'colóide') e a membrana basal (voltada para o interstício e capilares). As reações bioquímicas de síntese hormonal ocorrem em torno da membrana apical, onde se encontra a enzima determinante de todo este processo: a peroxidase tireóidea (TPO), ou tireoperoxidase, localizada em suas microvilosidades. A glândula tireóide é responsável pela síntese dos hormônios T 3 e T4, triiodotironina e tiroxina respectivamente, por intermédio da captação de iodeto. A primeira etapa na formação dos hormônios tireóideos consiste no transporte de iodetos do sangue para as células glandulares e os folículos da tireóide. A membrana basal das células tireóideas tem capacidade especifica de bombear, ativamente, o iodeto para o interior das células, processo denominado de seqüestro do iodeto. A intensidade do seqüestro do iodeto é influenciada principalmente pelo TSH que estimula a atividade da bomba de iodeto nas células tireóideas. O processo se inicia no retículo endoplasmático e no complexo de Golgi das células epiteliais cubóides, os quais secretam a tireoglobulina nos folículos. As tirosinas são os principais substratos e se combinam com o iodo para formar os hormônios tireoidianos. Dessa forma, os hormônios tiroxina e triiodotironina são formados no interior da molécula de tireoglobulina. Para formação dos hormônios tireoidianos ocorre primeiramente a conversão dos íons iodeto para uma forma oxidada de iodo ou o chamado iodo nascente (oxidação do iodeto). Esta conversão ocorre para que desta forma o iodo consiga se combinar diretamente com o aminoácido tirosina. Essa oxidação é promovida pela enzima peroxidase acompanhada do peróxido de hidrogênio. -formação dos hormônio tireoidianos A ligação da tireoglobulina com o iodo nascente é chamada de organificação da tireoglobulina, acelerada pela enzima iodinase (enzima-I). Nesse momento o iodo oxidado, se liga ao aminoácido tirosina para formar os hormônios tirosina e triiodotironina. A tirosina é iodada inicialmente para monoiodotirosina e então para diiodotirosina. O acoplamento de uma molécula de monoiodotirosina com uma diiodotirosina forma a triiodotironina (T3), um dos hormônios tireoidianos. O hormônio tiroxina (T4) é formado quando moléculas de iodotirosina se acoplam uns aos outros. 3. Armazenamento e secreção dos hormônios tireoidianos Entre todas as glândulas endócrinas, a tireóide é única na sua capacidade de armazenar grandes quantidades de hormônio. Dentro da luz folicular os hormônios recentemente sintetizados são armazenados na forma de um material colóide. São sintetizados a partir de tirosina e iodeto pelo complexo enzimático da peroxidase. A tirosina é incorporada em ligações peptídicas dentro da tireoglobulina, onde cada molécula contém até 30 moléculas de tiroxina e algumas de triiodotironina. 9 Assim a tireóide armazena seus recém formados hormônios em seus folículos no interior das moléculas de tireoglobulina em uma quantidade suficiente para suprir as necessidades normais do organismo por 2 a 3 meses. A molécula de tireoglobulina não é liberada no sangue circulante, portanto, a tiroxina e triiodotironina devem ser clivadas da mesma, livres são liberados. As superfícies apicais das células foliculares emitem pseudopodes que englobam pequenas porções do colóide, formando vesículas pinociticas, que posteriormente ocorre a fusão dos lisossomas citoplasmáticos com as mesmas. Nos lisossomas contém múltiplas proteinases, que digerem as moléculas de tireoglobulina, liberando a tiroxina e triiodotironina em sua forma livre. A seguir, estes hormônios difundem-se através da membrana basal das células foliculares para o interstício e os capilares, sendo liberados para o sangue. Aproximadamente 93% da tiroxina e 7% de triiodotironina são liberados pela tireóide. Entretanto, quase toda a tiroxina é, finalmente convertida em triiodotironina nos tecidos, pois a mesma passa por um processo de desiodetação. Dessa forma, o hormônio finalmente utilizado pelo organismo consiste principalmente da triiodotironina (T3). 4. Transporte dos hormônios tireoidianos Na circulação a forma do hormônio em maior quantidade é o T4 (tiroxina), devido a sua menor velocidade de depuração metabólica e renovação fracional em comparação à T3 (triiodotironina). O T3 e o T4 circulam quase inteiramente ligados a proteínas, porém é a fração livre que é ativa, ou seja, T3 é a molécula responsável pela maioria das ações tissulares do hormônio tireoidiano, pois é ela que é ativa. A principal proteína de fixação é a globulina fixadora de tiroxina (TBG), e em menor grau, com a pré-albumina de ligação da tiroxina, que são sintetizadas no fígado. Além de transportar os hormônios, elas também tamponam as modificações agudas na função da tireóide e evitam que os hormônios, que são moléculas relativamente pequenas, sejam perdidos na urina, ajudando a conservar o iodeto. 5. Ação celular dos hormônios tireoidianos O efeito geral dos hormônios tireoidianos é ativar a transcrição nuclear de grande número de genes. Antes de aumentar a transcrição genética, ocorre a remoção de um iodeto de quase toda a tiroxina, com conseqüente formação de triiodotironina. Os receptores intracelulares têm afinidade pela triiodotironina. Dessa forma, 90% dos hormônios tireoidianos que se ligam aos receptores intracelulares são T3. Os receptores de T3 e T4 estão fixados aos filamentos de DNA ou em sua proximidade. Ao ocorrer o acoplamento hormônio-receptor, inicia-se o processo de transcrição, formando-se um grande número de diferentes tipos de RNAm, formando centenas de novos tipos de proteínas intracelulares. Dessa forma, tem-se um grande aumento da atividade metabólica celular. 6. Efeitos fisiológicos dos hormônios tireoidianos Os hormônios Tireóideos aumentam a atividade metabólica celular: Os hormônios tireóideos aumentam a atividade metabólica de quase todos os tecidos do organismo. A falta completa de secreção da tireóide determina, habitualmente, a queda do metabolismo basal de 40 a 50% abaixo do normal, enquanto os excessos de secreção da tireóide podem aumentar o metabolismo basal por até 10 60 a 100% acima do normal. A velocidade de utilização dos alimentos para a obtenção de energia encontra-se acentuadamente acelerada. Apesar de a intensidade de síntese protéica estar aumentada, o seu catabolismo também está aumentado. Influenciam a taxa metabólica de duas maneiras: através da estimulação de quase todos os tecidos do corpo para que eles produzam proteínas e através do aumento da quantidade de oxigênio utilizado pelas células. Quando as células trabalham mais intensamente, os órgãos do corpo trabalham mais rapidamente. Crescimento e diferenciação dos tecidos: Os hormônios tireóideos são necessários para o crescimento e diferenciação da maior parte dos tecidos do organismo, pois estimulam a síntese protéica por todos os tecidos corpóreos. Metabolismo dos carboidratos: T3 e T4 estimulam a absorção de glicose pelo intestino, aumentando sua utilização pelos tecidos. Eles também estimulam a quebra do glicogênio em glicose no fígado, coração e músculo estriado esquelético. Metabolismo lipídico: há um aumento na mobilização de lipídios do tecido adiposo e estimulam a oxidação de ácidos graxos. Há redução nos níveis plasmáticos de colesterol Sistema circulatório: Apresentam um efeito direto sobre a excitabilidade do coração, o que eleva a freqüência cardíaca. A elevação da atividade enzimática provocada pelos hormônios tireoidianos provoca um aumento da força de contração cardíaca. Devido ao aumento no metabolismo provocado pelos hormônios tireoidianos, os tecidos utilizam o oxigênio mais rápido que o normal e há uma liberação aumentada de produtos metabólicos. Esses efeitos aumentam a vasodilatação e conseqüentemente o fluxo sangüíneo, levando-se também, desta forma, o débito cardíaco. Sistema nervoso: participa da maturação do snc no “neonatal” (hipocampo, cerebelo,arborização dendrítica, sinapse) e na criança. Estimula a atividade do processos mentais no adulto. Respiração: A freqüência e a profundidade da respiração são aumentados devido aos efeitos causados pelos hormônios tireoidianos como a maior taxa metabólica basal que aumenta a utilização de oxigênio e a formação de dióxido de carbono. Gônadas: os hormônios tireoidianos são necessários para o desenvolvimento normal das gônadas. A calcitonina, outro hormônio secretado pela tireóide, participa do controle da concentração sangüínea de cálcio, inibindo a remoção do cálcio dos ossos e a saída dele para o plasma sangüíneo, estimulando sua incorporação pelos ossos. 7. Regulação da secreção do hormônio tireoidiano Para manter os níveis normais de atividade metabólica no organismo, é necessário que os hormônios tireoidianos sejam secretados de modo continuo e exatamente na quantidade apropriada. O TSH, denominado de tireotropina, é um hormônio da hipófise anterior (adeno-hipófise) e tem o papel de aumentar a secreção dos hormônios tireoidianos. A secreção do TSH é controlado por um hormônio hipotalâmico, o TRH (hormônio de liberação da tireotropina. 11 A regulação da secreção hormonal se faz por feedback negativo de alça longa por T 3 e T4 sobre a adenohipófise e o hipotálamo. Quando a concentração destes hormônios estão elevados inibe-se a produção de TRH pelo hipotálamo e de TSH pela adenohipófise, levando a célula folicular da tireóide a reduzir tanto a captação de iodo como a liberação de vesículas de tireoglobulina. Com isso ocorre uma diminuição da produção de secreção de T3 e de T4. Se o indivíduo não ingere alimentos ricos em iodo o TSH aumenta a captação de iodo mas não há formação de T3 e T4 suficiente, não havendo feedback negativo, provocando permanente estímulo da glândula. Isto leva ao bócio endêmico, que é hipertrofia da glândula tireóide. Tanto o estresse quanto o frio estimulam a liberação de TSHRF (RF: Releasing Factor ou Fator de Libereção) pelo HIPOTÁLAMO, que estimulam a liberação de TSH pela ADENO-HIPOFISE, que por sua vez, estimula a TIREÓIDE a liberar T3 e T4 que aumenta a taxa do metabolismo basal. -Controle da secreção tireoidiana Outro mecanismo que estimula a secreção do hormônio, agora através do estímulo da secreção de TRH pelo hipotálamo, é a noradrenalina e colesterolemia. 8. Distúrbios mais comuns da Tireóide Hipertireoidismo O hipertireoidismo acontece quando a glândula tireóide produz muito hormônio tireoidiano. O aumento da produção deste hormônio causa os seguintes Sintomas: Ansiedade, cansaço ou insônia; tremores; aumento da sudação; falta de ar; dificuldade em enxergar com nitidez; diminuição do peso; inchação da glândula tireóide (bócio); protuberância do globo ocular; intolerância ao calor; taquicardia; aumento do apetite; diarréia. Esta doença pode causar insuficiência cardíaca e morte se não for tratada. Hipotireoidismo: É uma síndrome que se caracteriza pelas manifestações clínicas e bioquímicas devido a deficiência na produção ou ação dos hormônios tireóideos, levando a uma lentidão generalizada dos processos metabólicos. Sintomas: No hipotireoidismo, os processos físicos e mentais do indivíduo tornam-se mais lentos. Há um aumento no peso corporal e uma preferência por ambientes aquecidos (o indivíduo adquire intolerância ao frio). Ocorre constipação intestinal e a taxa cardíaca é reduzida. A pele tornase seca, fria e pálida, o cabelo fica ressecado, quebradiço e tende a cair, a língua aumenta (macroglossia) e a voz torna-se rouca. A libido diminui em ambos os sexos e a ,menorragia é comum nas mulheres. Pode ocorrer edema periorbitário e em membros inferiores. Cretinismo é o termo utilizado para casos de hipotireoidismo congênito associado ao retardo mental, à baixa estatura e ao inchaço de face e mãos característico. Freqüentemente se acompanha de surdo-mudez. O teste do pezinho veio para auxiliar no diagnóstico precoce. O hipotireoidismo no adulto causa a síndrome conhecida como Mixedema, cujo sintoma mais evidente é um edema localizado no rosto que não cede à pressão. O mixedema é devido ao acúmulo excessivo de substância fundamental amorfa no tecido conjuntivo. 12 AS PARATIREÓIDES 1. Anatomohistologia São pequenas glândulas, geralmente em número de quatro, cujo peso total não passa de 0,2 g, localizadas na região posterior da tireóide, em cápsula que reveste os lobos dessa glândula. São abundantemente vascularizadas pelas a.a. tireóideas inferiores e a inervação é essencialmente vasomotora. Apresentam basicamente dois tipos de células: células principais, em maior número, apresentam grande núcleo e citoplasma claro; células oxífilas em menor número apresentam grânulos oxífilicos no citoplasma, grande número de mitocôndrias e que são ausentes nos jovens. As células principais secretam o hormônio paratireóideo (PTH). O papel das células oxífilas não é conhecido, acredita-se que sejam células principais modificadas e que não secretam mais hormônios ou relacionadas com a produção de energia (ATP) das paratireóides. 2. Hormônio Paratireóideo (PTH) É um polipeptídio (84 a.a.), produzido pelas células principais da paratireóide (4 glândulas que se localizam na parte posterior da tireóide). Sua secreção é regulada pelo nível plasmático de cálcio (calcemia) caindo a zero quando este excede 12 mg/100 ml e aumentando quando o cálcio plasmático cai. O hormônio paratireóideo (PTH) estimula a remoção de cálcio da matriz óssea (o qual passa para o plasma sangüíneo), a absorção de cálcio dos alimentos pelo intestino e a reabsorção de cálcio pelos túbulos renais, aumentando a concentração de cálcio no sangue. Neste contexto, o cálcio é importante na contração muscular, na coagulação sangüínea e na excitabilidade das células nervosas. 3. Principais ações do PTH A ação deste hormônio se faz via adenilciclase e AMP cíclico e se expressa por alterações da permeabilidade da membrana das células e organelas. No Tecido Ósseo: O PTH promove o aumento da reabsorção de cálcio e fosfato através da osteólise, que se constitui em uma fase rápida de absorção óssea. Estudos mostraram que o PTH causa remoção dos sais ósseos (cristais de hidroxiapatita) de duas áreas do osso: da matriz óssea e na vizinhança dos osteoblastos ao longo da superfície óssea. A osteólise consiste no aumento da atividade da bomba de Ca++ na membrana osteocística, aumentando a transferência deste do líquido ósseo para o liquido extracelular e deste, para o sangue. 13 Por outro lado, o PTH também apresenta uma ativação sobre os osteoclastos, que se constitui em uma fase mais lenta na absorção óssea. A ativação do sistema osteoclástico ocorre em dois estágios: a ativação imediata dos osteoclastos já formados e formação de novos osteoclastos. Nos Rins: O PTH afeta diretamente o processo de excreção renal de cálcio, pois aumenta a reabsorção nos túbulos renais após a primeira filtragem. Não fosse o efeito do PTH sobre os rins, a perda contínua de Ca++ na urina provocaria grande queda nos níveis sanguíneos e, em seqüência, também nos ossos. A maior parte do cálcio é reabsorvido a nível proximal e independe de hormônio, a menor parte é reabsorvida a nível distal e depende de PTH. É nos rins que o PTH promove a hidroxilação da vitamina D, ou seja, a conversão do 25hidroxicolecalciferol em 1,25-diidroxicolecalciferol (Calcitriol), que é a forma ativa da vitamina D. Por sua vez, o calcitriol (vit. D ativa), exerce vários efeitos sobre o organismo: intestino, rins e ossos, que aumentam a absorção de Ca++ e P0-4 para o líquido extracelular. No Intestino Delgado: Como vimos anteriormente, o PTH não apresenta ação direta sobre o intestino para realizar a absorção de Ca++. Na absorção do cálcio no TGI, tem-se um mecanismo ativo, que vai depender de uma proteína transportadora que o passa para dentro da célula. Esse mecanismo ativo depende da participação de hormônio ativo, o calcitriol (vitamina D ativa - ver abaixo). O calcitriol promove a formação de uma proteína de ligação do cálcio nas células epiteliais do intestino (calbindina) e a formação de ATPase na borda em escova, fatores que aumentam a absorção do cálcio a nível intestinal. O precursor da vit. D, 7-desidrocolesterol (colecalciferol) é formada na pele pelos raios ultravioletas do sol, que posteriormente é transformado pelo fígado em 25hidroxicolecalciferol (calcidiol), para finalmente ser convertido nos rins pelo PTH em 1,25-diidroxicolecalciferol (calcitriol) que é a sua forma ativa (vit D3). A vitamina D3 exerce efeito potente na absorção de Ca++ no intestino, na deposição e reabsorção de Ca++ nos ossos e na absorção renal do Ca++ nos túbulos renais. A deficiência de vitamina D resulta em raquitismo em crianças pela deficiência de cálcio e de fosfato no líquido extracelular. Por outro lado, a deficiência de vitamina D no adulto, resulta em osteomalacia (raquitismo do adulto). ++ -Ativação da Vit. D3 e o seu papel na concentração de Ca (Guyton & Hall, 2008 A calcitonina age como um antagonista fisiológico do PTH, impedindo que o cálcio se eleve acima dos níveis fisiológicos. Atua principalmente no osso, causando uma diminuição da reabsorção óssea através da inibição da atividade osteoclática (osteoclastos – células que reabsorvem tecido ósseo antigo). A secreção da calcitonina, produzida pela células (C) principais da tireóide (também pode ser produzida pelas células do pulmão e cérebro), é estimulada pelos níveis plasmáticos de cálcio, quando estes são elevados, a produção de calcitonina aumenta. Os níveis de calcitonina caem com a idade, e 14 de forma acelerada nas mulheres após a menopausa. A produção de calcitonina é estimulada pelos estrogênios, o que pode explicar este fato. Seus efeitos são mais notáveis em humanos jovens, ainda em fase de crescimento. Em adultos há contraposição quase imediata do PTH, que acaba muitas vezes superando o efeito da calcitonina. As taxas de absorção e deposição diária nos adultos são baixas, pois não há mais tanta remodelação óssea. 4. Controle da secreção do PTH A produção e liberação do PTH é controlado pela concentração plasmática de Ca++ que atua diretamente sobre as células paratireóides através de um receptor de cálcio na membrana plasmática. A diminuição da concentração de Ca++ plasmático estimula a secreção do PTH, e um aumento na sua concentração plasmática acarreta justamente o inverso. - Controle da secreção do PTH e da calcitonina. 5. Distúrbios mais comuns Hipoparatireoidismo Quando há pouca quantidade de PTH, a reabsorção osteocítica do cálcio permutável diminui. Em conseqüência, o nível baixo de Ca++ interstício (hipocalcemia) produz espasmos tetânicos, em particular os músculos da laringe, provocando a obstrução da respiração, que constitui a causa de morte na tetania. Hiperparatireoidismo Quando há excesso de PTH, ocorre uma extrema atividade osteoclástica nos ossos, produzindo a osteíte fibrosa cística. O nível muito alto de Ca++ intersticial produz bradicardia, arritmias, astenia, atonia muscular, anorexia, depressão do sistema nervoso, úlcera péptica, cálculos renais. 15 O PÂNCREAS ENDÓCRINO 1. Anatomohistologia O pâncreas é uma glândula digestiva de secreção interna e externa, de mais ou menos 15 cm de comprimento e de formato triangular, localizada transversalmente sobre a parede posterior do abdome, na alça formada pelo duodeno, sob o estômago. Possui uma cabeça que se encaixa no quadro duodenal, de um corpo e de uma cauda afilada. É uma glândula mista ou anfícrina – apresenta regiões endócrinas (ilhotas de Langerhans) e regiões exócrinas (porção secretora que partem dutos que lançam as secreções para o interior da cavidade intestinal). O pâncreas do ser humano tem de 1 a 2 milhões de ilhotas de Langerhans que são organizadas e torno de pequenos capilares onde são secretados seus hormônios. São constituídas por três tipos principais de células: alfa, beta e delta, que se distinguem umas das outras por suas características morfológicas. 2. Hormônios do Pâncreas Endócrino As chamadas ilhotas de Langerhans são a porção endócrina, onde estão as células que secretam os dois hormônios: glucagon e insulina, que atuam no metabolismo da glicose. O pâncreas endócrino tem cerca de 1milhão de ilhotas e nestas tem pelo menos quatro tipos de células diferentes: • Célula : 20% secreta glucagon; • Célula ß: 75% secreta insulina e amilina; • Célula : 3-5% secreta somatostatina; • Célula F: 2% secreta peptídeo pancreático. As células ß são dominantes, mas na verdade quaisquer dessas células podem controlar uma às outras, no entanto a disposição anatômica das células ß é mais favorável de modo que a insulina em seu caminho para a secreção entra em contato com as outras células. As chamadas ilhotas de Langerhans são a porção endócrina, onde estão as células que secretam os dois hormônios: glucagon e insulina, que atuam no metabolismo da glicose: a) Glucagon: estimula a conversão de glicogênio hepático em glicose do sangue, favorecendo o aumento da glicose circulante. b) Insulina: aumenta a utilização da glicose pelo músculo e outros tecidos, reduz a concentração de açúcar no sangue, aumenta os depósitos de glicogênio e o metabolismo da glicose. Quando tem um funcionamento defeituoso, impede que seu hormônio, a insulina, possa chegar ao sangue; por isso não há combinação de oxigênio com a glicose, a qual permanece inalterada aumentando sua quantidade e provocando, como conseqüência, a diabetes melitos. 16 3. Química, síntese e liberação da insulina A insulina é uma proteína com duas cadeias polipeptídicas ligadas, contendo 21 aminoácidos na cadeia A e 30 aminoácidos na cadeia B. as cadeias unem-se por ligações de dissulfeto. A insulina é sintetizada nos humanos e em outros mamíferos dentro das células das ilhotas de Langerhans, no pâncreas. Um a três milhões de ilhotas de Langerhans formam a parte endócrina do pâncreas, que é principalmente uma glândula exócrina. A parte endócrina totaliza apenas 2% da massa total do órgão. Dentro das ilhotas de Langerhans, as células constituem 60-80% do todo No interior das células , o precursor da insulina é formado a partir de síntese dirigida por DNA ou RNA. Quando a insulina começa ser produzida, ela está sob a forma de pré-pró-insulina, que é inativa. A insulina madura é formada a partir do seu precursor pré-pró-insulina, através de várias reações de proteólise. A remoção de 23 aminoácidos (seqüência de sinalização) na região aminoterminal da pré-pró-insulina e a formação de 3 pontes de dissulfeto produzem a pró-insulina. Posteriormente, nova proteólise remove o peptídeo C formando a insulina madura, composta por 2 cadeias: A e B. São vários os tipos de estímulo e secreção de insulina pelas células β do pâncreas. Esses fatores podem estimular ou inibir a liberação de insulina. Algumas proteínas (arginina, lisina, leucina e alanina), cetoácidos, cálcio, potássio, glucagon ácidos graxos livres, secretina, colecistocinina, acetilcolina, etc. estimulam a secreção de insulina, enquanto exercícios físicos, jejum, galanina, pancreastamina, etc. diminuem. O principal estímulo da secreção é a concentração de açúcar no sangue. O alimento presente no estômago estimula a produção de algumas enzimas citadas acima, que estimulam a secreção de insulina. As células das ilhotas de Langerhans liberação de insulina em duas fases. A liberação de insulina de primeira fase é rapidamente acionado em resposta ao aumento da glicemia. A segunda fase é a liberação sustentada lento de vesículas recém-formados que são acionados de forma independente de açúcar. A descrição do lançamento da primeira fase é a seguinte: A glicose entra nas células pelo transportador de glicose GLUT2 A glicose entra na glicólise e do ciclo respiratório, onde várias moléculas de alta energia do ATP são produzidas por oxidação Fechamento dos canais de potássio-ATP (K +) Despolarização com abertura dos canais de cálcio voltagem (Ca ++) Um maior nível de cálcio no citosol causa a ativação da fosfolipase C, formando inositol e diacilglicerol. Inositol (IP3) liga a proteínas receptoras na membrana do retículo endoplasmático (ER). Isso permite a liberação de Ca ++ do ER via IP3 canais fechado, e ainda aumenta a concentração celular de cálcio. quantidade significativamente maior de Ca++ nas células provoca a liberação de insulina previamente sintetizada, que foi armazenada em vesículas secretoras, por exocitose. 17 4. Transportadores de glicose Assim como todos os hormônios peptídicos, a insulina produz seus efeitos por se ligar a receptores (transportadores) específicos na membrana plasmática de suas células-alvo. A glicose entra em praticamente todas as células por difusão facilitada. Entretanto, existem vários tipos de transportadores de glicose que medeiam este processo: GLUT-1, na captação basal da glicose; GLUT2, sensor na célula ; GLUT-3 e GLUT-4, na captação de glicose nos tecidos insulina-dependentes; GLUT-5, absorção da glicose no jejuno. O subtipo GLUT-4, que é regulado pela insulina, é encontrado principalmente nas células musculares e no tecido adiposo, enquanto que o subtipo GLUT-2 é encontrado no fígado. - Efeitos da glicose nas células alvo: A ligação de insulina no receptor de membrana promove a captura de glicose sanguínea e sua utilização: glicogênese, lipogênese, além da síntese protéica 5. Efeitos da insulina sobre as células alvo Para iniciar seus efeitos sobre as células-alvo, a insulina liga-se, inicialmente, a uma proteína receptora na membrana. O receptor da insulina é uma combinação de quatro subunidades ligadas por pontes de dissulfeto: duas subunidades , que ficam situadas fora da membrana celular; e duas subunidades , que penetram através da membrana. A insulina liga-se à subunidade no exterior da célula, determinando a autofosforilação da subunidade , que por sua vez ativa o sistema tirosina-cinase. A ativação da tirosina-cinase, desencadeia a cascata de fosforilação na célula, aumentando a atividade de enzimas que medeiam os efeitos da glicose sobre o metabolismo da glicose, das gorduras e das proteínas. Por exemplo, o deslocamento dos transportadores de glicose para a membrana celular, a fim de facilitar a entrada da glicose no interior da célula. 18 6. Efeitos metabólicos da insulina Os efeitos metabólicos da insulina são exercidos principalmente sobre as células musculares (cardíacas e esqueléticas), células adiposas e células hepáticas. A. Carboidratos: Após uma refeição rica em carboidratos, a glicose absorvida para o sangue causa rápida secreção da insulina. A insulina causa rápida captação, armazenamento e uso da glicose por quase todos os tecidos do corpo, mas especialmente pelos músculos, tecido adiposo, e fígado. O músculo durante grande parte do dia, não depende da glicose para obter energia, e sim, dos ácidos graxos. Isso ocorre, porque a membrana do músculo em repouso é apenas ligeiramente permeável à glicose, exceto quando a fibra muscular é estimulada pela insulina. Em duas condições os músculos usam grandes quantidades de glicose: uma é durante o exercício moderado ou pesado, mas não requer insulina para isso; a outra é durante as poucas horas após uma refeição. A concentração de glicose é alta, e o pâncreas secreta grandes quantidades de insulina. Isso faz com que haja transporte rápido de glicose para dentro das células musculares. Se o músculo não estiver se exercitando, essa glicose vai ser armazenada sob a forma de glicogênio muscular No fígado, um dos mais importantes efeitos da insulina é fazer com que a maior parte da glicose absorvida, após uma refeição, seja armazenada quase imediatamente sob a forma de glicogênio (glicogenogênese, pela glicogênio sintase). Isso é importante porque entre as refeições, quando a concentração sangüínea de glicose começa a cair, a secreção de insulina diminui rapidamente, e o glicogênio hepático é transformado em glicose impedindo que seus níveis caiam demais. A insulina também aumenta o transporte de glicose para dentro da maioria das outras células do corpo. Esse transporte fornece a porção glicerol da molécula de gordura, e assim, de maneira indireta, a insulina promove a deposição de gorduras nessas células. B. Gorduras A insulina participa do metabolismo das gorduras em longo prazo, mas especialmente importantes, são os efeitos causados pela falta de insulina, como, por exemplo, a aterosclerose, levando na maioria das vezes a acidentes vasculares. Efeito da insulina sobre a síntese e armazenamento de gordura: A insulina aumenta a utilização de glicose pela maioria dos tecidos, diminuindo dessa forma a utilização de gordura. Além disso, a insulina promove a síntese de ácidos graxos. Assim, a insulina não só ajuda a “poupar gordura“, como também participa de sua síntese, quando a ingestão de carboidratos é maior que a necessária, havendo então, a produção de ácidos graxos. Alguns fatores são especialmente importantes nesse processo, como: • depois que a concentração do glicogênio hepático atinge 5 a 6%, sua síntese é inibida por realimentação, e então todo excesso de glicose que entra nas células hepáticas é desviada para a síntese de gordura. A glicose, primeiramente, é convertida a piruvato e em seguida a acetil-CoA, substrato para a síntese do ácido graxo; • quando grandes quantidades de glicose estão sendo usadas para energia, forma-se um excesso de íons citrato e isocitrato, que vão ativar a enzima acetil-CoA carboxilase, necessária para a carboxilação do acetil-CoA na formação de ácidos graxos; 19 • os ácidos graxos formados no fígado são transformados em triglicerídeos e liberados no sangue em lipoproteínas. A insulina ativa a lipoproteína lipase, que “quebra“ novamente os triglicerídeos em ácidos graxos nos capilares do tecido adiposo. Armazenamento de gordura nas células adiposas: A insulina promove o transporte de glicose para o interior da célula adiposa, onde pequena parte da glicose formará ácidos graxos e o grande restante formará grande quantidade de glicerolfosfato, responsável pela síntese do glicerol, necessário para o armazenamento de ácidos no tecido adiposo sob a forma de triacilglicerol. Uso metabólico aumentado de gordura causado pela falta de insulina: Na ausência da insulina, a quebra e o uso da gordura são muito acentuados. Nos casos de Diabetes Mellitus, esta reação é muito intensa. • Lipólise da gordura e liberação de ácidos graxos Na falta da insulina, a enzima lipase sensível a hormônios nas células adiposas torna-se ativada, causando a hidrólise dos triacilglicerídeos armazenados. Conseqüentemente a concentração de ácidos graxos no sangue torna-se elevada dentro de poucos minutos. Este ácido graxo livre tornase então, principal substrato energético utilizado por todos os tecidos do corpo, exceto o cérebro. • Efeitos da falta de insulina sobre as concentrações plasmáticas de colesterol e fosfolipídios O excesso de ácidos graxos no plasma promove a conversão hepática de alguns ácidos graxos em fosfolipídios e colesterol. • A falta de insulina promove cetose e acidose Na falta da insulina e excesso de ácidos graxos no fígado o mecanismo da carnitina como transporte de ácidos graxos para dentro das mitocôndrias torna-se mais ativo. Nas mitocôndrias então, a oxidação dos ácidos graxos ocorre muito mais rápido, liberando quantidades extremas de acetil-CoA, da qual grande quantidade será usada para formar ácido acetoacético que é liberado no sangue. Por outro lado, a falta de insulina inibe a utilização do ácido acetoacético nos tecidos periféricos. Parte do ácido acetoacético é também convertido a ácido hidroxibutírico e acetona. Estas duas substâncias juntamente com o ácido acetoacético, são chamados de corpos cetônicos, que em altas concentrações nos líquidos corporais é chamado cetose. C. Proteínas Quando quantidades excessivas de nutrientes estão disponíveis no sangue, as proteínas também são armazenadas nos tecidos e a insulina é que faz esse armazenamento. Alguns dos fatores que influenciam no armazenamento das proteínas são os seguintes: 1 - A insulina causa o transporte ativo dos aminoácidos para dentro das células. Os mais transportados são: valina, leucina, isoleucina, tirosina e fenilalanina. A insulina compartilha com o hormônio do crescimento a capacidade de aumentar a captação de aminoácidos para dentro das células. 2 - Tem efeito direto sobre os ribossomos, aumentando a tradução de ARN-mensageiro, formando novas proteínas. De algum modo, a insulina “liga” mecanismo ribossômico. Na ausência de 20 insulina, os ribossomos param de trabalhar, como se a insulina acionasse um mecanismo do tipo “ligadesliga”. 3 - Por um período maior, a insulina aumenta a taxa de transcrição de seqüências genéticas de ADN, selecionadas nos núcleos das células, formando quantidades aumentadas de ARN e ainda mais síntese protéica, promovendo uma variada coleção de enzimas para armazenamento de carboidratos, gorduras e proteínas. 4 - A insulina inibe o catabolismo das proteínas, diminuindo a taxa de liberação de aminoácidos das células, especialmente das musculares. Isto resulta presumivelmente de alguma capacidade da insulina de diminuir a degradação normal de proteínas pelos lisossomas celulares. 5 - No fígado, a insulina deprime a gliconeogênese, pois diminui a atividade das enzimas que a promovem. Já que a gliconeogênese usa como substrato os aminoácidos plasmáticos para síntese de glicose, esta supressão conserva os aminoácidos nas reservas de proteínas do corpo. 5. Controle da secreção de insulina O principal fator controlador da secreção da insulina é a concentração plasmática de glicose. Um aumento na concentração plasmática de glicose age sobre as células das ilhotas de Langerhans para estimular a secreção de insulina, enquanto uma diminuição inibe sua secreção. A retroalimentação (feedback) no seu controle é o seguinte: após uma refeição, um aumento na concentração plasmática de glicose estimula a secreção de insulina. A insulina estimula a entrada de glicose no músculo e no tecido adiposo, bem como a captação de glicose pelo fígado. Estes efeitos acabam reduzindo a concentração sanguínea de glicose em nível prérefeição, com isto removendo o estimulo para a secreção de insulina, que retorna o seu nível anterior. A secreção de insulina é aumentada por: Glicose:as células do pâncreas são os mais importantes sensores de glicose do organismo. O aumento de glicose sanguínea leva a um aumento na secreção de insulina Aminoácidos:a ingestão de proteínas causa um aumento transitório dos níveis plasmáticos de aminoácidos induzindo a secreção de insulina Hormônios intestinais, como a secretina, também estimula a secreção de insulina 21 Diabetes mellitus São distúrbios metabólicos nas quais existe uma menor utilização de glicose, por resposta secretora deficiente de insulina, induzindo a hiperglicemia. É uma das dez principais causas de morte. Como funciona o Metabolismo de um paciente diabético 1) O pâncreas é incapaz de liberar quantidades suficientes de insulina para controlar o metabolismo. Inicialmente, a insulina falta apenas quando é necessária em grandes quantidades, como logo após uma refeição. Depois de um tempo, entretanto, a insulina pode faltar mesmo nos períodos de jejum, quando os tecidos estiverem quebrando os alimentos para produzir energia. 2) Sem glicose suficiente para empurrar a glicose para dentro das células, a glicose passa a se acumular no sangue. Ocorre então o aumento da glicemia, ou hiperglicemia. 3) A glicose em excesso no sangue passa através dos rins para a urina, antes que o organismo do diabético consiga utilizar essa glicose para produzir energia. Com isso, o paciente diabético pode começar a urinar demais e ter muita sede. Esses podem ser os primeiros sintomas da doença. O paciente também começa a emagrecer, pois não consegue utilizar a energia dos alimentos, que é perdida através da urina. 4) Com o passar do tempo, o organismo reage ao desequilíbrio da glicemia e podem surgir importantes complicações. Essas complicações podem ser prevenidas se o diagnóstico for feito cedo e o tratamento for iniciado o quanto antes, com o objetivo de manter a glicemia normal ou muito próxima dos valores normais. Tipos de diabetes Existem 2 tipos principais de diabetes. a) Diabetes Mellitus Tipo 1 (insulino-dependente ou diabetes juvenil) – é a forma mais severa. Atinge geralmente pessoas mais jovens, incluindo crianças e adolescentes, a maioria com peso normal, mas pode atingir pessoas mais velhas. Acontece devido à destruição das ilhotas de Langerhans por algum motivo, levando à ausência completa ou quase completa de produção de insulina. As pessoas com diabetes tipo 1 (DM 1) precisam tomar injeções de insulina diariamente para controlar essa condição. Os sintomas da DM 1 podem surgir muito subitamente. b) Diabetes Mellitus Tipo 2 (não insulino-dependente) – a forma mais comum da doença, responsável por 90 a 95% dos casos de diabetes. Neste tipo de diabetes, o que acontece é que a pessoa torna-se resistente à ação da insulina. Ou seja: o pâncreas produz insulina em quantidades normais no início da doença, mas essa insulina não age nos seus tecidos-alvos como deveria, o que faz com que o pâncreas acabe produzindo mais e mais insulina para compensar esse defeito. Com o passar dos anos, o pâncreas acaba se “cansando”, e deixa de ser capaz de compensar a resistência à insulina – é nesse momento que surge a hiperglicemia, e é feito então o diagnóstico de Diabetes Tipo 2. O DM 2 está intimamente relacionado ao excesso de peso, a hábitos alimentares inadequados e ao sedentarismo, que aumentam a resistência à insulina. Como mais e mais pessoas estão se tornando obesas, o número de indivíduos com DM 2 também está aumentando de forma assustadora. Freqüentemente o DM 2 pode ser controlado com um estilo de vida saudável, mas muitos necessitam 22 de medicações para controlar sua glicemia e alguns precisam usar insulina, principalmente aqueles pacientes com muitos anos de diabetes. Sintomas da diabetes mellitus Se a doença estiver no início, o paciente pode não perceber quaisquer sintomas que chamem a sua atenção. Por ser uma doença relativamente assintomática no seu início, estima-se que cerca de 50% dos diabéticos não saibam do diagnóstico. Ou seja: metade dos diabéticos não sabe que tem diabetes! Por isso é importante a avaliação médica e a dosagem da glicemia no sangue em pessoas com alto risco para desenvolver diabetes ou que apresentem quaisquer sintomas compatíveis com diabetes. Em pessoas com doença mais avançada ou com glicemia mais alta, alguns sintomas muito sugestivos de diabetes são: - Vontade de urinar a toda hora, com grande quantidade de urina (poliúria); sede em excesso (polidipsia); aumento do apetite (polifagia); sonolência; dores musculares e câimbras; infecções freqüentes (pele, urina e genitais); perda de peso sem motivo aparente, apesar de estar comendo até mais que o normal; distúrbios da visão; fraqueza intensa, mal-estar, desânimo; “formigamentos” nas mãos e nos pés; lesões nas pernas ou nos pés de difícil cicatrização Complicações Agudas: As complicações agudas são provocadas por um grave desequilíbrio no metabolismo, constituindo uma emergência médica. A acidocetose diabética desenvolve-se espontaneamente na diabetes do tipo I, constituindo em alguns casos a primeira manifestação da doença, e com menor freqüência na diabetes do tipo II, na qual apenas se manifesta em determinadas situações de stress, produzindo-se quando o organismo, ao não poder utilizar a glicose por falta de insulina, obtém energia a partir de lipídeos, mediante a sua decomposição através do metabolismo, o que provoca a formação de compostos denominados corpos cetônicos, cuja acumulação pode provocar consideráveis alterações do meio interno. O episódio, que se estabelece ao fim de algumas horas ou dias, manifesta-se inicialmente por um notório aumento da poliúria e por sede, que nestes casos não costuma ser acompanhada por fome, como é habitual nos diabéticos, mas por perda de apetite. Caso não se proceda ao tratamento imediato, a situação agrava-se, conduzindo ao aparecimento de náuseas, vômitos, dor abdominal, dificuldade em respirar e, por fim, sonolência, apatia e estado de coma. A hiperglicemia hiperosmolar é uma complicação aguda que afeta essencialmente as pessoas de idade avançada afetadas pela diabetes do tipo II, sendo provocada por valores de glicemia muito elevados originados por um grave estado de desidratação conseqüente a perda de líquidos pela urina devido a hiperglicemia. O quadro manifesta--se inicialmente por um agravamento da poliúria, dores 23 abdominais e sinais típicos de desidratação, como secura da boca, perda do turgor cutâneo e um cansaço extremo. Caso não se proceda ao tratamento adequado, pode originar uma grave hipotensão arterial que conduz a um choque cardiovascular e algumas alterações neurológicas que podem evoluir para um estado de coma e provocar a morte. Tardias: Caso não se proceda ao seu controlo regular durante vários anos ou, então, devido a uma hiperglicemia persistente, a diabetes, nas suas fases avançadas, pode originar complicações muito variadas que envolvem diversos tecidos e órgãos. Um habitual tipo de complicação crônica é a microangiopatia diabética, um processo patológico que afeta os pequenos vasos sanguíneos capilares, provocando vários problemas na irrigação de vários tecidos. Entre as principais repercussões destacam-se os problemas nos rins (nefropatia), que podem conduzir a uma insuficiência renal, e os da retina (retinopatia), que podem provocar a perda da visão. Outra complicação tardia típica é a macroangiopatia diabética, um processo patológico que afeta os vasos sanguíneos de médio e grande calibre, provocando lesões e conseqüências semelhantes ás provocadas pela aterosclerose, ou seja, doença coronária, acidentes vasculares cerebrais e obstruções vasculares que podem provocar uma gangrena. Por fim, outra complicação tardia é a neuropatia diabética, uma doença que implica determinadas alterações no funcionamento do sistema nervoso. Por um lado, como são afetados os nervos periféricos (polineuropatia), sobretudo dos membros inferiores, provoca problemas sensoriais e uma especial propensão para o padecimento de úlceras cutâneas. Por outro lado, dá origem a problemas nas estruturas pertencentes ao sistema nervoso autônomo, o que provoca alterações no funcionamento de aparelhos orgânicos tão diferentes como o cardiovascular e o geniturinário. Diabetes Insípido ≠ Diabetes Mellitus Outro tipo de diabetes, menos freqüente, é o diabetes insípido. Deve-se a carências na síntese do chamado hormônio antidiurético, ADH ou vasopressina, ou a um bloqueio de sua ação. Essa substância, secretada pela hipófise posterior ou neuro-hipófise, atua no túbulo renal e tem como principal função a de regular e limitar a eliminação de água pela urina, dificultando a eventual desidratação do organismo. Caso se registre uma disfunção ou destruição dos núcleos hipotalâmicos - centros cerebrais onde se sintetiza o ADH (Núcleos supra-ópticos)- ou dos condutos através dos quais passa o ADH, desenvolve-se o diabetes insípido classificado como supra-óptico hipofisário. Se a produção do hormônio se revela normal mas os túbulos renais não respondem à ação da vasopressina, produz-se o diabetes insípido nefrogênico. Em qualquer dos dois casos registra-se abundante poliúria, em que o paciente chega a eliminar até 15 litros de urina por dia, enquanto os níveis normais não ultrapassam os dois litros diários. Ao mesmo tempo, os pacientes sofrem intensa sensação de sede e há risco de desidratação. Diversamente do que ocorre no diabetes melito, nesse processo não se verifica excesso de glicose no sangue nem na urina, daí o nome insípido. O tratamento compreende medidas como a administração de hormônios de composição afim à da vasopressina (eficaz somente na modalidade supra-óptica), a redução da carga renal e a ingestão de fármacos diuréticos. 24 AS ADRENAIS 1. Anatomohistologia São duas glândulas localizadas sobre os rins, achatadas com formato de meia-lua. O tamanho das adrenais varia com a idade e as condições fisiológicas do indivíduo, mas em geral, no adulto, as duas glândulas juntas pesam cerca de 8 g. As adrenais são constituídas por uma camada denominada cortical ou córtex da adrenal, e outra camada denominada camada medular ou medula da adrenal, secretoras de hormônios diferentes, comportando-se como duas glândulas. -Histologia adrenal O córtex da adrenal é constituído por três camadas: Zona glomerulosa: constitui cerda de 15% do córtex, situada imediatamente abaixo da cápsula conjuntiva; suas células dispõem-se em agrupamentos globosos, envolvidos por capilares. Secretam hormônios chamados MINERALOCORTICÓIDES, cujo principal representante é a Aldosterona. Zona fasciculada: constitui cerca de 75% do córtex, suas células poliédricas formam cordões paralelos entre si e perpendiculares à superfície do órgão. Essas células são as principais produtoras de GLICOCORTICÓIDES, cujo principal representante é o Cortisol Zona reticulada: zona mais interna do córtex constitui-se cerca de 10% do córtex, limítrofe da camada medular, as células dispõem-se em cordões irregulares, formando um aspecto de rede. Local onde são produzidos hormônios sexuais, principalmente Andrógenos, em especial a dehidroepiandrosterona. Sua ação, porém, é menos de 1/5 daquela exercida pelo andrógeno testicular (testosterona). Medula adrenal: As células dessa camada são poliédricas e dispõem-se em cordões que formam uma intensa rede em cujas malhas há capilares e vênulas. As células contém grânulos citoplasmáticos que se tornam marrons quando expostos a sais de cromo, sendo, por esse motivo, denominadas células cromafins. Estas secretam catecolaminas, representadas pela adrenalina e pela noradrenalina, substâncias mediadoras químicas do sistema nervoso simpático. Ao contrário do córtex, que lança seus produtos continuamente na circulação, a medula os acumula. A adrenalina e a noradrenalina são geralmente liberadas depois de fortes reações emocionais, como, por exemplo, o susto. 25 2. Hormônios das adrenais Os diversos hormônios produzidos pelo córtex da adrenal são esteróides derivados do colesterol e são divididos em grupos: Mineralocorticóides: atuam no metabolismo de minerais, principalmente no controle dos íons sódio e potássio. O principal mineralocorticóide, responsável por pelo menos 95% da função mineralocorticóide da supra-renal, é o hormônio aldosterona. Outros mineralocorticóides bem menos importantes são: desoxicorticosterona e corticosterona. Glicocorticóides: atuam no metabolismo dos carboidratos, proteínas e gorduras. O principal hormônio deste grupo é o cortisol. Androgênios: produzem efeitos masculinizantes, semelhantes àqueles produzidos pela testosterona, secretada em grande quantidade pelas gônadas masculinas. A medula (parte interna) das adrenais secreta hormônios derivados da tirosina (catecolaminas): a adrenalina (epinefrina) em 85% e noradrenalina (norepinefrina) em 15%. O principal mecanismo de controle da secreção medular é o simpático que mantém uma ação tônica sobre a glândula. Quando aumenta a atividade simpática, exagera-se na liberação das catecolaminas adrenais. 3. Síntese e transporte dos hormônios adrenocorticais Todos os hormônios adrenocorticais são sintetizados a partir do colesterol, proveniente das lipoproteínas de baixa densidade (LDL). Praticamente todas as etapas da síntese dos esteróides adrenais ocorrem em duas organelas celulares: as mitocôndrias e o reticulo endoplasmático. Cerca de 95% do cortisol no plasma liga-se a uma globulina plasmática (transcortina) e em menor grau à albumina. Esse elevado grau de ligação às proteínas plasmáticas diminui a velocidade de eliminação do cortisol no plasma. Dessa forma, o cortisol tem meia-vida relativamente longa (60 a 90 minutos). Apenas cerca de 60% da aldosterona se combinam com as proteínas plasmáticas e 40% encontram-se de forma livre no plasma. Dessa forma, a aldosterona tem meio-vida relativamente curta (20 minutos). 4. Ação celular dos hormônios adrenocorticais Aldosterona Apresenta rápida difusão através da membrana celular devido a sua lipossolubilidade. No citoplasma, combina-se com proteínas receptoras citoplasmáticas altamente especificas. O complexo aldosterona-receptor se difunde para o interior do núcleo induzindo o DNA a formar o RNAm. O RNAm difunde-se de volta para o citoplasma atuando com os ribossomos, formando proteínas (enzimas e proteínas de transporte da membrana), necessárias para o transporte do sódio, potássio e hidrogênio através da membrana celular. Cortisol Semelhante com outros hormônios esteróides interage com os receptores intracelulares da célula-alvo, por ser altamente lipossolúvel. No citoplasma celular, liga-se a sua proteína receptora para posteriormente agir no núcleo da mesma. Os glicocorticóides aumentam ou diminuem a 26 transcrição de numerosos genes, alterando a síntese do RNAm das proteínas que medeiam seus múltiplos efeitos fisiológicos. 5. Funções dos hormônios adrenocorticais Aldosterona Atua nos rins aumentando a reabsorção de sódio e a secreção de potássio nos túbulos renais tendo como conseqüência o aumento do volume do liquido extracelular e a pressão arterial. Exerce quase o mesmo efeito sobre as glândulas sudoríparas, glândulas salivares e intestino grosso. Cortisol Metabolismo dos carboidratos: Estimulação da gliconeogênese: aumenta as enzimas necessárias para converter os aminoácidos em glicose no fígado e mobilização dos aminoácidos dos músculos. Tendo como conseqüência o aumento da concentração de glicose sanguínea, aumento da gliconeogênese hepática (proteínas e gorduras glicose) e diminuição da utilização de glicose pelas células. Metabolismo das proteínas: Ação sobre o metabolismo das proteínas consiste em: diminuição das reservas de proteínas em todos os tecidos, exceto no fígado; promove o seqüestro de aminoácidos dos músculos para o fígado e aumenta a intensidade de formação de proteínas pelas células hepáticas. Metabolismo das gorduras: Apresenta atividade lipolítica no tecido adiposo, promove mobilização dos ácidos graxos do tecido adiposo. A utilização aumentada de ácidos graxos para a energia metabólica é fator importante na conservação da glicose. Entretanto, a secreção excessiva de cortisol promove deposição abundante de gordura no tórax e na cabeça, resultando em tronco semelhante a um búfalo e face redonda “de lua cheia”, sinais da síndrome de Cushing. Outros efeitos do cortisol: resistência do organismo ao estresse, efeitos antiinflamatórios, bloqueia reações alérgicas. 6. Regulação da liberação dos hormônios adrenocorticais Aldosterona Está relacionada com a regulação das concentrações de eletrólitos do liquido extracelular, do volume do liquido extracelular, volume sangüíneo, da pressão arterial e outras funções renais. De todos os fatores, a concentração de K+ e o sistema renina-angiotensina são os mais potentes na regulação da secreção da aldosterona. 27 Cortisol: -Regulação da secreção do cortisol (Guyton & Hall). O estresse fisiológico estimula o Hipotálamo, este libera o Fator Liberador de Corticotropina (CRF) que é secretado no sistema porta Hipotálamo-Hipofisário, sendo levado para a adeno-hipófise. Por sua vez, a hipófise produz a liberação do ACTH (H. Adenocorticotropico) para o sangue. Na corrente circulatória o ACTH chega ao córtex adrenal para liberar o cortisol que promoverá os seguintes efeitos fisiológicos: mobilização de gordura e proteína; gliconeogênese que ajudam no reparo da lesão e impede ruptura de lisossomos. Com a elevação da concentração plasmática de cortisol, o mesmo exerce um efeito inibitório sobre o hipotálamo, diminuindo a formação de CRF e conseqüentemente, a hipófise anterior diminui a formação de ACTH (feedback negativo). 7. Distúrbios comuns do córtex adrenal Hipoadrenalismo - Doença de Addison Deficiência de aldosterona: redução do volume do liquido extracelular, perda do volume plasmático, diminuição do débito cardíaco e morte por choque circulatório. Deficiência de cortisol: perda dos níveis normais de glicemia, depressão das funções metabólicas do organismo, tornando altamente suscetível aos efeitos do estresse. Hiperadrenalismo - Síndrome de Cushing Quantidades anormais de cortisol provoca uma cascata complexa de alterações orgânicas. Mobilização de gordura da parte inferior para a superior do corpo: produzindo tórax de búfalo e face de “lua cheia”; perda de proteínas nos músculos com intensa fraqueza; supressão do sistema imune; diminuição do colágeno subcutâneo resultando em grandes estrias púrpuras pela ruptura; deposição diminuída de proteínas nos ossos, resultando em osteoporose. A secreção excessiva de androgênios também causa efeitos importantes como: acne e hirsutismo (crescimento excessivo de pelos faciais). 28 BIBLIOGRAFIA http://www.afh.bio.br/endocrino/endocrino1.asp wikipedia.org/wiki/Sistema_end%C3%B3crino http://www.endocrino.org.br/oqtrata_010c.php CORDOVA, Alfredo. Fisiologia Dinâmica. S/e. Rio de Janeiro: Guanabara Koogan, 2006. DOUGLAS, C. R.; Tratado de fisiologia aplicada às ciências médicas. 6 ed. Rio de Janeiro: Guanabara koogan, 2006. GUYTON, A. C. & HALL, J. E. Tratado de Fisiologia Médica. 10 ed. Rio de Janeiro: Guanabara Koogan, 2002. SCHAUF, C. Fisiologia Humana. Rio de Janeiro: Guanabara Koogan, 1993. WIDMAIER, E.; RAFF, H.; STRANG, K. Fisiologia Humana: os mecanismos das funções corporais. 9 ed. Rio de Janeiro: Guanabara Koogan, 2006. 29
Download