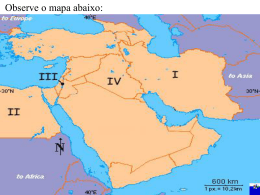
Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 02: O Ministério Público do Rio Grande do Sul realizou a Operação "Leite Compensado", com o objetivo de desbaratar uma quadrilha de empresas de transporte de leite que adulterava o produto cru antes de entregar para as indústrias. As empresas investigadas transportaram aproximadamente 100 milhões de litros de leite entre abril de 2012 e maio de 2013. Desse montante, estima-se que um milhão de quilos de ureia [(NH2)2CO] contendo formol (H2CO), tenham sido adicionados. A simples adição de água com o objetivo de aumentar o volume acarreta perda nutricional, que é compensada pela adição da ureia. Nº INSCRIÇÃO: ____________ O organismo humano sintetiza a ureia a partir da amônia, que é um produto do metabolismo celular do fígado, intestino e rins, principalmente. O excesso de ureia pode causar insuficiência renal, tendo como sintomas perda de apetite, alteração no paladar, distúrbios neurológicos e até alteração na coloração da pele. PARTE 1 – QUESTÕES DE ESCOLHA SIMPLES Escrever o NÚMERO DE INSCRIÇÃO na grade de respostas e nas folhas de respostas das questões descritivas. Ao término da prova entregar somente a grade de respostas e as folhas de respostas das questões descritivas. A prova é constituída de 20 questões que devem ser respondidas com tinta azul ou preta e sem rasuras. As 15 primeiras questões são de escolha simples (escolher apenas uma alternativa) e devem ter suas respostas marcadas na grade que se encontra na folha de respostas, sem rasuras. Para cada questão CORRETA será atribuído 0,4 ponto. As questões numeradas de 16 a 20 são descritivas e devem ser respondidas na folha de respostas. Sobre esses compostos, são feitas as seguintes afirmações: I- A amônia, à temperatura ambiente, é um gás que, em contato com a água, forma uma base forte chamada hidróxido de amônio. II- O número de oxidação do carbono na ureia e no formol é igual a zero. III- Tanto as moléculas de água como as moléculas de amônia encontram-se unidas por ligações de hidrogênio. IV- Amônia, formol, ureia e água apresentam, respectivamente, geometria piramidal, trigonal plana, trigonal plana e angular. V- 1 mol de ureia tem massa correspondente a aproximadamente 0,5 mol de formol. Estão corretas: a) Somente III e IV b) Somente II, IV e V c) Somente I, III e V d) Somente II, III e IV e) Somente I, II, III e IV Questão 01: Sobre os haletos de hidrogênio HF, HCl, HBr e HI, são feitas as seguintes afirmações: I- Somente o HF apresenta ligações de hidrogênio. II- Nas ligações entre os átomos de hidrogênio e halogênio, nos respectivos haletos acima, predominam ligações covalentes polares, porém suas moléculas são apolares. III- No HCl e no HBr predominam as forças intermoleculares tipo dipolo-dipolo. IV- Em soluções aquosas todos são classificados como hidrácidos, fixos e fortes. V- Por apresentar maior massa molecular, o HI é o que apresenta maior ponto de ebulição. Questão 03: Os compostos brometo de amônio, cianeto de potássio, sulfato de sódio e iodeto de potássio, ao serem dissolvidos em água pura, deixam o meio, respectivamente: a) básico, ácido, ácido, neutro b) básico, básico, neutro, neutro c) ácido, básico, neutro, neutro d) ácido, básico, básico, neutro e) ácido, básico, neutro, ácido Estão corretas: a) Todas b) Somente I, III, IV e V c) Somente II, IV e V d) Somente I e III e) Somente II e III ~1~ Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 04: Para o bom funcionamento do organismo, devemos ingerir, diariamente, uma pequena quantidade de sais minerais, que são encontradas em alguns alimentos. Dentre os principais íons relevantes ao bom funcionamento do organismo, podemos ilustrar, conforme Tito & Canto no livro: Química na Abordagem do Cotidiano. Questão 05: A produção de ferro gusa, que é a principal matéria-prima para a fabricação do aço, ocorre em altos-fornos, em várias etapas. A transformação que é observada na entrada e na saída de um alto-forno é representada pela equação global não balanceada abaixo: Fe2O3(s) + C(s) + O2(g) → Fe(s) + CO2(g) Sobre essa equação e sobre todas as espécies envolvidas, são feitas as seguintes afirmações: I- A soma total dos menores coeficientes inteiros possíveis é igual a 20. II- A molécula do gás formado apresenta geometria linear e é apolar. III- Partindo-se de 5 mols de oxigênio, obtém-se 5 mols de gás carbônico. IV- O óxido de ferro III tem caráter anfótero e o gás carbônico tem caráter ácido. V- Uma das formas alotrópicas do carbono é o diamante e do oxigênio, é o ozônio. Estão corretas: a) Somente I, II, III e V b) Somente II, III, IV e V c) Somente I, III e V d) Somente II, IV e V e) Somente II e IV Considere as afirmações abaixo: Questão 06: A seguir você encontra uma relação de oito substâncias numeradas. Encontre uma correspondência com as cinco características na sequência, numerando-as: I- Comparando os cátions responsáveis pelo funcionamento dos músculos e nervos, o que tem maior raio atômico é o potássio. II- Os elementos que originam os íons responsáveis pela formação dos glóbulos vermelhos pertencem ao mesmo período da tabela periódica, e são elementos de transição interna. III- É obtido um composto de fórmula Ca3PO4, quando ocorre a atração eletrostática entre os íons que formam ossos e dentes. IV- Considerando os íons responsáveis pelo funcionamento das enzimas, pode-se dizer que o íon zinco tem maior número de elétrons no subnível d do que o íon manganês II. V- Os sais formados a partir dos íons responsáveis pelo funcionamento dos nervos e músculos são todos solúveis em água. ( ( ( ( ( Pode-se afirmar que as afirmativas corretas são: (1) (2) (3) (4) (5) (6) (7) (8) CO2 N2 H2O2 O2 K2O H2 HCN HNO3 ) Gás mais abundante do ar. ) Substância gasosa à temperatura ambiente e de elevada toxicidade. ) Quando dissolvido em água forma solução com pH > 7, ou seja, básico. ) Substância na qual o elemento hidrogênio tem número de oxidação igual a zero. ) É um óxido ácido. A sequência correta, de cima para baixo, é: a) 2 – 7 – 5 – 6 – 1 b) 4 – 7 – 3 – 6 – 8 c) 6 – 3 – 1 – 8 – 7 d) 4 – 6 – 5 – 7 – 1 e) 2 – 6 – 5 – 3 – 8 a) II e III b) I e IV c) II e V d) II, III e IV e) I, IV e V ~2~ Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 07: Um prego, constituído predominantemente de ferro, foi mergulhado numa solução aquosa de sulfato de cobre II. Após dez minutos, observou-se que a superfície do prego adquire uma tonalidade vermelho-alaranjada, e a solução, inicialmente azul, passa a incolor. Questão 09: O desenho abaixo representa um processo de separação por destilação simples. A reação que ocorre é a seguinte: Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s) Baseado nessa reação e nas espécies envolvidas, as seguintes considerações são feitas: I- É uma reação de síntese. 2+ II- A espécie Cu é isoeletrônica do átomo de cobalto. III- O raio do átomo de ferro é maior que o raio do íon ferroso. IV- A energia de ionização necessária para transformar o ferro metálico em cátion férrico é maior que a energia de ionização necessária para transformá-lo em cátion ferroso. V- Segundo o diagrama de Linus Pauling, o subnível mais energético do cátion 2 cúprico é o 4s . Estão corretas: a) Somente I, III e IV b) Somente II. III e IV c) Somente I, IV e V d) Somente II e V e) Somente II e III Sobre esse processo e baseado nesse desenho, são feitas as seguintes afirmações: I- É recomendado para separar misturas homogêneas L-L, com pontos de ebulição próximos. II- A solução a separar encontra-se num balão volumétrico e o líquido mais volátil é recolhido em um erlenmeyer. III-O condensador é formado por um duto interno e ao redor deste passam os vapores gerados. IV- A entrada de água fria no condensador se dá pela sua parte superior. V- Não é recomendado para separar misturas homogêneas S-L, como NaCl e água, por exemplo. Questão 08: Indicadores ácido-base são substâncias que alteram sua cor original, quando expostos às diferenças de pH. Em uma solução aquosa diluída do indicador ácido-base HA, ocorre o seguinte equilíbrio: + (aq) HA(aq) H apresenta cor azul. + - - A (aq) , onde HA apresenta cor vermelha e a espécie A Qual dos gases abaixo que, borbulhando nessa solução, torna-a nitidamente azul? Estão corretas: a) SO2 b) HCl c) CO2 d) CO e) NH3 a) Todas b) Nenhuma c) Somente I, II, III e IV d) Somente I, III, IV e V e) Somente I e II ~3~ Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 10: Considere a seguinte equação química genérica abaixo, que ocorre em uma só etapa (reação elementar): A(g) + 2 B(g) → 2 C(g), Sobre essa reação, pode-se afirmar que: Questão 12: Bafômetro é um instrumento que permite determinar a concentração de álcool (etanol) em uma pessoa, analisando o ar exalado pelos pulmões. Todos os tipos de bafômetros são baseados em reações químicas, e os reagentes mais comuns são dicromato de potássio e célula de combustível. A diferença entre estes dois reagentes é que o dicromato muda de cor na presença do álcool enquanto a célula gera uma corrente elétrica. Este último é mais moderno, sendo o mais utilizado pelos policiais do Brasil. I- A velocidade da reação depende apenas da temperatura. II- Duplicando a concentração de B e mantendo a concentração de A constante, a velocidade da reação quadruplica. III- Duplicando a concentração de A e mantendo a concentração de B constante, a velocidade da reação duplica. IV- Duplicando a concentração de B e reduzindo à metade a concentração de A, a velocidade da reação duplica. V- A velocidade fica inalterada ao variar-se igualmente as concentrações de A e de B. Nos bafômetros que usam dicromato de potássio, o motorista deve assoprar o bafômetro com força em um canudinho, que conduzirá o ar de seus pulmões para um analisador contendo uma solução ácida de dicromato de potássio, inicialmente alaranjada. Se o ar nele soprado contiver álcool, haverá alteração dessa cor para verde. A maior ou menor alteração da cor, indicará o grau de embriaguez do motorista. Estão corretas as afirmativas: a) I, II e III b) III, IV e V c) I e II d) II, III e IV e) III e V A reação que ocorre é a seguinte reação, não balanceada: K2Cr2O7 + H2SO4 + CH3CH2OH → CH3COOH + K2SO4 + Cr2(SO4)3 + H2O etanol ácido acético Sobre essa reação, assinale a alternativa correta: Questão 11: Dada a curva de solubilidade de um sal em água: a) O dicromato de potássio é o agente oxidante e o ácido sulfúrico é o agente redutor. 6+ 3+ b) A mudança de cor ocorre devido à oxidação do cromo de Cr para Cr . c) Um dos carbonos do etanol sofre oxidação, passando de 1- para 2+. 6+ 3+ d) O cromo se reduz de Cr para Cr , pois perde 3 elétrons. e) O número de oxidação do enxofre é o mesmo em todos os compostos. Questão 13: Com relação à reação de combustão completa, não balanceada, abaixo, C6H14 + O2 CO2 + H2O + calor , afirma-se: Pode-se concluir que: a) A quantidade de calor liberada independe do estado físico dos produtos. b) Há mais energia armazenada nos reagentes do que nos produtos. c) A quantidade de energia liberada independe da massa dos reagentes. d) O valor da variação da entalpia (ΔH) é positivo. e) 258 g do combustível fornecem 36 mols de gás carbônico. a) Trata-se de uma dissolução exotérmica. b) O resfriamento de 250 g dessa solução saturada, de 30 ºC para 20 ºC, provoca a formação de 10 g de cristais. c) A 20 ºC, 25 g de sal em 100 g de água formam uma solução insaturada. d) A 30 ºC, 25 g saturam 100 g de água, sem formação de precipitado. e) Abaixo de 20 ºC, a solubilidade do sal é maior que 15 g de sal/100 g de água. ~4~ Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 14: Em 1986, um reator nuclear de uma usina elétrica situada em Chernobyl (Ucrânia) sofreu uma avaria, devido a um superaquecimento, causando um vazamento de material radioativo. Esse incidente foi responsável por um grande número de mortes imediatas e outras tantas, nas semanas e nos meses seguintes. A nuvem radioativa atravessou vários países da Europa, provocando, durante o trajeto, a precipitação dos radioisótopos, contaminando a agricultura, animais (e seus subprodutos, como ovos, leite, etc.) e pessoas. QUESTÕES ANALÍTICO-EXPOSITIVAS Questão 16: O nitrato de sódio, também conhecido como salitre do Chile é usado, entre outras coisas, para fabricação de fertilizantes e explosivos e para preservação da cor de produtos embutidos, como carnes, salsichas, salames, presuntos, etc. Pode ser obtido pela reação do ácido nítrico com o hidróxido de sódio. 90 Dentre esses radioisótopos, um dos mais perigosos era o Sr, principalmente por poder substituir o cálcio, incorporando-se aos ossos, o que ocorre porque ambos são semelhantes, pois pertencem à mesma família da tabela periódica. Baseado nessa reação: a) Escrever a equação química de obtenção do nitrato de sódio. b) Calcular a massa, em g, de sal obtido, partindo-se de 4 g de base, com 80 % de pureza. c) Determinar o grau de pureza do nitrato de sódio, supondo-se que 400 g deste sal contêm 20 g de impurezas. d) Calcule a quantidade de matéria de ácido nítrico necessária para obter 510 g de sal. 90 Sabendo-se que o Sr tem uma meia-vida aproximada de 28 anos, o tempo, em anos, necessário para que uma amostra de 64 g desta substância radioativa fique reduzida a uma massa de 2 g será de: a) 140 b) 112 c) 84 d) 56 e) 32 Questão 17: Identifique e represente a geometria molecular das seguintes substâncias: a) H2Se b) AsH3 c) CCl4 d) HCN Questão 15: Com relação ao conceito de equilíbrio químico e aos fatores que o afetam, avalie as seguintes alternativas: I- Para o equilíbrio N2(g) + 3 H2(g) recipiente desloca o equilíbrio para a direita. 2 NH3(g) , uma redução no volume do III- No sistema em equilíbrio 2 NO(g) + O2(g) 2 NO2(g) de ΔH = - 27 kcal, a quantidade de NO2 aumentará com a diminuição da temperatura Questão 18: A análise da solução sobrenadante de um sistema bifásico sólido-líquido revelou as seguintes concentrações: + -3 [Ag ] = 1,0 x 10 mol/L 2-1 [SO4 ]= 1,0 x 10 mol/L -7 [Cl ] = 1,6 x 10 mol/L IV – Uma reação reversível atinge o equilíbrio quando a velocidade da reação direta for maior do que a velocidade da reação inversa. Sabendo-se que: Kps AgCl = 1,6 x 10 responda: Estão corretas somente as alternativas: a) Qual a constituição do sólido formado? Justifique através de cálculos. b) Qual a massa de íons sulfato presente em 100 L da solução sobrenadante? c) Quantos ppm de íons cloreto há no sobrenadante? II- Após estabelecido o equilíbrio, as reações direta e inversa cessam e as concentrações molares de todos os compostos envolvidos permanecem constantes. a) I, II e III b) I e IV c) I e III d) II, e IV e) II e III ~5~ -10 (mol/L) 2 e Kps Ag2SO4 = 1,4 x 10 -5 3 (mol/L) , Olimpíada de Química do Rio Grande do Sul – 2013 MODALIDADE EM2 Questão 19: Sobre a pilha representada abaixo, pede-se: QUESTÃO MODALIDADE EM-2 01 02 03 04 05 Potenciais de redução: E o Cu = + 0,34 V; E o Ag 06 = + 0,80 V 07 a) Seu cátodo e seu ânodo. b) Quem se oxida e quem se reduz. c) Qual eletrodo terá sua massa aumentada? d) Qual das soluções irá diluir-se? e) A reação catódica. f) A reação anódica. g) A reação global. h) Sua ddp. 08 09 10 11 Questão 20: Uma amostra de 2,0 g de barrilha (carbonato de sódio impuro) foi totalmente dissolvida em 120,0 mL de solução 0,2 mol/L de ácido clorídrico. O excesso de ácido foi neutralizado por 40,0 mL de solução 0,1 mol/L de hidróxido de sódio. 12 13 14 a) Faça as reações envolvidas nessa análise. b) Determine o teor de carbonato de sódio, em % massa, na amostra de barrilha. c) Determine o volume de gás liberado, nas CNTP. 15 Boa Prova! ~6~ D A C E D A B E B D D E B A C
Baixar