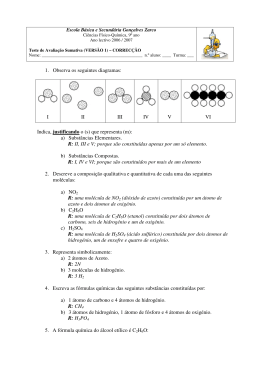
MÓDULO 1 – Estrutura Atómica. Tabela Periódica. Ligação Química. APONTAMENTOS Introdução A que perguntas procura responder a Química? A Química, como ciência, é razoavelmente recente, datando do início do séc. XVII os primeiros trabalhos que a distinguem da Alquimia1, mas algumas das questões a que esta ciência se propõe responder já inquietavam os sábios e filósofos desde há muitos séculos. Essencialmente as grandes questões da Química são: - De que são feitas as coisas? De que são feitos os materiais à nossa volta? e - Como é que as coisas se alteram? Como se transformam os materiais e substâncias? Ao longo do nosso estudo, nestes dois anos, vamos aprofundar alguns conhecimentos já adquiridos no ensino básico, nomeadamente sobre a constituição da matéria, a tabela periódica dos elementos e misturas de substâncias – indo ao encontro da primeira grande questão referida; e vamos estudar reacções químicas e compostos orgânicos e sua transformação – indo ao encontro da segunda grande questão. Comecemos pois por rever alguns conceitos essenciais, e que por vezes são confundidos. Esses conceitos que são utilizados pelos químicos para caracterizar a constituição da matéria são: elemento, átomo, molécula, ião, substância elementar, substâncias compostas. Como classificamos cada um dos seguintes exemplos? H Na+ Al3+ He SO42C2H5OH O2 Cl2 Al ClNH3 O Li C12H22O11 O22- O3 H2SO4 Mg2+ H2 H+ NH4+ Fe O2NaCl H2O H2O2 S8 Quadro 1 – Exemplos de fórmulas químicas Os símbolos H , Al , Li, Fe , He e O representam átomos, pois correspondem apenas a um átomo só, que não está ligado a nenhum outro átomo, e com carga eléctrica total igual a zero2. Cada átomo é assim representado apenas pelo símbolo químico do elemento respectivo. Um átomo é a porção mais pequena de matéria que ainda possui as 1 Pode ser interessante procurar informação sobre Jean Baptiste Van Helmont e sobre Robert Boyle, para saber mais sobre o “nascimento” da Química enquanto ciência. 2 Relembremos que um símbolo químico é uma letra maiúscula apenas, ou uma letra maiúscula seguida de uma letra minúscula, ou em casos excepcionais que correspondem aos elementos de números atómicos mais elevados uma letra maiúscula seguida de duas minúsculas. Assim HF é diferente de Hf; HF é formado por um átomo do elemento de símbolo H – o hidrogénio, e um átomo do elemento de símbolo F – o flúor; Hf é o símbolo do elemento háfnio. 1 propriedades de um certo elemento. Veremos adiante que alguns destes símbolos representam também as fórmulas químicas de certas substâncias elementares. As fórmulas O3 , H2 , H2O , C2H5OH , C12H22O11, H2SO4 , H2O2 , O2 , NH3, NaCl , S8 e Cl2 representam moléculas. As moléculas são constituídas por pelo menos 2 átomos ligados entre si. Algumas moléculas são formadas por um pequeno número de átomos, outras por um número grande, de que é um exemplo a sacarose (C12H22O11) que possui 45 átomos. Mas podem existir moléculas com milhares de átomos, como por exemplo uma molécula de DNA (ou ADN) de que já ouvimos falar nos meios de comunicação. As moléculas com tantos átomos chamam-se macromoléculas. Outros exemplos de macromeléculas são as proteínas e a celulose. Se olharmos com mais atenção para o conjunto de moléculas seleccionadas do quadro 1, podemos reparar que algumas são constituídas por átomos de apenas um elemento. Chamam-se, por isso, moléculas de substâncias elementares. Assim, O3 e O2 são as fórmulas de duas substâncias elementares de oxigénio, mas não correspondem ao elemento oxigénio. São duas substâncias diferentes, com propriedades diferentes entre si, e com propriedades diferentes do elemento oxigénio; chamam-se respectivamente ozono e oxigénio. Portanto, existe o elemento oxigénio – que é o conjunto de todos os átomos com as propriedades específicas deste elemento; existem os átomos de oxigénio – que podem entrar na composição de muitas moléculas e tomar parte em reacções químicas; e existe a substância elementar chamada oxigénio – que é constituída por dois átomos do elemento oxigénio ligados entre si e que à temperatura ambiente é um gás. É frequente haver substâncias elementares com o mesmo nome dos elementos (como o hidrogénio, H2 , o enxofre, S8 e o cloro, Cl2 ) porque foram, para cada caso, as primeiras substâncias elementares estudadas, mas pode haver outras substâncias elementares com nomes que diferem do nome do elemento (como o ozono). As restantes moléculas seleccionadas são moléculas de substâncias compostas ou compostos, porque são constituídas (compostas) por átomos de pelo menos 2 elementos diferentes. Assim, a água, H2O, o etanol ou álcool etílico, C2H5OH, a sacarose, C12H22O11, o ácido sulfúrico, H2SO4 , o peróxido de hidrogénio ou água oxigenada, H2O2 , o amoníaco, NH3 e o cloreto de sódio, NaCl são compostos. As moléculas, tal como os átomos, têm uma carga eléctrica global igual a zero, quer dizer são electricamente neutras. Este aspecto é evidenciado pela ausência de qualquer sinal + ou - junto à fórmula química. Os restantes exemplos apresentados no quadro 1 são iões. Os iões são espécies químicas com carga eléctrica global diferente de zero. Se a carga total é positiva os iões chamam-se iões positivos ou catiões, e significa que perderam electrões relativamente ao átomo ou molécula que lhes deu origem (ou que com a mesma fórmula química teriam carga total igual a zero). Se a carga total é negativa os iões chamam-se iões negativos ou aniões, e significa que ganharam electrões relativamente ao átomo ou molécula que lhes deu origem. Por outro lado, quanto à composição em termos do número de átomos, os iões podem chamar-se iões atómicos se derivam de apenas um átomo, ou iões moleculares se derivam de uma molécula. Assim: - o ião sulfato, SO42- , é um anião molecular, com 2 electrões em excesso; - o ião sódio, Na+ , é um catião atómico, com falta de 1 electrão; - o ião cloreto, Cl- , é um anião atómico, com 1 electrão em excesso; - o ião hidrogénio, H+ , é um catião atómico, com falta de 1 electrão; - o ião óxido, O2- , é um anião atómico, com 2 electrões em excesso; 2 - o ião alumínio, Al3+ é um catião atómico, com falta de 3 electrões; - o ião peróxido (ou superóxido), O22- , é um anião molecular, com 2 electrões em excesso; - o ião magnésio, Mg2+ , é um catião atómico, com falta de 2 electrões; - o ião amónio, NH4+ , é um catião molecular, com falta de 1 electrão. Adaptado de: Lucinda S. Mendonça, Marta Duarte Ramalho (1997) Jogo de Partículas Química 10º ano, Texto Editora, Lisboa, p. 10-12. Vejamos agora alguns exemplos de fórmulas químicas de substâncias elementares: 3 Fig.1 Fig.3 Fig.2 Fig.4 Como já tinha sido referido, por vezes o símbolo químico de um elemento também pode representar uma substância elementar cujas partículas mais pequenas são átomos isolados (caso do hélio) ou substâncias elementares constituídas por um número grande e indefinido de átomos de um só elemento (é o caso dos metais como o ferro, o lítio, etc. e é o caso de substâncias que apresentam uma estrutura cristalina como o diamante). 4
Baixar