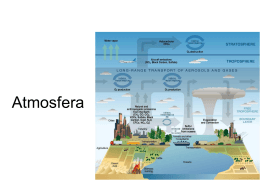
A Química do Ambiente Introdução • As actividades humanas afectam o meio ambiente • O crescimento económico depende de processos químicos – e.g. água potável, utilização de energia, síntese química, etc. • Cimeira da Terra – Brasil 1992 • 1997 – Encontro de Quioto • 2001 – Bona – Assinatura dos “protocolos de Quioto” – Protocolos concebidos para o estabelecimento regulamentações ambientais internacionais. de Tópicos • Atmosfera da Terra – Ozono – Chuva ácida – Efeito de estufa • O Oceano • Água • Química “verde” Atmosfera da Terra Existem quatro zonas. A temperatura e a pressão da atmosfera variam com a altitude. Vivemos na troposfera. Jactos voam a esta altitude. Chapter 18 Atmosfera terrestre • A atmosfera da Terra é afectada pela temperatura e pela pressão assim como pela gravidade. • Átomos e moléculas mais leves encontram-se a altitudes maiores . Quanto menos O2, mais “fino” é o ar. • Troposfera e estratosfera contêm 99.9% do total de massa da atmosfera, estando cerca de 75% na troposfera. • Há uma lenta e ligeira mistura de gases entre as regiões da atmosfera. • Os dois componentes princiais da atmosfera são o azoto, N2, e o oxigénio, O2. Regiões externas da atmosfera • Contêm uma pequeníssima percentagem da massa atmosférica. Pressão baixa! • Formam a defesa externa contra a radiação e as partículas muito energéticas do espaço. - Fotodissociação, fotoionização Fotodissociação • Fotodissocação: quebra de ligações induzida pela radiação. hc E h Quanto mais elevada for a frequência, menor é o comprimento de onda e mais elevada é a energia da radiação. • Para uma reacção ser induzida pela radiação é necessário que os fotões possuam energia suficente para quebrar as ligações; é necessário que as moléculas absorvam os fotões. Fotodissociação • Nas regiões superiores da atmosfera (acima de 120km), a fotodissociação origina a formação de átomos de oxigénio: O2(g) + h 2O(g) O minímo de energia necessária para esta mudança é determinada pela energia de dissociação de O2 (495kJ/mol). • A dissociação de O2 é muito extensa a altitudes elevadas: a 400 km só 1% do oxigénio é O2 e a 130km, cerca de 50% é O2. Fotoionização • É a ionização das moléculas (e átomos) causada pela radiação. • Em 1924 foram descobertos electrões na atmosfera superior; Então também catiões devem estar presentes nessa região (para balanço das cargas). • Fotoionização ocorre quando a molécula absorve um fotão com energia suficiente para remover um electrão. • Comprimentos de onda que causam fotoionização e fotodissociação são filtrados pela atmosfera (ocorrem principlamente em zonas afastadas da superfície terrestre). Ozono na atmosfera superior • O ozono (O3) absorve fotões com um comprimento de onda (cdo) entre 240 e 310 nm. (N2, O2 e O absorvem cdo menores que 240nm) • Maior parte do ozono está localizado na estratosfera (a cerca de 20 km). • Nas regiões entre 30-90km a fotodissociação do oxigénio molecular é possível: O2(g) + h 2O(g) Ozono na atmosfera superior • Os átomos de oxigénio podem colidir com moléculas de oxigénio e formam ozono com excesso de energia, O3*: O(g) + O2(g) O3*(g) (105kJ/mol) • As moléculas excitadas de ozono podem perder energia decompondo-se em átomos e moléculas de oxigénio (reacção inversa) O(g) + O2(g) O3*(g) ou transferindo a energia para M (normalmente N2 ou O2): O3*(g) + M(g) O3(g) + M*(g) Ozono na atmosfera superior • 90% do ozono da Terra encontra-se na estratosfera, entre os 10 e os 50 km de altitude. • cdo menores que 1140 nm podem fotodissociar O3 (energia de ligação 105kJ/mol). • O2(g) + hv O(g) + O(g) O(g) + O2(g) O3(g) + M*(g) (energia libertada) O3(g) + hv O2(g) + O(g) O(g) + O(g) + M*(g) O2(g) + M*(g) (energia libertada) • Ciclo natural Depleção do ozono • Em 1970, Crutzen mostrou que óxidos de nitrogénio, que ocorrem naturalmente, podem cataliticamente destruir o ozono. • Em 1974 Rowland e Molina mostraram que os clorofluorcarbonetos (CFCs) diminuem a camada de ozono ao catalizarem a formação de ClO e O2. Depleção do ozono • Em 1994 visualizou-se sobre a Antártica um buraco na camada de ozono • Em 1995 o Prémio Nobel da Química foi atribuído a F. Sherwood Rowland, Mario Molina, e Paul Crutzen pelos seus estudos sobre a diminuição da camada de ozono Clorofluorcarbonetos (CFCs) • - Principalmente CFCl3 e CF2Cl2 : usados em latas de spray, como gases de refrigeração, em ar condicionado, formação de plásticos • Não são reactivos na baixa atmosfera, são insolúveis em água. • Difundem lentamente para a estratosfera. • Vários milhões de toneladas estão actualmente presentes na atmosfera. Os CFC e a diminuição da camada de ozono Na estratosfera, CFCs sofrem fotodissociação da ligação C-Cl : CF2Cl2(g) + h CF2Cl(g) + Cl(g) – Consequentemente: Cl(g) + O3(g) ClO(g) + O2(g) – Adicionalmente o ClO produz também Cl : 2ClO(g) O2(g) + 2Cl(g) A Química na Troposfera • Troposfera: essencialmente constituída por O2 e N2 (99%). • Apesar de outros gases estarem presentes em baixas concentrações os seus efeitos no ambiente podem ser profundos. • O dióxido de enxofre, SO2, é largamente produzido por cobustão de petróleo e carvão. • SO2 é oxidado em SO3 ao reagir com O2 ou O3 e podendo este reagir com água e produzir ácido sulfúrico: SO3(g) + H2O(l) H2SO4(aq) Compostos de enxofre e chuva ácida • Mais de 30MT ,por ano, de SO2 são lançadas na atomosfera pelos Estados Unidos da América . • Os óxidos de nitrogénio também contribuem para as chuvas ácidas (ácidos nítricos e sulfúrico). • A água da chuva normal apresenta um pH de cerca de 5.6 (devido ao H2CO3 produzido a partir do CO2). • A chuva ácida tem um pH de 4, enquanto o pH de águas naturais que têm formas de vida se situa entre 6.5 e 8.5. Óxidos de nitrogénio e o smog O smog fotoquímico (“a nuvem castanha”) é o resultado de reacções fotoquímicas nos poluentes. • No motor dos carros, forma-se NO : N2(g) + O2(g) 2NO(g) H = 180.8 kJ • No ar, acontece a rápida oxidação do NO: 2NO(g) + O2(g) 2NO2(g) H = -113.1 kJ • O NO2 decompoe-se quando sujeito a cdo da ordem do 393nm (cdo da luz solar) NO2(g) + h NO(g) + O(g) Óxidos de nitrogénio e o smog • O oxigénio produzido por fotodissocaição do NO2 pode reagir com O2 e formar O3, o qual é o componnete chave do smog. O(g) + O2(g) + M(g) O3(g) + M*(g) • Na troposfera o ozono é indesejável visto ser tóxico e muito reactivo. • Ozono…demasiado no smog, insuficiente na estratosfera. Vapor de água, CO2 e clima • Existe um balanço térmico entre a Terra e a sua vizinhança. • Radiação é emitida a partir da Terra na mesma taxa em que á absorvida. • A troposfera é transparente à luz visível. • No entanto, a troposfera não é transparente à radiação Infravermelha (IV). • Então, a troposfera isola a Terra fazendo com que esta pareça mais fria do exterior do que, realmente está, à superfície. Vapor de água, CO2 e clima • As moléculas de água e de dióxido de carbono absorvem radiação IV evitando que todo o calor se escape do planeta. • O nível de dióxido de carbono tem vindo a aumentar nos últimos anos. A Terra pode aquecer demasiado. Perfil histórico de CO2 Houve um aumento de 15% desde 1950, essencialmente devido à indústria • Um aquecimento global excessivo, devido ao aumento exponencial da concentração de CO2 , pode resultar no degelo dos glaciares e consequente subida do nível da água do mar. O Mundo dos Oceanos • 72 % da superfície terrestre está coberta de água. • 97.2% da água do planeta é salgada , volume: 1.35 109 km3. Só cerca de 0.6% consiste em água doce e destes apenas 0,1% são potáveis • Salinidade: massa (em g) de sais em 1 kg de água do mar. Média: 35. • Maioria dos elementos na água do mar apenas estão presentes em pequenas quantidades (vestigiais). • Comercialmente o, NaCl,os iões Br- and Mg2+ são obtidos a partir da água do mar. Dessalinização Remoção dos sais da água • Método comum: osmose inversa . – Sob uma enorme pressão os solventes movem-se de soluções concentradas para soluções diluídas (envolvido muito consumo de energia). Química “verde” • A indústria reconheceu a importância do uso de alguns químicos em determinados processos, de3 forma a: • • • • • Evitar desperdícios, Diminuir gastos energéticos, Usar catalisadores, Usar materiais renováveis, Eliminar uso de solventes, tanto quanto possível.
Baixar