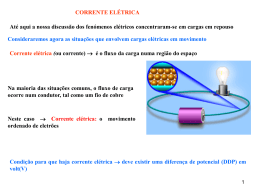
Unidade 7 Estrutura atómica Unidade 7 Estrutura atómica 7.5 Distribuição eletrónica e iões Segundo o modelo da nuvem eletrónica, os eletrões movem-se muito rapidamente em torno do núcleo. Nuvem eletrónica Os eletrões, como têm carga negativa, quando se aproximam demasiado uns dos outros, repelem-se e afastam-se. Por esse motivo, os eletrões «organizam-se» em torno do núcleo, distribuindo-se por diferentes níveis de energia. O modelo atómico de Bohr, apesar de desatualizado, permite compreender a distribuição dos eletrões pelos níveis de energia. Os níveis de energia são caracterizados por um número natural, n, que atualmente tem valores de 1 a 7. Em cada nível de energia pode existir um número máximo de eletrões, dado pela expressão: N.º eletrões do nível = 2n2 n é o nível energético Nível 1 Nível 2 Nível 3 … Nível 4 Nível de energia (n) N.º máximo de eletrões (2n2) 1 2 x 12 = 2 2 2 x 22 = 8 3 2 x 32 = 18 O modelo atómico de Bohr, apesar de desatualizado, permite compreender a distribuição dos eletrões pelos níveis de energia. O nível mais próximo do núcleo, o nível 1, corresponde ao nível de energia mais baixo. Nível 1 A energia do nível é tanto maior quanto maior é o afastamento do núcleo. Nível 2 Nível 3 … Nível 4 Energia crescente O modelo atómico de Bohr, apesar de desatualizado, permite compreender a distribuição dos eletrões pelos níveis de energia. A distribuição dos eletrões deve começar pelo nível de energia mais baixo, o nível 1. Quando o nível 1 estiver completo, distribuem-se eletrões pelo nível 2, e assim sucessivamente. Nível 1 Nível 2 Nível 3 … Nível 4 O último nível de energia com eletrões não pode ter mais do que 8 eletrões (no caso de ser o primeiro nível, não pode ter mais do que 2 eletrões). Considera o exemplo do oxigénio (O): O 8 Número atómico = 8 Número de eletrões = 8 A distribuição dos eletrões deve começar pelo nível de energia mais baixo, o nível 1. O nível 1 pode ter no máximo 2 eletrões. Dos 8 eletrões do oxigénio, falta distribuir 6. Nível 1 Considera o exemplo do oxigénio (O): O 8 Número atómico = 8 Número de eletrões = 8 Como o nível 1 já está totalmente preenchido, vamos distribuir os eletrões em falta pelo nível 2. O nível 2 pode ter no máximo 8 eletrões. Colocando os 6 eletrões restantes neste nível, a distribuição fica completa. Nível 1 Nível 2 Considera o exemplo do oxigénio (O): O 8 Número atómico = 8 Número de eletrões = 8 O átomo de oxigénio tem: 2 eletrões no nível 1; 6 eletrões no nível 2. Nível 1 Nível 2 Considera o exemplo do oxigénio (O): O 8 Número atómico = 8 Número de eletrões = 8 A distribuição eletrónica do átomo de oxigénio é: 2: 6 Eletrões de valência Os eletrões do último nível de energia ocupado denominam-se eletrões de valência. Nível 1 Os eletrões de valência são os mais afastados do núcleo e são determinantes no comportamento químico. Nível 2 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 A distribuição dos eletrões deve começar pelo nível de energia mais baixo, o nível 1. O nível 1 pode ter no máximo 2 eletrões. Nível 1 Dos 20 eletrões do cálcio, falta distribuir 18. Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 Como o nível 1 já está totalmente preenchido, vamos distribuir os eletrões em falta pelo nível 2. O nível 2 pode ter no máximo 8 eletrões. Nível 1 Dos 20 eletrões do cálcio, falta distribuir 10. Nível 2 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 Como o nível 2 já está totalmente preenchido, vamos distribuir os eletrões em falta pelo nível 3. O nível 3 pode ter no máximo 18 eletrões. Nível 1 Contudo, se for o último nível com eletrões, não pode ter mais do que 8. Nível 2 Nível 3 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 Não podemos, por isso, colocar os 10 eletrões no nível 3, pois assim este seria o último nível e teria mais do que 8 eletrões. Colocam-se apenas 8 eletrões no nível 3. Nível 1 Dos 20 eletrões do cálcio, falta distribuir 2. Nível 2 Nível 3 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 Os últimos 2 eletrões podem ser distribuídos pelo nível 4. Os 20 eletrões estão todos distribuídos pelos diferentes níveis de energia. Nível 1 Nível 2 Nível 3 Nível 4 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 O átomo de cálcio tem: 2 eletrões no nível 1; 8 eletrões no nível 2; 8 eletrões no nível 3; Nível 1 Nível 2 2 eletrões no nível 4. Nível 3 Nível 4 Vejamos agora o exemplo do cálcio (Ca): Ca 20 Número atómico = 20 Número de eletrões = 20 A distribuição eletrónica do átomo de cálcio é: 2:8:8: 2 Eletrões de valência Nível 1 O átomo de cálcio apresenta 2 eletrões de valência. Nível 2 Nível 3 Nível 4 Iões Os iões são partículas com carga elétrica que resultam de átomos que perderam ou ganharam eletrões: Quando um átomo perde eletrões, origina um ião com excesso de carga positiva — catiões. O átomo de sódio (Na) perde 1 eletrão de valência, originando o ião Na+: perde 1 eletrão + 11Na 11Na Balanço de cargas +11 (11 protões) cargas positivas +11 (11 protões) –11 (11 eletrões) cargas negativas –10 (10 eletrões) 0 +1 Os iões são partículas com carga elétrica que resultam de átomos que perderam ou ganharam eletrões: Quando um átomo ganha eletrões, origina um ião com excesso de carga negativa — aniões. O átomo de oxigénio (O) ganha 2 eletrões, originando o ião O2–: ganha 2 eletrões 2– 8O 8O Balanço de cargas +8 (8 protões) cargas positivas +8 (8 protões) –8 (8 eletrões) cargas negativas –10 (10 eletrões) 0 –2 Conclusão Os eletrões são distribuídos por níveis de energia em torno do núcleo do átomo. Os eletrões de valência são os mais afastados do núcleo e são determinantes no comportamento químico. Os iões são partículas com carga elétrica que resultam de átomos que perderam ou ganharam eletrões: Quando um átomo perde eletrões, origina um ião positivo — catião; Quando um átomo ganha eletrões, origina um ião negativo — anião.
Baixar