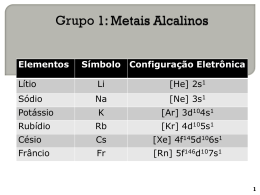
Unidade 8 Propriedades dos materiais e Tabela Periódica Unidade 8 Propriedades dos materiais e Tabela Periódica 8.4 Propriedades químicas e estrutura atómica dos metais alcalinos Metais alcalinos Períodos Grupos Os elementos do grupo 1 (com exceção do hidrogénio) pertencem à família dos metais alcalinos. Os elementos desta família apresentam propriedades químicas semelhantes. Os átomos dos metais alcalinos possuem apenas um eletrão de valência. Lítio 3Li – 2:1 Sódio 11Na – 2:8:1 Perde 1 eletrão Potássio 19K – 2:8:8:1 Perde 1 eletrão Perde 1 eletrão +–2 Li 3 + – 2:8 Na 11 + – 2:8:8 K 19 2He 10Ne 18Ar –2 – 2:8 – 2:8:8 Por esse motivo, os átomos dos metais alcalinos tendem a formar iões monopositivos. A distribuição eletrónica dos iões assemelha-se à distribuição do gás nobre do período anterior, o que lhes confere uma grande estabilidade (nível de valência completamente preenchido). Os átomos dos metais alcalinos possuem apenas um eletrão de valência. Lítio 3Li – 2:1 Sódio 11Na – 2:8:1 Perde 1 eletrão Potássio 19K – 2:8:8:1 Perde 1 eletrão Perde 1 eletrão +–2 Li 3 + – 2:8 Na 11 + – 2:8:8 K 19 2He 10Ne 18Ar –2 – 2:8 – 2:8:8 A semelhança das propriedades químicas das substâncias elementares dos metais alcalinos resulta da facilidade com que os átomos perdem o seu eletrão de valência e se transformam em iões monopositivos. Os metais alcalinos apresentam um brilho metálico quando cortados e reagem violentamente com a água: 2 Li(s) + 2 H2O(l) 2 LiOH(aq) + H2(g) 2 Na(s) + 2 H2O(l) 2 NaOH(aq) + H2(g) 2 K(s) + 2 H2O(l) Os hidróxidos formados, quando em solução aquosa, tornam carmim a fenolftaleína, o que indicia um carácter básico. 2 KOH(aq) + H2(g) Os metais alcalinos apresentam um brilho metálico quando cortados e reagem violentamente com a água: 2 Li(s) + 2 H22O(l) 2 LiOH(aq) + H22(g) 2 Na(s) + 2 H2O(l) 2 NaOH(aq) + H2(g) 2 K(s) + 2 H2O(l) O potássio reage mais violentamente com a água do que o sódio. O sódio reage mais violentamente com a água do que o lítio. 2 KOH(aq) + H2(g) A reatividade dos metais alcalinos aumenta ao longo do grupo. Aumento da reatividade À medida que se desce num grupo na Tabela Periódica, os eletrões de valência dos átomos vão ocupando níveis de energia mais elevados. Por esse motivo, a atração exercida pelo núcleo sobre esses eletrões é menos intensa. No caso dos átomos dos metais alcalinos, quanto maiores são os átomos, mais facilmente estes originam iões monopositivos, e maior é a sua reatividade. A reatividade dos metais alcalinos aumenta ao longo do grupo. Aumento da reatividade Aumento do raio atómico Como os átomos de potássio são maiores do que os átomos de sódio, e estes são maiores do que os átomos de lítio, o potássio é mais reativo do que o sódio, e este é mais reativo do que o lítio. Raio atómico do potássio > Raio atómico do sódio > Raio atómico do lítio Reatividade do potássio > Reatividade do sódio > Reatividade do lítio A reação dos metais alcalinos com oxigénio (O2) origina óxidos do metal respetivo e uma chama de cor característica: Lítio Reação com oxigénio (O2) Chama avermelhada Sódio Reação com oxigénio (O2) Chama amarelada Potássio Reação com oxigénio (O2) Chama azulada Os metais alcalinos têm diversas utilizações no nosso dia a dia. O lítio é utilizado nas baterias dos telemóveis. O sódio é utilizado em lâmpadas de iluminação. O potássio é um dos componentes dos adubos utilizados na agricultura. O césio é utilizado em detetores de infravermelhos. Conclusão Os átomos dos metais alcalinos possuem apenas um eletrão de valência e têm tendência para formar iões monopositivos. A reatividade dos metais alcalinos aumenta ao longo do grupo. A reação dos metais alcalinos com oxigénio (O2) origina óxidos do metal respetivo e uma chama de cor característica.
Baixar