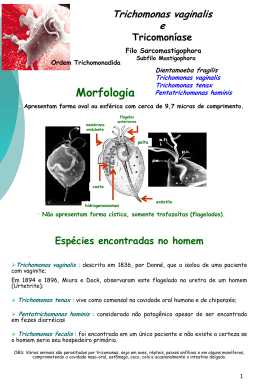
Danilo Mendes Akiau Eduardo Medeiros Batista Laura Helena G. Fernandes Paulo Eduardo Latorre Martins Tavares Sandra de Jesus Santana Thaís Cristina de Oliveira Disciplina: Coleta de materiais Professora: Ana Marina Colocar o paciente sentado, em local de boa iluminação. A coleta deverá ser feita de preferência pela manhã, antes da ingestão de alimentos líquidos e/ou sólidos, antes do uso de qualquer produto tópico e da administração de antimicrobianos sistêmicos. • Lavar as mãos; • Calçar luvas de procedimento; • Com um abaixador de língua, expor a faringe posterior procurando visualizar e coletar o material das áreas com hiperemia, sem pus ou material necrótico, pois uma amostra destas áreas inviabiliza o isolamento de germes patogênicos. Nesses materiais, a presença de substâncias tóxicas inibidoras e a restrição nutritiva impedem a sobrevivência de microrganismos mais exigentes; • Para diminuir o reflexo de vômito, pedir ao cliente para fazer um ¨AAA ¨ prolongado para ocasionar a elevação da úvula; • Coletar a amostra fazendo esfregaços sobre as amígdalas e faringe posterior, evitando tocar na língua e na mucosa bucal para não contaminar, pois a saliva é rica em micróbios da microbiota normal, que prejudicam o isolamento dos patogênicos. • Colher um swab e introduzí-lo no meio de transporte Amies ou Stuart; • Colher um segundo swab e realizar um esfregaço em duas lâminas para bacterioscopia (Gram); • Retirar as luvas de procedimento; • Lavar as mãos • Enviar imediatamente ao laboratório • O material que não for semeado em 15 minutos deverá ser mantido em meio de transporte adequado (Stuart). • Colher um swab sem meio de transporte e fazer o esfregaço imediatamente em duas lâminas de vidro limpas, friccionando-o duas vezes sobre cada uma delas. Esperar secar. Enviar as lâminas embrulhadas em papel ou em envelope próprio. Lâminas preparadas após 15 minutos da coleta podem alterar de forma significativa a qualidade do material (com morte da bactéria e destruição celular) e, consequentemente, o resultado. • No momento de uso, os meios de cultura não podem estar gelados, sendo necessário retirá-los do refrigerador pelo menos 30 minutos antes. No início da coleta ,os meios de transporte PAI deverão estar à temperatura ambiente; • A coleta deverá ser realizada preferencialmente antes do início da antibioticoterapia, contudo deverá sempre ser feita; • Identificar os tubos com N (nariz) e G (garganta) para facilitar o manuseio e evitar trocas; • Nariz (N) – utilizar o mesmo swab para ambas as narinas. Introduzir o swab ultrafino flexível e estéril na narina do paciente até encontrar resistência na parede posterior da nasofaringe. Realizar movimentos rotatórios; • Imediatamente após a coleta, introduzir o swab no meio de transporte; • Garganta – (G) – com o auxílio de um abaixador de língua, pressionar a língua para baixo e com swab estéril, fazer a coleta ao redor da superfície da garganta, passando o swab pelas amígdalas, úvula e toda a parede da garganta. Caso se verifique a presença de placa pseudomembranosa, o swab deve • ser passado com cautela, tomando-se o cuidado de não removê-la; • Imediatamente após a coleta, introduzir o swab no meio de transporte; • A coleta de casos suspeitos deve ser feita em hospital sob acompanhamento médico; • Após a semeadura, identificar os tubos e anexar a ficha de encaminhamento de amostras clínicas, devidamente preenchida. • O meio de transporte PAI deve ser armazenado sob refrigeração (2 a 8°C), observando sempre a data de vencimento antes de sua utilização; • O meio de transporte PAI deve ser armazenado sob refrigeração (2 a 8°C), observando sempre a data de vencimento antes de sua utilização; • Passar o swab em toda a extensão (superfície) do meio, girando e fazendo movimentos de zigzag da base até o ápice; • Encaminhar o material coletado ao laboratório à temperatura ambiente, imediatamente após a coleta ou incubar a 37ºC por no máximo 24h e em seguida encaminhar ao laboratório à temperatura ambiente; •Por serem doenças de transmissão respiratória, o uso de jaleco, máscara e luvas é essencial para proteção do profissional que realiza a coleta; •Todo material descartável utilizado na coleta deverá ser acondicionado em saco plástico, vedado com fita crepe, identificado como “contaminado”, recolhido no lixo hospitalar; •Não deve ser feita qualquer improvisação do material. •É imprescindível que o meio de cultura e o swab estejam obedecendo rigorosamente a condição de uso no momento da coleta. • Todo paciente suspeito de tuberculose sintomático respiratório – aquele que tosse há mais de três semanas – deve ter três amostras de escarro colhidas e analisadas por método baciloscópico. • A baciloscopia é exame de fácil execução e deve ser realizada em todo o paciente que produza escarro espontaneamente ou induzido. Sua sensibilidade é de 75%, sendo estimado que sejam necessários de 104 a 105 bacilos/ml de escarro para ser possível a sua detecção ao microscópio óptico. • A amostra de escarro deve ser coletada preferencialmente pela manhã, quando o paciente costuma apresentar uma maior expectoração, após acordar e realizar higiene oral, sendo encaminhada para exame de pesquisa direta de bacilo ácido-álcool resistente (BAAR) através de coloração específica. Para os pacientes que não conseguem espontaneamente produzir escarro, pode-se induzi-lo através de inalação de solução salina hipertônica. • O Paciente é orientado em produzir escarro e não saliva. A respectiva coleta deve ser realizado fora do prédio no ar livre e distante de outras pessoas. • As amostras são recebidas em potes com tampas rosquiada contendo em média 5 ml de escarro identificada de acordo com a requisição do exame, e acondicionada em bandeja de inox para serem encaminhada a sala do laboratório de baciloscopia com requisição e ficha de informação, que deve ser preenchido pela recepção do laboratório, contendo os dados do paciente. O nome e o registro do paciente deve ser afixado no recipiente propriamente dito e não na tampa. • A amostra recebida nos postos. O escarro devera ser transportado da unidade de saude para o laboratório por meio de um mensageiro e devera ser acondicionada em caixas térmicas com gelo reciclável de modo que o pote não vire e não derrame. • As amostras são retiradas da bandeja de inox e colocadas na bancada do laboratório de baciloscopia pelo técnico para procedimentos de identificação e do preenchimento do livro branco e preparação do esfregaço. • Antes de iniciar o registro do material recebido fazer a desinfecção externa do pote, com gaze ou algodão molhado com hipoclorito de sódio a 1% ou fenol a 5%. • As orientações simples deve ser ditas verbalmente, exemplo: Horário da coleta Dia Local • As orientações mais complexas deve ser feitas por escrito • Deve explicar ao paciente como é feito o exame • Verificar se o paciente se encontra nas condições ideais para a coleta • O cadastro deve estar completo, com letra legível • As etiquetas devem estar coladas sem estarem tortas ou amassadas de modo a fácil visualização do nome • Na lâmina escrever com lápis 2B. • A paciente deve estar 2 dias em abstinência sexual. • Não pode usar antissépticos locais, cremes, óvulos, pomadas vaginais ou qualquer tipo de medicamento usado no local. • Não pode estar menstruada • Não deve esta fazendo uso de antibiótico ou quimioterápico • Não ter realizado exames ginecológicos com toque; • Não pode ter feito nas 48 horas antes do exame uma ultrasom transvaginal; • Não pode fazer a higiene intima antes do exame; • Não fazer duchas vaginal; • Deve-se colher pela manhã; Porta-lâminas Lâmina Swab Espéculo Gase • Em uma lâmina limpa e previamente identificada colocar uma gota de salina sobre ela; • Introduzir o espéculo no canal vaginal; • Com o auxilio de um “swab” colete a amostra do saco vaginal; • Retire o swab, na lâmina com salina coloque a secreção e a homogieneize e depois cubra com uma lamínula e olhe no microscópio no aumento de 40x; • Coloca o material coletado por swab no tubo seco sem aditivo e sem gel • O tubo deve conter 1 ml de solução salina o,9% estéril (soro fisiológico) • homogeneizar para que o material se desprenda na salina, turvando-a e desprezar o swab.(não deixar o swab dentro do tubo). • Coloque na Lâmina • cubra com uma lamínula e olhe no microscópio no aumento de 40x; • Com o swab envolto pela secreção deve-se girar levemente no centro da Lâmina limpa com álcool fazendo o esfregaço fino e homogêneo com a forma oval. • Não pode macera o material. • Espere a lâmina secar e embrulhe com o papel alumínio porém coloque dois palitos para que o alumínio • não fique esfregando na amostra ou coloque no suporte sendo o ideal. • Coloque a etiqueta de código de barra no papel que envolve as lâminas, nunca direto na lâmina. • Introduza o espéculo; • Limpe com gaze estéril a secreção do fundo do saco vaginal e a que recobre o colo do útero; • Introduza o swab alginatado ou no canal endocervical, girando-o delicadamente de 8 a 10 vezes, para absorver a secreção. Cuidado para não tocar as paredes vaginais; • Retire o swab, sem tocar as paredes vaginais. • • Material: Secreção uretral Volume: Suficiente para a confecção de 2 Lâminas • Método: Microscopia (Coloração de Gram) • Temperatura: Sob refrigeração • Coleta: Coletar secreção uretral e confeccionar lâminas. • Interpretação: • Uso: pesquisa de Trichomonas (coloração Giemsa), fungos, diplococos Gram-Negativos, bacilos Gram-Variáveis parasitando células epiteliais (clue cells) com morfologia de Gardnerella; relato da relação leucócitos/células epiteliais. Algumas bactérias isoladas habitualmente fazem parte da flora bacteriana do meato anterior da uretra. Por esta razão é muito importante observar os cuidados especiais na coleta da secreção. • 1.Coloque uma gota de salina sobre uma lâmina previamente identificada; • 2. Solicite ao paciente para retrair o prepúcio; • 3. Limpe a secreção emergente com gaze estéril; • 4. Certifique-se de que a uretra esteja reta; • 5. Introdu za o swab cerca de 2 centímetros no canal uretral atravessando a fossa navicular; • 6. Gire o swab delicadamente de 8 a 10 vezes para absorver asecreção; • 7. Retire o swab, coloque a secreção sobre a salina na lâmina e homogeneíze para coloração; ou faça um esfregaço da amostra em meio de cultura apropriado; • Faça a expressão da secreção das glândulas parauretrais pressionando a parede vaginal com o dedo médio; • 2. Introduza o swab cerca de 2 centímetros na uretra; • 3. Colete a secreção girando delicadamente o swab de 8 a 10 vezes. • 4. Retire o swab, coloque a secreção sobre a salina na lâmina e homogeneíze para coloração; ou faça um esfregaço da amostra em meio de cultura apropriado; • • • • • • • • • • • • • Manual da Vigilância Sanitária: Procedimentos Laboratoriais: da Requisição do Exame à Análise Microbiológica. 2004. Manual de Coleta de Amostras do Laboratório Central Dr. Almino Fernandes. 2010. Manual de Procedimentos de Coleta da Associação Beneficente de Assistência Social e Hospitalar. Disponível em <http:http://www.prosaude.org.br/>. Acesso em 26 set 2011. World Health Organization. Treatment of tuberculosis: guidelines for national programmes. Geneva, Switzerland: WHO; 1993 Stone BL, Burman WJ, Hildred MV, Jarboe EA, Reves RR, Wilson ML. The diagnostic yeld of acid-fast-bacillus smear–positive sputum specimens. J Clin Microbiol 1997;35:1030-1031. Heifets LB, Good RC: Current laboratory methods for the diagnosis of tuberculosis, in Bloom BR (ed): Tuberculosis: pathogenesis, protection and control. Washington DC: ASM Press;1994. Pag 85-110. http://www.praticahospitalar.com.br/pratica%2042/pgs/materia%2023-42.html http://www.felixmotta.blogspot.com/.../ceamp-laboratrio-de-baciloscopia-da.html
Baixar