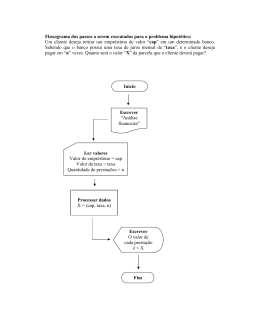
Disciplina Curso Professor Série QUÍMICA ENSINO MÉDIO GUILHERME 1ª SÉRIE ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO – 2º SEMESTRE / 2012 Aluno (a): Número: 1 - Conteúdo: Gases – Lei do gás ideal, gás ideal versus gás real, Misturas gasosas. Estequiometria – proporções molares e em massa, reagentes limitantes e em excesso, cálculos levando em conta impurezas e rendimento. Modelos atômicos detalhados: Modelos de Dalton, Thomson, Rutherford e Bohr, propriedade e características dos modelos. Radioatividade Concentração de soluções 2 - Data de entrega: No dia da prova de Recuperação. 3 - Material para consulta: Livro didático: “Química – na abordagem do cotidiano”, Tito e Canto 4 - Trabalho a ser desenvolvido: O aluno deverá elaborar resumos teóricos dos textos do livro e de outras fontes sobre os tópicos do conteúdo. Os resumos teóricos devem ser feitos à mão, em folha de atividades do colégio, de própria autoria e entregues anexados ao roteiro de recuperação. Como fonte, pode ser usado o livro texto, livros didáticos de química e textos de química. Após fazer os resumos, o aluno deverá fazer uma reelaboração das provas, em anexo no roteiro, como exercícios. Além disso, em caráter opcional, o aluno poderá refazer os seguintes exercícios do livro didático: Cap 14 – 84 ao 98 Cap 15 – 1 ao 77 Cap 5 – 1 ao 43 Cap 6 – 1 ao 41 Cap 24 – 1 ao 78 Cap 16 – 1 ao 32 1 – Analise a imagem abaixo: a) Indique qual é o modelo atômico representado na charge, explicando detalhadamente a sua escolha. b) Considerando que o átomo “atingido” encontra-se estável após perder um elétron, indique qual é a família da tabela periódica à qual ele pertence. Justifique a sua escolha. c) Sabendo que os átomos representados pertencem ao quarto período da tabela periódica, indique o nome e a distribuição eletrônica do átomo atingido, considerando seu átomo neutro. Justifique a sua escolha. d) Sabendo que seu colega de luta pertence à família 17 (Halogênios), faça a distribuição eletrônica do átomo não atingido. Justifique a sua escolha. e) Comparando este primeiro átomo ao seu colega de luta, e usando seus conhecimentos sobre as propriedades periódicas, o tamanho relativo dos átomos na charge é correto? Justifique sua resposta e indique qual átomo é mais eletronegativo. 2 – O homem, na tentativa de melhor compreender os mistérios da vida, sempre lançou mão de seus conhecimentos científicos e/ou religiosos. A datação por carbono quatorze é um belo exemplo da preocupação do homem em atribuir idade aos objetos e datar os acontecimentos. Em 1946 a Química forneceu as bases científicas para a datação de artefatos arqueológicos, usando o 14C. Esse isótopo é produzido na atmosfera pela ação da radiação cósmica sobre o nitrogênio, sendo posteriormente transformado em dióxido de carbono. Os vegetais absorvem o dióxido de carbono e, através da cadeia alimentar, a proporção de 14C nos organismos vivos mantém-se constante. Quando o organismo morre, a proporção de 14C nele presente diminui, já que, em função do tempo, se transforma novamente em 14N. Sabe-se que, a cada período de 5.730 anos, a quantidade de 14C reduz-se à metade. Baseado nisso, responda: Poderia um artefato de madeira, cujo teor determinado de 14C corresponde a 25% daquele presente nos organismos vivos, ser oriundo de uma árvore cortada no período do Antigo Egito (3.200 a.C. a 2.300 a.C.)? Justifique. g) Equacione o decaimento radioativo de 14C a 14N. f) 3 – Sabendo que o 232Th é um emissor alfa e beta e que o seu tempo de meia vida corresponde a 24 dias, responda: a) Faça a equação balanceada do decaimento de 232Th a 208Pb. b) Partindo-se de uma massa igual a 1 kg, qual será a massa de 232Th após 6 meses e 12 dias? (considere cada mês com 30 dias para efeitos de cálculo.)
Download