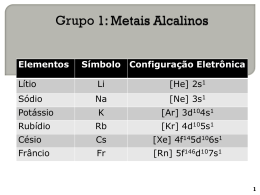
UFPB – Universidade Federal da Paraíba CCEN – Centro de Ciências Exatas e da Natureza Departamento de Química Química Geral e Inorgânica Experimental Aula Prática Nº 09 Metais Alcalinos OBJETIVOS · · · Observar reações do sódio metálico Observar propriedades dos sais de metais alcalinos Identificar metais alcalinos. INTRODUÇÃO O sódio é um metal fortemente eletropositivo, desloca o hidrogênio da água a temperaturas ordinárias. Quando um pequeno pedaço de sódio é colocado em água à temperaturas ambiente, ocorre reação violenta e o pedaço de sódio rapidamente com a água formando hidróxido de sódio e desprendendo hidrogênio conforme a reação: 2Na(s) + 2H2O ® 2Na+ + 2OH- + H2. Vemos que a reação líquida do sódio metálico consiste essencialmente na oxidação do Na0 à Na+, que permanece em solução na forma de íons Na+, hidratados. Ao mesmo tempo um átomo de hidrogênio da molécula da água, é reduzido do seu número de oxidação +1 na água a zero na molécula de H2 (H+ ® H20). Para cada molécula de H2O que tenha reagindo forma-se um íon OH- que permanece em solução. Metais Alcalinos para utilização em laboratório, devem ser guardados sob líquidos inertes, como querosene ou tolueno , pois todos os metais alcalinos reagem espontaneamente e a baixa temperatura como o oxigênio e a umidade da pele, causando fortes queimaduras. Seus óxidos e hidróxidos são sólidos brancos, muito higroscópicos e bastante solúveis em água. Seus hidróxidos mais importantes são a soda cáustica (NaOH) e a potassa cáustica (KOH), que se obtém principalmente por eletrólise de soluções de NaCl e KCl. Os sais de metais alcalinos, são bastante solúveis e formam eletrólitos fortes e os sais de ácidos fracos em solução aquosa apresentam reação alcalina.Os sais voláteis dos metais alcalinos dão a chama uma coloração de matizes que os identificam: Lítio (carmim), Na (amarelo), K (violeta), Rubídio (vermelho) e Césio (violeta). MATERIAL REAGENTES 1 béquer de 250ml 2 béquer de 50ml 10 pipetas de 5ml 1 vidro de relógio 10 tubos de ensaio Bastão de vidro Espátula Alça metálica Pinça metálica Sódio metálico (Na(S)) Álcool etílico NaOH – 2M Solução de fenolftaleína Solução de Bromotimol K2CO3 , NaNO3, Na2S, KCl. NaCl, LiCl KCl 58 UFPB – Universidade Federal da Paraíba CCEN – Centro de Ciências Exatas e da Natureza Departamento de Química Química Geral e Inorgânica Experimental PROCEDIMENTO Parte I 1.0 2.0 3.0 4.0 Retire um pedacinho de sódio e corte-o em pequenos fragmentos em um papel de filtro. Coloque água destilada em um béquer de 50ml e adicione 3 gotas de fenolftaleína. Em seguida vá adicionando os pedacinhos de sódio com cuidado para não ficar muito perto. Observe a formação de H2 e do NaOH. Em um béquer de 250ml, coloque água até metade de sua capacidade. Encha também um tubo de ensaio. Corte um pedacinho de sódio, coloque no tubo de ensaio e inverta rapidamente o tubo de ensaio cheio no béquer. Observe a formação do gás hidrogênio, aumentando a pressão sobre a superfície da água, fazendo com que a coluna líquida baixe de nível. Em um béquer de 50ml adicione 10ml de álcool etílico. Corte um pedacinho de sódio e coloque no álcool. Observe a reação. Parte II 1.0 1.0 Colocar em 4 tubos de ensaio alguns pequenos cristais dos seguintes sais: NaNO3, Na2SO3, KCl e K2CO3 respectivamente . Adicionar 3 mL de água destilada em cada tubo e verificar o pH, usando pael indicador Universal. 2.0 2.0 Usando uma alça metálica ( nicrômio ), introduzir em 4 tubos de ensaio contendo, respectivamente, soluções de LiCl, NaCl e KCl e aquecer a chama oxidante do bico de gás. Observar a coloração da chama. Realizar os experimentos usando um sal de cada vez. 3.0 Identificar o metal através da análise desconhecidas fornecidas pelo professor. 59 da chama, de amostras UFPB – Universidade Federal da Paraíba CCEN – Centro de Ciências Exatas e da Natureza Departamento de Química Química Geral e Inorgânica Experimental Aula Prática Nº 09 Metais Alcalinos Aluno:_____________________________________Turma:_____ Data: __________ Parte I Reação Observação 1 2 3 Parte II Sais Observação 1 NaNO3KCl 2 Na2SO3, 3 Na2SO3, 4 K2CO3 Sais Observação 1 LiCl 2 NaCl 3 KCl 60 UFPB – Universidade Federal da Paraíba CCEN – Centro de Ciências Exatas e da Natureza Departamento de Química Química Geral e Inorgânica Experimental Aula Prática Nº 09 Metais Alcalinos Exercícios de Fixação 1. Por que não devemos tocar o sódio com as mãos? 2. Qual a finalidade da adição das gotas de fenolftaleína? 3. Qual a reação entre o sódio e o álcool etílico? 4. Por que não devemos usar pedaços grandes de sódio? 5. Pela reação de 50g de sódio em água, quanto de NaOH se obtém? 6. Qual o volume de hidrogênio obtido nas CNTP? 7. Qual a função da fenolftaleína neste experimento? 8. Comente a reação entre o sódio e o álcool etílico. 9. Justifique o valor do pH dos sais de ácidos fracos de metais alcalinos. 10. Comente a identificação dos metais alcalinos usados no teste da chama. 61
Download