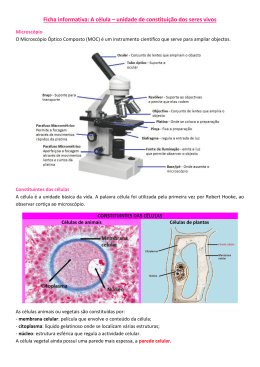
1 1. OBJETIVOS DA DISCIPLINA Ao término do programa sugerido o acadêmico (a) deverá: Saber manusear o microscópio óptico e reconhecer estruturas celulares. Identificar a importância dos componentes químicos celulares. Diferenciar organismos procariotos de eucariotos, assim como as suas origens e evolução. Compreender o funcionamento normal da célula animal, objetivando a aplicação desses conhecimentos na identificação e resolução de problemas específicos e profissionalizantes futuros. 2. MICROSCOPIA ÓPTICA 2.1 Objetivos do estudo teórico Ao final do estudo do microscópio óptico, o acadêmico deverá: a. Reconhecer a importância do microscópio para o estudo de citologia. b. Descrever o funcionamento de seus componentes ópticos e mecânicos. c. Justificar as razões de cada etapa do procedimento técnico utilizado no preparo de material para observação ao microscópio óptico. d. Saber sobre as técnicas de microscopia para a citologia. e. Citar as funções das diferentes estruturas celulares. 2.2 Objetivos do estudo prático a. b. c. d. e. f. g. h. i. Identificar os componentes de um microscópio óptico e aprender a manuseá-lo corretamente. Interpretar a imagem observada ao microscópio. Desenhar as estruturas observadas ao microscópio óptico. Citar partes do microscópio óptico (M.O.) ou de luz. Descrever as funções dos sistemas de lentes que compõem o M.O. Explicar o que é limite de resolução e poder resolutivo de um M.O. Fazer cálculos a fim de descobrir o poder resolutivo das objetivas de um M.O. Identificar o aumento das estruturas biológicas observadas ao M.O. Explicar porque é possível se observar ao microscópio eletrônico (M.E.), estruturas diminutas que não são visíveis ao M.O. j. Citar os principais fixadores em M.O. e M.E. 2 3. MÉTODOS DE ESTUDOS Os conhecimentos sobre as células progridem paralelamente ao aperfeiçoamento dos métodos de investigação. A princípio o uso do microscópio composto possibilitou o descobrimento das células e a elaboração da teoria segundo a qual todos os seres vivos são constituídos por células. Posteriormente, foram descobertas técnicas citoquímicas que possibilitaram a identificação e localização de diversas moléculas constituintes das células. Com o advento dos microscópios eletrônicos foram observados pormenores da estrutura celular que não poderiam ser sequer imaginados pelos estudos feitos com os microscópios ópticos. Mais ou menos simultaneamente com o uso dos microscópios eletrônicos, foram aperfeiçoados métodos para a separação de organelas celulares e para o estudo in vitro de suas moléculas e respectivas funções. A análise das organelas com técnicas bioquímicas, fisiológicas, imunológicas, farmacológicas etc. contribui para o surgimento do que se costuma chamar de biologia molecular, que é o estudo integrado das células, através de todo o arsenal técnico disponível. As técnicas para melhor observação das células e dos seus componentes vieram acompanhadas com o surgimento e aperfeiçoamento de equipamentos como o microscópio óptico, do simples ao composto, o microscópio de polarização, microscópios eletrônicos e micrótomos. 3.1 Preparados permanentes Embora sela possível o estudo microscópico de células vivas, muitas vezes há vantagens em obter um preparado permanente (lâmina) no qual as células ficam preservadas, isto é, fixadas e coradas, para melhor demonstração dos seus componentes. Um preparado permanente passa por várias etapas: fixação, microtomia, coloração, montagem entre outras. 3 3.2 Processos de montagem de lâminas histológicas de rotina Fixação: é feita com misturas fixadoras. Os fixadores mais comumente usados são o formol a 10% e o bouin. A finalidade da fixação é preservar a morfologia e composição dos tecidos conforme estado “in vivo”. O tempo de fixação depende da solução fixadora usada. No caso do formol e do bouin gira em torno de 24 horas. Desidratação: é feita em álcool etílico de concentrações crescentes iniciando com álcool 70% e terminando com álcool absoluto. Tem como finalidade remover a água dos tecidos. A ação depende do tamanho da peça a ser desidratada, em media 5 horas. Clareamento: é feita com xilol, benzol ou toluol. Tem como objetivo embeber o material em substância miscível com a parafina. A duração média é de 3 horas. Inclusão: na microscopia óptica é feita com parafina. O objetivo da inclusão é facilitar a obtenção dos cortes pela penetração da parafina nos vasos e espaços intracelulares. O tempo de inclusão é de 3 a 4 horas. Corte: tem como finalidade a obtenção de cortes delgados que deixam passar a luz e que possam ser colocados em lâminas de vidros. Para fazer os cortes utiliza-se o micrótomo. Coloração: processo pelo qual utiliza-se vários ou determinados corantes. O objetivo é tornar bem visíveis os elementos que compõem os tecidos. O tempo de efeito dos corantes depende do tipo utilizado Montagem: tem como objetivo, transformar os cortes em preparados permanentes. A substância comumente utilizada para a montagem é o bálsamo do Canadá. 4. INTERPRETAÇÃO DE CORTES 4.1 Pontos básicos Todos os cortes de origem conhecida ou desconhecida devem primeiro ser examinados a olho nu. A tendência de querer ver mais, indo diretamente ao maior aumento nem sempre é uma boa escolha, é melhor progredir por etapas de aumento, observando as características estruturais especificas em cada campo. 4.2 Artefatos histológicos São alterações das células e tecidos resultantes do manuseio e/ou descuido do processamento da amostra. 5. QUESTIONÁRIO DE FIXAÇÃO Histórico da microscopia e citologia 1. Quem foram os possíveis inventores do microscópio óptico? Em que século? Qual era a profissão deles e em país viviam? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 4 2. Qual cientista aperfeiçoou o microscópio óptico? Qual o seu país de origem? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 3. Qual o nome e em que país nasceu o descobrir das células? O que realmente ele observou? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Técnicas e substâncias utilizadas em M.O e M.E. 1. Explique a função do micrótomo. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 2. O que são artefatos celulares? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 3. Que substâncias são utilizadas para se conseguir cortes delgados em microscopia óptica e microscopia eletrônica? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 4. O que são corantes celulares? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Capacidade dos sistemas ópticos 1. Diferencie poder de resolução de limite de resolução de um sistema óptico. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 2. O que determina a riqueza de detalhes de um microscópio de luz? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5 3. Qual a função das lentes oculares? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 4. Qual a função das lentes objetivas? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5. Que calculo é feito para sabermos o aumento real de um espécime observada a um microscópio óptico? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 6. O limite de resolução (LR) depende da abertura numérica (AN) de uma objetiva e do comprimento de onda utilizada. Sendo assim encontre o LR das objetivas de um sistema óptico. Dados: lente (4 X, AN – 0,10 µm); (10 X, AN – 0,25 µm); (40X, AN – 0,65 µm) e (100 X, AN – 1,25 µm). Abertura numérica do condensador: 1,25 µm. Equação: LR= K x λ / A.N da lente x A.N do condensador ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 7. Sabendo-se que o limite de resolução é diretamente proporcional ao comprimento de onda e inversamente proporcional à abertura numérica da objetiva, qual dos três microscópios você obteria uma melhor observação? Microscópio Ocular Objetiva A B C 20 X 10 X 15 X 10 X 20 X 20 X A.N da objetiva 0,15 µm 0,65 µm 0,10 µm Aumento total A.N do condensador 1,25 µm 1,25 µm 1,25 µm LR Justifique. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Preencha a cruzada 1. 2. 3. 4. 5. Principal fixador usado em microscopia eletrônica. Exemplo de corante ácido. Estruturas ricas em componentes básicos. Alterações produzidas nas células pelas técnicas utilizadas. Exemplo de fixador em microscopia óptica e eletrônica. 6 6. Moléculas ácidas, como o DNA e o RNA. 7. Primeira etapa para obtenção de um preparado permanente. 8. Seccionamento de estruturas em aparelho denominado micrótomo. 9. Substituição da água por soluções miscíveis no meio de inclusão. 10. Exemplo de corante básico. 11. Destruição das células por suas próprias enzimas. 12. Endurecimento do material biológico. Para saber mais sobre microscopia, pesquise os seguintes livros à disposição na biblioteca da UNIC. DE ROBERTS, E. M. F & HIB, J. Bases da biologia celular e molecular. 3ª ed. Rio de Janeiro: Guanabara Koogan, 2001. JUNQUEIRA, L. C. & CARNEIRO, J. Biologia celular e molecular. 8ª ed. Rio de Janeiro: Guanabara Koogan, 2005. JUNQUEIRA, L. C. & CARNEIRO, J. Histologia Básica. 10ª ed. Rio de Janeiro: Guanabara Koogan, 2004. 6. ORIENTAÇÃO PARA AULA PRÁTICA 6.1 Primeiros contatos com o laboratório a. b. c. d. e. Saiba que o laboratório é um local para trabalhos sérios e não para experimentos ao acaso Procure realizar somente os experimentos discutidos em aula. Leia as práticas com antecedência para obter melhores resultados. Não é permitido fumar em laboratório. Não troque produtos, objetos, aparelhos de uma mesa para outra sem a permissão dos professores ou técnicos do laboratório. f. Procure sempre participar das aulas práticas usando o guarda-pó (avental) g. Quando houver quebra ou danos nos materiais ou aparelhos, comunique aos professore sou técnicos responsáveis. 7 7. MICROSCÓPIO ÓPTICO 7.1 História da microscopia A microscopia é um processo básico de toda a biologia moderna, sendo responsável por algumas das mais importantes descobertas relacionadas com a vida, como é o caso da célula e de toda a sua estrutura e funcionamento. A história da microscopia começa com o fabrico das primeiras lentes óticas, através do polimento do vidro, pelo fiorentino Salvino d´Amato, em 1285. A idéia de combinar lentes para aumentar o tamanho dos objetos menores data de 1590 e deve-se a Zacharias Janssen, sendo, o primeiro microscópio por ele desenvolvido capaz de uma ampliação de cerca de 30x. A capacidade de ampliação foi evoluindo em conseqüência do aperfeiçoamento das lentes. No séc. XVII Antonie Van Leeuwenhoek (holandês) desenvolveu o microscópio simples capaz de ampliações de até 200x e medindo apenas 6,7 centímetros, com o qual o cientista fez a primeira observação de bactérias. Durante o séc. XVIII o microscópio tornou-se um objeto em moda, sendo fabricado por artífices com feitios e decorações ao gosto dos clientes, originando autênticas obras de arte e decoração. Ainda neste século, o microscópio passa a fazer parte do processo de ensino das classes nobres e ricas da sociedade. No entanto, apesar dos sucessivos aumentos de ampliação, as imagens obtidas continuavam a ser de qualidade inferior, devido às dificuldades em eliminar as aberrações cromáticas e distorções resultantes de imperfeições das lentes. Apenas no século XIX, com o aperfeiçoamento dos sistemas de fabricação de lentes, se conseguiu atingir o limite de resolução máximo possível utilizando luz visível. Surgem também neste século os primeiros microscópios binoculares. Para a melhoria das imagens obtidas com o microscópio ótico, foram também fundamentais o desenvolvimento de preparação do material biológico para observação, nomeadamente, as técnicas de coloração específica de organelas e estruturas celulares, de fixação, de inclusão e de corte. Os primeiros fabricantes e comércio dos microscópios surgem em meados do século XIX, sendo de destacar o de Camille-Sébastien Nachet, inaugurado em Paris em 1835, e o de Karl Zeiss, inaugurado na Alemanha em 1846. Em conseqüência do desenvolvimento da microscopia, foi possível a observação e descoberta de inúmeras estruturas e seres vivos microscópicos até então desconhecidos, como bactérias, protozoários e leveduras. Também graças ao desenvolvimento da microscopia, em 1835, Schleiden e Schwann, propõem as bases da teoria celular, primeiro grande princípio unificador da biologia, o qual postula que todos os organismos vivos são constituídos por células, sendo estas as unidades estruturais e funcionais dos mesmos. O aperfeiçoamento do microscópio ótico foi conduzido até um ponto tal que, a única limitação era o grande comprimento de onda da radiação (luz visível) utilizada para iluminação, este obstáculo impedia a obtenção de um maior poder de resolução. Esta dificuldade levou os cientistas a procurarem um modelo de microscópio que usando outro tipo de radiação para que a iluminação permitisse aumentar ainda mais a resolução. Em 1924, o físico Louis de Broglie, constata que um feixe de elétrons apresenta um comportamento idêntico aos raios luminosos, mas com um comprimento de onda 10.000x menor, o que lança os fundamentos da microscopia eletrônica, conjuntamente com a teoria do efeito de foco de um campo magnético ou eletrostático sobre um feixe de elétrons, desenvolvida em 1926 por Hans Bush, investigador da Universidade de Jena, a qual prova que é possível focar um feixe de elétrons com lentes magnéticas cilíndricas. Estavam assim elaboradas as bases teóricas do microscópio eletrônico, sendo o primeiro aparelho construído em 1931/1932 por Ernst Ruska e por Max Knoll. Em 1933 o microscópio eletrônico ultrapassava já o limite de resolução do microscópio ótico. No entanto, só após a Segunda Guerra Mundial o microscópio eletrônico se desenvolve em pleno, constituindo-se o Elmskop I, desenvolvido por Ernst Ruska e Bodo Van Bonier nos laboratórios da Siemens, como o mais famoso dos primeiros microscópios eletrônicos. A microscopia eletrônica teve um rápido desenvolvimento em poucos anos, graças a grandes aperfeiçoamentos técnicos que permitiram não apenas maiores valores de ampliação, mas também aumentos sucessivos da capacidade de resolução e da qualidade das imagens obtidas. Estes progressos foram também tornados possíveis graças ao aperfeiçoamento dos métodos de preparação do material biológico para observação, sendo desenvolvidas várias técnicas, como a de obtenção de cortes ultrafinos e a de fixação de estruturas celulares através do uso de resinas sintéticas, entre outras. Uma variante do microscópio eletrônico com grande interesse para a biologia, já que permite a obtenção de imagens de material não seccionado, é o microscópio eletrônico de varredura ou scanning desenvolvido pela primeira vez em 1965 pela empresa Cambridge Instruments. Fonte: http://www.infopedia.pt/$historia-da-microscopia acesso em 03/2011 8 7.2 Primeiros contatos com o microscópio a. b. c. d. e. Acenda a lâmpada do microscópio; Gire o revolver e encaixe a objetiva de menor aumento; Coloque a lâmina sobre a platina fixando-a com a presilha; Utilizando o charriot, percorra o campo (esquerda e direita, frente e traz) enquanto o observa; Gire novamente o revolver, observe o objeto em médio e depois em grande aumento, prestando atenção no campo; f. Ao terminar a observação, encaixe a objetiva de menor aumento, retire a lâmina, volte a platina à posição inicial (o mais longe possível das lentes objetivas) e cubra o microscópio. g. Evite deixar o microscópio ligado à rede de energia. 7.3 Cuidados com o microscópio a. O microscópio é um aparelho caro com o qual se deve tomar todo o cuidado. Siga sempre as instruções para o seu uso. b. O microscópio é um aparelho frágil e pode ser danificado. Evite transportá-lo de bancadas. c. As lentes do microscópio custam quase tanto quanto todas as outras partes juntas. Use sempre para limpá-las apenas lenços de papel. d. Evite molhar o microscópio ao usar preparações temporárias feitas com água ou outro líquido. e. Não toque com os dedos na lente ocular para não sujá-la. f. Não movimente a platina do microscópio com a objetiva de maior aumento encaixada: pode quebrar a lâmina. g. Depois de usar a objetiva com óleo de imersão, limpe-a com álcool-éter, bem como a lâmina. h. Quando não for mais usar o microscópio, encaixe a objetiva de menor aumento, desligue-o e cubra. i. Em caso de dúvidas, procurem os professores ou técnicos de laboratórios. j. A reparação dos microscópios só pode ser feita por técnicos ou assistência técnica especializada. Portanto, caso verifique algum defeito ao manuseá-lo, comunique ao professor ou ao técnico. k. Todo cuidado será necessário para conservação do material e local de estudo, porque outros acadêmicos o utilizarão. 8 - ROTEIRO RESUMIDO DE TÉCNICAS CITOLÓGICAS E HISTOLÓGICAS 8.1 Preparados histológicos permanentes São cortes de órgãos em finíssima espessura, colocados em lâmina para estudo da estrutura microscópica, podendo ser observado ao microscópio óptico. Em geral os órgãos dos varias animais, são espessos e precisam ser reduzidos em cortes delgados (translúcidos), porém, antes da montagem em lâminas o corte deve passar por determinados processos. 8.2 Processos de montagem de lâminas histológicas de rotina Fixação: é feita com misturas fixadoras. Os fixadores mais comumente usados são o formol a 10% e o bouin. A finalidade da fixação é preservar a morfologia e composição dos tecidos conforme estado “in vivo”. O tempo de fixação depende da solução fixadora usada. No caso do formol e do bouin gira em torno de 24 horas. Desidratação: é feita em álcool etílico de concentrações crescentes iniciando com álcool 70% e terminando com álcool absoluto. Tem como finalidade remover a água dos tecidos. A ação depende do tamanho da peça a ser desidratada, em media 5 horas. 9 Clareamento: é feita com xilol, benzol ou toluol. Tem como objetivo embeber o material em substância miscível com a parafina. A duração média é de 3 horas. Inclusão: na microscopia óptica é feita com parafina. O objetivo da inclusão é facilitar a obtenção dos cortes pela penetração da parafina nos vasos e espaços intracelulares. O tempo de inclusão é de 3 a 4 horas. Corte: tem como finalidade a obtenção de cortes delgados que deixam passar a luz e que possam ser colocados em lâminas de vidros. Para fazer os cortes utiliza-se o micrótomo. Coloração: processo pelo qual utiliza-se vários ou determinados corantes. O objetivo é tornar bem visíveis os elementos que compõem os tecidos. O tempo de efeito dos corantes depende do tipo utilizado Montagem: tem como objetivo, transformar os cortes em preparados permanentes. A substancia comumente utilizada para a montagem é o bálsamo do Canadá. 10 9. PRÁTICAS DE BIOLOGIA CELULAR 9.1 Conhecendo as partes de um microscópio óptico Data ____/____/____ Objetivo: Você deverá comparar o microscópio que tem em mãos com o desenho abaixo e responder as perguntas. 1. O microscópio que você está usando contém algumas partes iguais ao microscópio do desenho. Quais são estas partes? Quais são as suas funções? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ 2. Que estruturas apresentadas no desenho são inexistentes no microscópio que você está utilizando? Quais são as suas funções? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ __________________________________________________________________________ ________________________________________________________________________________ _______________________________________________________________________________ 11 9.2 Aprendendo a usar o microscópio Data ____/____/____ Materiais: Microscópio composto, lâminas, lamínulas, pequenos recipientes para água, conta-gotas, letras impressas de jornal. Procedimento: a) Recorte uma letra de jornal ou revista e coloque-a em uma lâmina limpa. Com um conta-gotas, coloque uma gota de água sobre a letra; b) Espere um momento e cubra-a com uma lamínula procedendo da seguinte maneira: coloque a lamínula em um ângulo de aproximadamente 45º com a lâmina e abaixe-a vagarosamente. Bata ligeiramente sobre a lamínula para remover qualquer bolha de ar que possa estar presente; c) Coloque a lâmina na platina do microscópio e fixa-a com as presilhas. Mova a lamínula de maneira que a letra fique no meio do orifício da platina. Focalize primeiramente com a objetiva de menor aumento, procedendo da seguinte forma: sem olhar pela ocular, aproxime a lâmina movendo o parafuso macrométrico. d) Olhando pela ocular, levante vagarosamente a objetiva, sempre usando o parafuso macrométrico, até que a letra seja focalizada. e) Compare a vista ao microscópio com a que você viu a olho nu. Mude para as objetivas de maior aumento comparando com a que você observou anteriormente e faça a seguir os desenhos vistos em todas as objetivas. 9.3 Noções de profundidade de campo Data ____/____/____ Materiais: fios de cabelo, água, lenço de papel, lâmina, lamínula. Procedimento: Obtenha dois fios de cabelo (claro e escuro). Corte pequenos pedaços e sobreponha-os, em cruz, sobre a lâmina de vidro. Sobre eles, pingue uma gota de água, retire o excesso com papel de filtro e coloque a lamínula. Coloque a lâmina sobre a platina. Utilize as objetivas de 4, 10 e 40. Dê o foco. Utilize o parafuso micrométrico para observar a variação de profundidade de campo. Analise, desenhe com objetiva de 40X e descreva as características das imagens quanto ao foco. Anotações: ________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 12 9.4 Uso da objetiva de imersão Data ____/____/____ Materiais: óleo de imersão, lenço de papel, lâminas com corte histológico. Procedimento: Colocar a lâmina com corte histológico na platina. Focalizar o material com a objetiva de menor aumento, dar o foco e, em seguida, com a objetiva de aumento médio. Sem movimentar a lâmina, girar o revólver do microscópio, de modo que nenhuma objetiva fique sobre o material. Colocar sobre a lâmina uma gota de óleo de imersão. Desenhar observando na objetiva de imersão. Para focar somente o botão micrométrico!!!!!!!! Anotações: ________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 9.5 Observação de procariotos - Bactéria da coalhada (iogurte - Bacilo lacteo) Data ____/____/____ Materiais: coalhada, lâmina, conta-gotas, álcool, clorofórmio, azul de metileno, água destilada, aquecedor. Procedimento: Sob uma lâmina coletar uma pequena porção de coalhada. Pingar uma gota de água e dissolver bem. Fazer um esfregaço, tomando-se o cuidado de identificar o lado da lâmina no qual se encontra o esfregaço. Secar bem a lâmina, podendo utilizar chapa aquecida. Pingar 3-4 gotas da mistura álcool-clorofórmio. Secar o preparado movimentando a lâmina no ar. Em seguida, pingar 2 gotas de azul de metileno, espalhando-o pela lâmina. Aguardar 5 minutos, lavando com água de preferência destilada, mas pode ser em água corrente. Limpar o excesso de água e levar ao microscópio para observação em objetiva de 10x e 40x. Fechar um pouco o diafragma após a localização do material. Represente o material observado. Anotações: _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ _____________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 13 9.6 Observação de organismos microscópicos em cultura mista Data ____/____/____ Materiais: conta-gotas ou pipeta Pasteur, lâmina, lamínula e infusão (ver abaixo com preparar a infusão). Procedimento: coloque sobre uma lâmina uma ou duas gotas da infusão, e, sobre esta, a lamínula. Leve ao microscópio e com a objetiva de 4x, 10x e 40x, observe o preparado. Desenhe. Preparação de infusões 01: alguns dias antes da data prevista para observação em aula prática coloque uma boa quantidade de vegetais em um vasilhame de vidro (Becker), previamente limpo, onde não tenha sido colocado nenhum fixador (formol, álcool, etc). Adicione água, de preferência obtida em uma fonte natural. Cubra o recipiente com gaze e prenda a mesma com cordão ou elástico. Coloque a preparação em local iluminado, não diretamente à luz solar. Preparação de infusões 02: Com antecedência de 6 a 7 dias prepare as culturas A e B. Coloque alface picada em uma frasco (A) e grama picada em outro (B). Acrescente a ambos alguns grãos de arroz cru e 100 ml de água filtrada. Deixe os frascos em local arejado e iluminado, sem exposição direta ao sol. Depois de alguns dias cobrir os frascos com papel filtro ou algodão. Coloque uma gota da cultura (A ou B - colha a película que se forma na superfície ou o sedimento do fundo) em uma lâmina, cubra com lamínula e observe ao microscópio com objetivas de 10x e 40x. Esquematize as observações. 14 15 9.7 Observação de células de fermento Data ____/____/____ Materiais: lâmina, lamínula, conta-gotas, placa de petri, fermento tipo fleischmann e açúcar. Procedimento: tome uma pitada de fermento, dissolva em um pouco de água. Junte o açúcar comum e deixe descansar por uns 15 a 20 minutos. Decorrido esse tempo coloque uma gota da suspensão numa lâmina, cubra com lamínulas, examine a faça o desenho. 9.8 Observação de células de cebola Data ____/____/____ Materiais: microscópios, lâmina, lamínula, pinça, cebola, corante. Procedimento: corte uma cebola ao meio e observe a disposição das escamas; corte-as outra vez ao meio, observe e separe as escamas. Com o auxílio da pinça ou mesmo à unha, retire uma finíssima película que reveste inteiramente a escama (epiderme da escama). Com um pedaço da epiderme prepare uma lâmina para observar ao microscópio. Se você tiver dificuldade para observar as estruturas das células poderá usar um corante (azul de metileno ou giemsa). Tente observar o núcleo e o nucléolo, observe o citoplasma. Note que as células estão limitadas por paredes bem nítidas e definidas. Desenhe. 16 9.9 Especificidade da membrana plasmática (observação macroscópica de osmose) Data ____/____/____ Materiais: batata inglesa, cloreto de sódio, placas de petri, Becker, provetas pequenas. Objetivo: demonstrar os mecanismos de transportes através da membrana celular. Procedimento: cortar a batata em fatias e colocá-las imersas em solução a 0,1%; 1% e 10% de cloreto de sódio. Faça um relatório discutindo o observado. Relatório: ______________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ ______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ ______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ 9.10 Transporte passivo pela membrana plasmática (simulação de osmose) Data ____/____/____ Materiais: filme de PVC, funil, becker, água (se possível destilada), suco artificial em pó (escuro). Objetivo: demonstrar o mecanismo de transporte pela membrana plasmática. Relate o observado. Relatório: ______________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ ______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ 17 _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ ______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ 9.11 Plasmólise e deplasmólise (observação microscópica de osmose) Data ____/____/____ Materiais: lâmina, lamínula, pincel, pinça, conta-gotas ou pipeta Pasteur, cloreto de sódio (NaCl), cebola. Procedimento: retire a epiderme interna de uma cebola colocando-a sobre uma lâmina contendo uma gota de água de preferência destilada. A seguir distenda a película com um pincel, e, coloque sobre ela a lamínula. Na mesma lâmina, sem desfazer o primeiro procedimento coloque outra película de cebola e ao invés de água, deposite solução de NaCl a 10%. Após alguns minutos (3 a 5) observe o plasmalema se afastar da rede celular. Observe também o que acontece com o vacúolo. Para observar a deplasmólise, substitui-se a solução de NaCl por água destilada. Desenho o que você observou. 9.12 Esfregaço de sangue Data ____/____/____ Materiais: lâmina, lamínula, lancetas ou agulhas esterilizadas, algodão, álcool, éter, giemsa, luvas. Procedimento: pique o dedo anular da mão esquerda, previamente limpo com álcool e coloque uma gota de sangue na extremidade de uma lâmina. Com o auxílio de outra lâmina, conduza o material por toda a lâmina num ângulo de 45º. Faça um esfregaço bem fino. Seque a lâmina ao ar e coloque sobre ela algumas gotas de uma mistura de álcool e éter 50%, deixando-a sobre a lâmina de 2 a 5 minutos para fixar bem. Core a lâmina colocando sobre ela algumas gotas de giemsa (deve permanecer de 15 a 20 minutos). A seguir lave em água corrente até retirar os excessos do corante. Seque a lâmina ao ar, leve o esfregaço ao microscópio, observe e desenhe com a objetiva de 40X. 18 9.13 Movimento das células sangüíneas Data ____/____/____ Materiais: lâmina, lamínula, lanceta, luvas. Procedimento: pique o dedo e coloque uma gota de sangue sobre uma lâmina e cubra com uma lamínula, examine ao microscópio. Não é necessário desenhar. Anotaçôes:______________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ 9.14 Equilíbrio, crenação e plasmoptise em hemácias (observação microscópica de osmose) Data ____/____/____ Materiais: lâmina, lamínula, lancetas ou sangue coletado previamente, luvas. Procedimento: coloque uma gota de sangue numa lâmina, adicione uma gota de solução salina a 0,9% e observe ao microscópio e faça anotações. Monte outra lâmina utilizando solução a 0,4%, observe ao microscópio e faça anotações. Monte uma terceira lâmina, desta vez com solução salina a 1,5%, observe ao microscópio e faça anotações. Anotaçôes:______________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ ______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ _______________________________________________________________________________________ UERJ - Colocando-se hemácias humanas em diferentes soluções com concentrações iônicas variáveis, pode-se exemplificar a influência que o grau de permeabilidade da membrana plasmática à água exerce sobre a célula. As conseqüências desse experimento estão demonstradas nos esquemas adiante. O esquema que representa o comportamento da hemácia, ao ser colocada em um meio hipertônico, é o de número: a) 1 b) 2 c) 3 d) 4 19 UDESC - A figura a seguir representa uma hemácia (A) que sofre alterações quando mergulhada em um meio hipertônico (1), ou quando mergulhada em um meio hipotônico (2). Com base nessas informações, RESPONDA: a) Se uma dose de solução salina, com concentração muito superior à do sangue, for injetada em um cão, qual dos fenômenos, anteriormente representados, pode ocorrer em suas hemácias? JUSTIFIQUE sua resposta. ________________________________________________________________________________________________ ________________________________________________________________________________________________ ________________________________________________________________________________________________ ________________________________________________________________________________________________ b) É correto afirmar que houve, tanto em (1) como em (2), o fenômeno da osmose? JUSTIFIQUE sua resposta. ________________________________________________________________________________________________ ________________________________________________________________________________________________ ________________________________________________________________________________________________ ______________________________________________________________________________________ 20 9.15 Observação de células da mucosa oral Materiais: abaixadores de madeira ou palito de dente. Procedimento 01: com o abaixador ou palito raspe a mucosa bucal. Faça um esfregaço do material obtido em uma lâmina adicione uma gota de água destilada e cubra com uma lamínula. Examine e desenhe. Procedimento 02: utilizando um abaixador de madeira, raspe a mucosa oral e faça um esfregaço. Deixe a lâmina secar movimentado-a no ar. Core o material com azul de metileno e espere 5 minutos, retire o excesso de corante com água corrente, espera a lâmina secar naturalmente ou movimentando-a. Observe ao microscópio, esquematize com as objetivas de 10X e 40X. 9.16 Ciclose em pelo estaminal Data ____/____/____ Materiais: flores de Tradescantia zebrina (antiga Zebrina pendula), Stereasea sp ou Helodea sp. , lâmina, lamínula, conta-gotas, becker, pinça e água. Procedimento: abra a corola de Zebrina sp. e retire com uma pinça um ou mais estames. Note que de sua base saem alguns. Coloque os estames (pelos) numa lâmina, adicione uma gota de água e cubra com uma lamínula. Observe ao microscópio os cloroplastos e seu movimento (ciclose). Desenhe. 21 9.17 Organelas citoplasmáticas de célula animal e vegetal Data ____/____/____ Procedimento: com base no desenho abaixo, você deverá indicar, na tabela abaixo, as organelas que pertencem às células vegetais e/ou animais, fazendo um X no local indicado. Em seguida, deverá responder às perguntas. Organelas Citoplasmáticas Nome 1.Núcleo 2.Mitocôndrias 3.Cloroplastos 4.Retículo Endoplasmático Liso 5.Retículo Endoplasmático Rugoso 6.Centríolo Figura Célula Vegetal Animal 22 7.Complexo de Golgiense 8.Parede Celular 9. Membrana Celular 10.Lisossomas 1. Cruzadas: mundo microscópico 1. Unidade estrutural e funcional básica de formação dos seres vivos. 2. Estrutura que compõe uma célula, responsável por funções específicas. 3. Instrumento ótico utilizado para observação dos seres vivos ou de partes deles que não são visíveis a olho desarmado. 4. Solução que pode dar ou modificar a cor de uma substância, organismo ou partes dele. 5. Material retangular de vidro utilizado em preparações de microscopia para observação de pequenos seres vivos ou parte deles. 6. Lâmina diminuta colocada sobre uma lâmina maior, para facilitar a visualização de materiais em microscópio. 23 10. QUESTIONÁRIO DAS PRÁTICAS 9.1 Conhecendo as partes de um microscópio óptico a. Local onde as objetivas são fixadas b. Estrutura que sustentam as partes ópticas do microscópio. c. Lentes que ficam próximos aos olhos do observador. d. Estrutura que permite aos microscopistas percorrer vários campos de uma lâmina que contém uma espécime. 9.2 Aprendendo a usar o microscópio a. Uma vez a lâmina pronta, cite o procedimento correto para iniciar a observação ao microscópio. b. Após fixar a lâmina à platina, utilizando a presilha, que botão você utilizará para fazer a aproximação rápida da preparação à uma das objetivas? c. Que botão é aconselhável usar ao mudar de uma objetiva de aumento menor para a de um aumento maior? d. Ao terminar uma aula prática de microscopia, que procedimento você recomenda à pessoa que está utilizando o microscópio? Por quê? 9.4 Uso da objetiva de imersão a. O que acontece em relação à distância de trabalho, à medida que são utilizadas objetivas de maior aumento? b. O que acontece com a luminosidade e ao tamanho do campo, nas mesmas condições? E com o poder de penetração da objetiva? c. Qual a relação existente entre a distância focal da objetiva e da ocular com o aumento e a distância do trabalho? d. Qual a relação existente entre a distância focal da objetiva e seu poder de penetração. e. Porque é necessário o uso do óleo de imersão com objetivas de certo aumento? Qual o aumento da objetiva de imersão de seu microscópio? 9.5 Bactéria da coalhada (iogurte - Bacilo lacteo) a. Por que se utilizou o corante azul de metileno? b. Qual a função da mistura álcool/éter? c. A que reino de seres vivos pertencem os organismos observados? d. De as características citológicas das bactérias 9.6 Observação de organismos microscópicos em cultura mista a. Quais são as estruturas locomotoras de amebas e paramécios? b. Qual é o processo utilizado pelas amebas para a sua alimentação? O que é clasmocitose? c. Cite um agente etiológico causador de amebíase humana. d. De as características citológicas dos protistas 9.7 Observação de células de fermento a. De as características citológicas gerais dos fungos 24 b. Qual o personagem e a relação histórica dos fungos com a indústria farmacêutica? Que outro grupo celular estava envolvido nesta descoberta histórica? c. Você aconselharia o uso de antibiótico para uma pessoa que comprovadamente apresenta contaminação por influenza? Justifique a sua resposta. 9.8 Observação de células de cebola a. De acordo com a propriedade da luz, explique por que ao utilizar o corante você pode observar melhor o núcleo e estruturas delimitando as células de Allum cepa? b. Além da membrana plasmática que outra estrutura envolve as células vegetais? Qual a função dessa estrutura? c. O que significa dizer que as células da epiderme da cebola são justapostas? 9.9 Especificidade da membrana plasmática (transporte) a. O que significa dizer que a membrana tem especificidade sobre alguns compostos? 9.10 Transporte passivo pela membrana plasmática (osmose) a. Qual a vantagem da célula ao realizar o transporte passivo? b. Enuncie osmose. 9.11 Plasmólise e deplasmólise a. O que é plasmólise e deplasmólise? Pode se usar este mesmo nome para fenômenos semelhantes que ocorrem em células animais? b. Uma célula deplasmolisada pode voltar a uma situação normal? Justifique-se. O que ocorrerá se esta célula for submetida a uma solução hipertônica? c. Por que uma célula vegetal, a ser submetida numa solução hipotônica, não se rompe? Ocorre o mesmo com uma célula animal? Justifique a sua resposta. 9.12 Esfregaço de sangue a. Quais os constituintes normais do sangue humano? Cite a função de cada um b. No esfregaço que você fez, leucócitos e eritrócitos ocorrem em proporções equivalentes? c. Você conseguiu observar os núcleos das hemácias? E dos leucócitos? Por quê? d. Há alguma diferença morfológica entre os núcleos dos leucócitos? 9.13 Movimento das células sangüíneas (sem gasto de ATP) a. O que significa dizer que as células sangüíneas são transportadas b. De onde é retirado o ATP para o metabolismo celular? Qual é a organela responsável por esse fenômeno? c. O que é leucopenia e leucocitose? d. Por que numa virose ou alergia do trato respiratório, ocorre aumento de leucócitos na circulação da pessoa afetada? 9.14 Equilíbrio, crenação e plasmoptise 9.15 Observação de células da mucosa oral Por que se utilizaram células da mucosa oral? Você utilizou alguma técnica especial para visualizar o núcleo dessas células? Qual? sem gasto de ATP? 25 11. REFERENCIAS BIBLIOGRÁFICAS Bibliografia pesquisada DE ROBERTIS, E. M. F & HIB, J. Bases da Biologia Celular e Molecular. 3ª. ed. Rio de Janeiro, Guanabara-Koogan, 2001. FAVARETTO, J. A & MERCADANTE, C. Biologia. 1ª. ed. São Paulo, Moderna, 1999. JUNQUEIRA, L.C. & CARNEIRO, J. Biologia Celular e Molecular. 7ª.ed. Rio de Janeiro, Guanabara-Koogan, 2000. PAULINO, W. R. Biologia: citologia e histologia. 1ª ed. São Paulo. Ática, 2005. Bibliografia recomendada CARVALHO, H. F. A.; RECCO-PIMENTEL, S. M. A célula 2001. Barueri: Manole, 2001. CORMACK, D. Fundamentos de Histologia. 2ª ed. Rio de Janeiro. Guanabara Koogan, 2001. JUNQUEIRA, L. C. & CARNEIRO, J. Histologia Básica. 10. ed. Rio de Janeiro: Guanabara Koogan, 2004.
Download